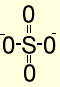- •1. Общие методические указания
- •Рекомендуемая литература
- •2. Методические указания по изучению дисциплины
- •Названия солей по международной номенклатуре Средняя или нормальная соль
- •Кислая соль
- •Основная соль
- •Названия солей по русской номенклатуре
- •Кислая соль
- •Основная соль
- •Примечание:
- •Энергетические уровни и электронная конфигурация атома
- •Квантовые числа
- •Магнитные и энергетические состояния атома
- •Размеры атома
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Геометрические формы молекул
- •Тема 4. Химическая термодинамика и кинетика
- •4.1 Химическая термодинамика
- •4.2. Химическая кинетика
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 5. Растворы
- •5.1. Теория электролитической диссоциации. Реакции ионного обмена
- •5.2. Водородный показатель
- •5.3. Растворимость и гидролиз
- •5.4. Растворы неэлектролитов и электролитов
- •Растворы неэлектролитов
- •Растворы электролитов
- •Активность и ионная сила
- •5.5. Буферные растворы
- •Задачи и упражнения
- •0,2432 Г эМе --------0,0200 г водорода.
- •Вопросы для самопроверки
- •Тема 6. Окислительно-восстановительные реакции
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 7. Общие свойства металлов. Электрохимия. Коррозия металлов Электролиз
- •7.1 Основные понятия электрохимии.
- •Уравнение Нернста
- •7.2 Коррозия.
- •7.3 Электролиз
- •7.4 Химические источники тока
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 8. Агрегатные состояния вещества. Коллоидные системы Комплексные и высокомолекулярные соединения
- •8.1 Агрегатные состояния вещества
- •8.2 Коллоидные системы
- •Классификация дисперсных систем по агрегатному состоянию
- •Характеристика дисперсных систем
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 9. Обзор свойств элементов и их соединений. Минеральные удобрения
- •Тема 10. Органические соединения.
Геометрические формы молекул
Когда говорят о формах молекул, прежде всего имеют в виду взаимное расположение в пространстве ядер атомов. О форме молекулы имеет смысл говорить, когда молекула состоит из трех и более атомов (два ядра всегда находятся на одной прямой). Форма молекул определяется на основе теории отталкивания валентных (внешних) электронных пар. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии). При этом необходимо иметь в виду следующие утверждения теории отталкивания.
1. Наибольшее отталкивание претерпевают неподеленные электронные пары. 2. Несколько меньше отталкивание между неподеленной парой и парой, участвующей в образовании связи.
3. Наименьшее отталкивание между электронными парами, участвующими в образовании связи. Но и этого бывает недостаточно, чтобы развести ядра атомов, участвующих в образовании химических связей, на максимальный угол.
В качестве примера рассмотрим формы водородных соединений элементов второго периода: BeH2, BH3, CH4, C2H4, C2H2, NH3, H2O. Начнем с определения формы молекулы BeH2. Изобразим ее электронную формулу: H:Be:H,
из которой ясно, что в молекуле отсутствуют неподеленные электронные пары. Следовательно, для электронных пар, связывающих атомы, есть возможность оттолкнуться на максимальное расстояние, при котором все три атома находятся на одной прямой, т.е. угол HBeH составляет 180°. Молекула BH3 состоит из четырех атомов. Согласно ее электронной формуле в ней отсутствуют неподеленные пары электронов:
![]()
Молекула приобретет такую форму, при которой расстояние между всеми связями максимально, а угол между ними равен 120°. Все четыре атома окажутся в одной плоскости – молекула плоская:
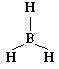
Электронная формула молекулы метана выглядит следующим образом:

Все атомы данной молекулы не могут оказаться в одной плоскости. В таком случае угол между связями равнялся бы 90°. Есть более оптимальное (с энергетической точки зрения) размещение атомов – тетраэдрическое. Угол между связями в этом случае равен 109°28'. Электронная формула этена имеет вид:
![]()
Естественно, все углы между химическими связями принимают максимальное значение – 120°. Очевидно, что в молекуле ацетилена все атомы должны находиться на одной прямой:
H:C:::C:H
Отличие молекулы аммиака NH3 от всех предшествующих состоит в наличии в ней неподеленной пары электронов у атома азота:

Как уже указывалось, от неподеленной электронной пары более сильно отталкиваются электронные пары, участвующие в образовании связи. Неподеленная пара располагается симметрично относительно атомов водорода в молекуле аммиака:
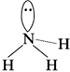
Угол HNH меньше, чем угол HCH в молекуле метана (вследствие более сильного электронного отталкивания). В молекуле воды неподеленных пар уже две:
![]()
Этим обусловлена уголковая форма молекулы:

Как следствие более сильного отталкивания неподеленных электронных пар, угол HOH еще меньше, чем угол HNH в молекуле аммиака. Приведенные примеры достаточно наглядно демонстрируют возможности теории отталкивания валентных электронных пар. Она позволяет сравнительно легко предсказывать формы многих как неорганических, так и органических молекул.
Задачи и упражнения
1. Используя приведенные данные привести структурные формулы кислотных остатков для следующих кислот: серная кислота H2SO4, соли – сульфаты, степень окисления серы +6; тритионовая кислота H2S3O6, соли – тритионаты, степень окисления серы +6,-2.
Помните, что химические связи в структурной формуле обозначаются черточками, их число равно валентности элемента в данном химическом соединении.
Решение: Формальные структуры
|
|
|
|
Сульфат |
тритионат |
Вопросы для самопроверки
1. Какие виды связей можно отнести к химическим?
2. Какие два основных подхода к рассмотрению химической связи вам известны? В чем состоит их отличие?
3. Дайте определение валентности и степени окисления.
4. В чем состоят отличия простой ковалентной, донорно-акцепторной, дативной, металлической, ионной связей?
5. Как классифицируют межмолекулярные связи?
6.Что такое электроотрицательность? Как она изменяется при продвижении в периодической таблице Д.И.Менделеева сверху вниз и слева направо?
7. Используя метод валентных связей, объясните строение водородных соединений элементов 2-го периода.