
- •Учебное пособие
- •Раздел 1. Структура и свойства ферментов
- •Инженерная энзимология. Иммобилизованные ферменты. Новые пути практического использования ферментов. Применение ферментов в промышленности, сельском хозяйстве, медицине
- •Принцип классификации ферментов. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Основные положения систематической и тривиальной номенклатуры ферментов
- •Способы количественного выражения активности ферментов. Единицы активности. Удельная и молекулярная активность
- •Методы определения активности ферментов: колориметрический, спектрофотометрический, флуориметрический, манометрический, биолюминесцентный и др.
- •Прямой и непрямой оптический тест Варбурга. Расчет ферментативной активности при определении по конечной точке и при кинетическом определении
- •Лекция 1.2 выделение и очистка ферментов
- •Разрушение клеток и экстракция белков
- •Тепловая денатурация
- •Осаждение белков
- •Гель-фильтрация
- •Разделение белков путем адсорбции
- •Выбор ионообменника
- •Элюция адсорбированного белка
- •Аффинная хроматография
- •Гидрофобная хроматография
- •Металлохелатная аффинная хроматография
- •Высокоэффективная жидкостная хроматография
- •Электрофорез
- •Изоэлектрическое фокусирование
- •Капиллярный электрофорез
- •Двумерные системы электрофореза
- •Кристаллизация белков
- •Лекция 1.3 уровни структурной организации ферментов
- •Многостадийный процесс образования пространственной структуры белка
- •Механизмы регуляции процесса сворачивания полипептидной цепи внутри клетки
- •Ферменты, участвующие в фолдинге белка
- •Специальные белки, увеличивающие эффективность сворачивания полипептидной цепи в нативную конформацию
- •Посттрансляционная модификация белка
- •Роль доменов в пространственной организации молекул ферментов
- •Увеличение числа доменов в ферменте и усложнение взаимодействий между ними
- •Роль доменов в формирование активного центра фермента
- •Роль доменов в регуляции ферментативной активности
- •Роль доменов в связывание ферментов с мембранами
- •Полифункциональные ферменты
- •Бифункциональные ферменты, катализирующие реакции одного метаболического пути
- •Бифункциональные ферменты, катализирующие противоположно направленные реакции
- •Лекция 1.4 Кофакторы ферментов и их роль в катализе Коферменты, простетические группы, ионы металлов
- •Классификация кофакторов
- •Функции кофакторов
- •Кофакторы окислительно-восстановительных процессов Никотинамидные кофакторы
- •Кофакторы переноса групп Коферменты – производные пиридоксина
- •Кофакторы процессов синтеза, изомеризации и расщепления с-с связей Биотин
- •Роль металлов в функционировании ферментов
- •Лекция 1.5. Топография активных центров простых и сложных ферментов
- •Методы изучения активных центров ферментов
- •Раздел 2. Кинетика и термодинамика
- •Ферментативных реакций
- •Лекция 2.1.
- •Кинетика химических реакций
- •Скорость химической реакции
- •Основной постулат химической кинетики ‒ закон действия масс
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции третьего порядка
- •Уравнения односторонних реакций 0-го, 1-го и 2-ого порядка
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Молекулярность элементарных реакций
- •Методы определения порядка реакции
- •Зависимость скорости реакции от температуры. Уравнения Вант-Гоффа и Аррениуса.
- •Катализ
- •Лекция 2.2. Стационарная кинетика ферментативный реакций
- •Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Лекция 2.3. Ингибиторы ферментов.
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Бесконкурентное ингибирование
- •Смешанный тип ингибирования
- •Субстратное ингибирование
- •Методы определения константы ингибирования. Метод Диксона
- •Лекция 2.4 Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •Методы определения коэффициента Хилла
- •Раздел 3.Механизмы ферментативного катализа
- •Сущность явления катализа
- •Стадии образования фермент-субстратного комплекса
- •Природа сил, стабилизирующих различные конформационные состояния ферментсубстратного комплекса
- •Электростатические взаимодействия
- •Водородные связи
- •Вандерваальсовы взаимодействия
- •Гидрофобные взаимодействия
- •Факторы, определяющие эффективность и специфичность ферментативного катализа
- •Физико-химические механизмы ферментативного катализа
- •Лекция 3.2
- •Механизм действия гидролаз на примере карбоксипептидазы а
- •Связывание субстрата карбоксипептидазой а
- •Работы Липскомба с сотрудниками по установлению молекулярного механизма действия кпа
- •Методы для изучения механизма действия ферментов
- •Лекция 3.3 Специфичность – уникальное свойство ферментов
- •Относительная или групповая специфичность действия
- •Абсолютная специфичность действия
- •Стереоспецифичность ферментов
- •Концепция стерического соответствия «ключ-замок»
- •Концепция индуцированного соответствия
- •Раздел 4. Контроль активности ферментов лекция 4.1. Ферменты в клетке и организованных системах
- •Распределение ферментов в клетке
- •Ферменты, присутствующие в ядре
- •Ферменты митохондрий
- •Лизосомальные ферменты
- •Ферменты эндоплазматического ретикулума
- •Ферменты, локализованные в цитозоле
- •Мембранные ферменты
- •Уровни структурной организации ферментов в клетке
- •Мультиферментные комплексы
- •Пируватдегидрогеназный комплекс
- •Мультиферментные конъюгаты
- •Метаболоны
- •Лекция 4.2 Изостерические и аллостерические механизмы регуляции активности ферментов
- •Изостерическая регуляция
- •Изоферменты
- •Лекция 4.3 ковалентная модификация ферментов и ее типы
- •Лекция 4.4
- •Регуляция количества ферментов в клетке
- •Контроль количества ферментов в клетке – процесс, зависящий от соотношения скоростей их биосинтеза и деградации.
- •Время полужизни различных ферментов
- •Фермент
- •Аминокислоты
- •Биосинтез ферментов и его регуляция на генетическом уровне. Конститутивные и индуцибельные (адаптивные) ферменты. Репрессия и индукция биосинтеза ферментов
- •Убиквитин-протеосомный путь деградации белков у эукариот. Убиквитин – белок, маркирующий белки для деградации. Строение 26s протеосомы
- •Раздел 5. Прикладное значение ферментов лекция 5.1. Генетическая инженерия ферментов
- •Использование рекомбинантных ферментов
- •Лекция 5.2 Ферменты в медицине (часть I)
- •Энзимодиагностика Органная специфичность в распределении ферментов
- •Ферменты сыворотки крови
- •Факторы, влияющие на уровень ферментов во внеклеточной жидкости
- •Диагностическое значение снижения ферментативной активности
- •Неспецифическое повышение ферментативной активности
- •Применение ферментов в качестве аналитических реагентов
- •Лактатдегидрогеназа
- •Лекция 5.3 Ферменты в медицине (часть II) Энзимопатии
- •Врождённые (наследственные) энзимопатии
- •Механизм возникновения наследственных энзимопатий
- •Блок обмена веществ
- •Примеры наследственных энзимопатий
- •Приобретённые энзимопатии
- •Энзимотерапия Использование ферментов в качестве лекарственных препаратов
- •Использование ингибиторов ферментов в качестве лекарственных препаратов
- •Библиографический список
Биосинтез ферментов и его регуляция на генетическом уровне. Конститутивные и индуцибельные (адаптивные) ферменты. Репрессия и индукция биосинтеза ферментов
Первичная структура фермента, как и любого другого белка, определяется той информацией, которая записана в информационной (матричной) РНК (мРНК) и считывается с помощью трехбуквенного (триплетного) кода. Нуклеотидная последовательность мРНК в свою очередь определяется комплементарной последовательностью оснований ДНК-матрицы, т.е. соответствующего гена. В результате мутаций нуклеотидная последовательность ДНК может измениться, и будут синтезироваться белки с измененной первичной структурой. Если новая аминокислота сильно отличается по своим свойствам от исходной, изменения могут охватить высокие уровни структурной организации и может произойти частичная или полная утрата каталитической активности (впрочем, в редких случаях наблюдается, напротив, ее повышение). Мутации в различных генетических локусах могут приводить к нарушению синтеза самых разных ферментов и тем самым к развитию многих генетических заболеваний.
Клетки могут синтезировать специфические ферменты в ответ на присутствие специфических низкомолекулярных индукторов. Индукцию ферментов можно проиллюстрировать на следующем примере. Клетки Escherichia coli, выращенные на глюкозе, не способны сбраживать лактозу из-за отсутствия фермента -галактозидазы, гидролизующей лактозу, которая распадается на глюкозу и галактозу. Если в питательную среду добавить лактозу или некоторые другие -галактозиды, то индуцируется синтез -галактозидазы, и культура клеток обретает способность сбраживать лактозу.
Индуктор (лактоза) является субстратом индуцируемого белка (-галактозидазы). Многие индукторы одновременно служат субстратами ферментов, которые они индуцируют, однако в роли индукторов могут выступать и соединения, структурно сходные с субстратом, но сами не являющиеся субстратами. И наоборот, соединение может быть субстратом, но не являться индуктором. Нередко какое-либо соединение индуцирует сразу несколько ферментов данного катаболического пути. В этих случаях говорят, что структурные гены, кодирующие группу катаболических ферментов, составляют оперон и все ферменты, кодируемые генами оперона, индуцируются единственным индуктором (координированная индукция). Способность регулировать синтез ферментов с помощью того или иного питательного вещества позволяет бактерии использовать это питательное вещество с максимальным для себя преимуществом; в то же время «ненужные» ферменты бактерия не синтезирует.
Ферменты, концентрация которых в клетке не зависит от добавления индукторов, называются конститутивными. Данный фермент может быть конститутивным для одного штамма, индуцируемым для другого и вообще отсутствовать в третьем. Обычно клетки содержат небольшое, но измеримое количество соответствующего фермента даже в отсутствие индуктора. Это – базовый уровень. Величина отклика данного организма на введение индуктора определяется генетически. При индукции различных штаммов может наблюдаться повышение содержания фермента, варьирующее от двукратного до тысячекратного. Таким образом, содержащаяся в клетке наследственная генетическая информация определяет и характер, и величину реакции на введение индуктора. Следовательно, понятия «конститутивный» и «индуцируемый» относительны: они характеризуют лишь крайние точки всего спектра возможных реакций.
Индукция ферментов наблюдается и у эукариот. Примерами индуцируемых ферментов у млекопитающих являются триптофанпирролаза, треониндегидраза, тирозин--оксоглутарат-трансаминаза, инвертаза, ферменты цикла мочевины, HMG-СоА-редуктаза и цитохром Р-450.
Бактерии, способные синтезировать определенный метаболит, при наличии этого метаболита в среде могут приостановить его синтез в результате репрессии. В этом случае небольшая молекула, например пурин или аминокислота, действуя как корепрессор, блокирует синтез ферментов, участвующих в биосинтезе самого корепрессора. Например, добавление гистидина в среду, на которой растет бактерия Salmonella typhimurium, подавляет (репрессирует) синтез всех ферментов биосинтеза гистидина; добавление в среду лейцина репрессирует синтез первых трех ферментов, которые участвуют исключительно в биосинтезе лейцина. В обоих случаях гены ферментов, ответственных за биосинтез данного метаболита, образуют оперон: добавление в среду конечного продукта биосинтеза, гистидина или лейцина, вызывает координированную репрессию. Координированная репрессия наблюдается не для всех путей биосинтеза. После удаления из среды корепрессора или же при истощении его запасов биосинтез соответствующих ферментов возобновляется. Это явление называют дерепрессией. Дерепрессия может быть координированной и некоординированной.
Приведенные выше примеры иллюстрируют репрессию конечным продуктом по принципу обратной связи, характерную для процессов биосинтеза в бактериях. Сходное явление – катаболитная репрессия – состоит в том, что одно из промежуточных соединений в цепочке катаболических ферментативных реакций репрессирует синтез катаболических ферментов. Оно было впервые обнаружено при изучении культуры Е. coli, растущей на среде, которая содержит в качестве источника углерода не глюкозу, а другое соединение (X). Добавление глюкозы репрессировало синтез ферментов, участвующих в катаболизме X. Это явление вначале называли «эффект глюкозы», но потом обнаружилось, что сходные эффекты могут вызывать и другие окисляемые питательные вещества; поэтому был предложен термин «катаболитная репрессия». Катаболитная репрессия осуществляется при участии сАМР.
В разветвленных процессах биосинтеза, например при биосинтезе аминокислот с разветвленными боковыми цепями или аминокислот семейства аспартата, ферменты начальных стадий участвуют в биосинтезе нескольких аминокислот. Если в среду, на которой растут бактерии, добавить лизин, репрессируется синтез ферментов, участвующих исключительно в биосинтезе лизина (EnzL). Добавление в среду треонина вызывает репрессию ферментов, участвующих только в биосинтезе треонина (EnzT). Это – примеры простой репрессии конечным продуктом. В то же время ферменты Enz1 и Enz2 участвуют одновременно в биосинтезе и лизина, и треонина. Если бы репрессию их синтеза вызывал каждый из конечных продуктов по отдельности, то наблюдался бы недостаток другой аминокислоты. Если же в среду добавить одновременно и лизин, и треонин, то ферменты Enz, и Enz2 окажутся излишними; их репрессия была бы выгодна бактерии, поскольку позволила бы более эффективно использовать имеющиеся питательные вещества. В присутствии всех конечных продуктов, образующихся на различных ответвлениях пути биосинтеза, может наблюдаться мультивалентная репрессия. Это происходит только тогда, когда все конечные продукты, синтезируемые данным набором ферментов, присутствуют в избытке. Следовательно, для полной репрессии аспартокиназы необходимо присутствие не только лизина и треонина, но также еще и метионина и изолейцина.
ATP-зависимые протеазы прокариот
Внутриклеточный протеолиз – это строго контролируемый процесс, который, как выяснилось в последнее время, у про- и эукариот осуществляется высокомолекулярными мультимерными энергозависимыми протеиназами. Эти протеиназы выполняют две основные функции: освобождают клетки от дефектных, поврежденных и мутантных белков – деструктивная функция, и осуществляют деградацию ряда короткоживущих регуляторных белков – регуляторная функция.
Энергозависимые протеиназы – особая группа протеиназ, обладающая целым рядом уникальных характеристик. Протеолитическая активность этих ферментов сопряжена с гидролизом АТР. Ферменты проявляют высокую селективность, поскольку производят отбор субстратов-мишеней из общего пула внутриклеточных белков, большая часть которых не должна повреждаться. При этом специфичность по отношению к аминокислотам, образующим расщепляемую связь, у энергозависимых протеиназ зачастую не выражена. Деградация белков-субстратов происходит по процессивному механизму – без высвобождения высокомолекулярных промежуточных продуктов. Все известные энергозависимые протеиназы являются олигомерами.
Основные проблемы при изучении АТР-зависимых протеиназ определяются особенностями этих ферментов и состоят в установлении принципов отбора белкового субстрата и механизма сопряжения гидролиза АТР и протеолиза. В клетках Escherichia coli к настоящему времени обнаружено пять АТP-зависимых протеиназ – Lon (La), FtsH (HflB), ClpAP (Ti), ClpXP и HslVU (ClpQY).
Lon и FtsH относятся к семейству ААА-белков (АТРаз, ассоциированных с другими клеточными активностями). Протеолитический и АТPазный центры этих ферментов локализованы в одной полипептидной цепи, и они функционируют как гомоолигомеры. Схематически структуры этих протеиназ сопоставлены на рис. 4.4.2.
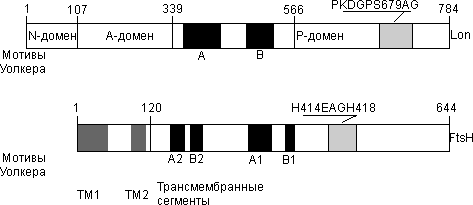
Рис. 4.4.2. Схема строения Lon- и FtsH-протеиназ
Исторически Lon-протеиназа явилась первой обнаруженной АТР-зависимой протеиназой. Косвенные сведения о существовании фермента, селективно гидролизующего дефектные белки в клетках E. coli, появились еще в 70-х годах, однако выделен он был в начале 80-х, а аминокислотная последовательность Lon-протеиназы (784 аминокислотных остатков (а.о.)) была расшифрована только в 1988 году одновременно в лаборатории проф. А.Гольдберга (США) и в лаборатории химии протеолитических ферментов ИБХ.
Сначала ферменту приписывали исключительно деструктивную функцию. И только в последнее время стало ясно, что кроме деградации дефектных белков, то есть выполнения роли “санитара клетки”, Lon-протеиназа расщепляет еще и целый ряд короткоживущих регуляторных белков. Считается, что Lon-протеиназа E. coli функционирует как тетра- или октамер.
Субъединица Lon-протеиназы состоит из трех функциональных доменов (рис. 4.4.2). Протеолитическим является С-концевой домен (Р-домен, His567-Lys784), содержащий каталитически активный остаток Ser679 в составе строго консервативного для Lon-протеиназ из различных источников октапептида PKDGPSAG. Надо отметить, что аминокислотная последовательность протеолитического домена не обнаруживает гомологии ни с одной из известных групп сериновых протеиназ, активный центр которых представлен так называемой классической каталитической триадой – Ser, His, Asp. Более того, показано, что наличие в Lon-протеиназе классической триады маловероятно, однако, есть основания полагать, что в активном центре фермента функционирует каталитическая диада Ser – Lys (такой тип активного центра обнаружен в последнее время у ряда сигнальных протеиназ). Протеолитическая функция Lon-протеиназы реализуется исключительно полноразмерным ферментом и только в условиях функционирования АТРазного центра; изолированный протеолитический домен проявляет лишь пептидгидролазную активность. Lon-протеиназа способна гидролизовать пептидные субстраты в отсутствие АТР; в присутствии комплекса АТР-Mg скорость гидролиза пептидов значительно возрастает; ADP-Mg ингибирует пептидгидролазную активность фермента. Нарушение олигомерной структуры Lon-протеиназы приводит к утрате протеолитической активности, однако пептидгидролазная активность сохраняется.
Lon-протеиназа гидролизует АТР и в отсутствие белкового субстрата, проявляя так называемую “базовую” АТРазную активность. Связывание белкового субстрата приводит к повышению АТРазной активности. АТРазный центр локализован в центральном домене (А-домен, Glu108-Lys566, рис. 4.4.2), который состоит из двух субдоменов (а.о. 108-339 и 340-566). Первый субдомен состоит из протяженных -спиральных участков и, возможно, вовлечен в обеспечение регуляторных функций фермента. Второй субдомен осуществляет АТРазную функцию и содержит мотивы Уолкера: А и В – консервативные фрагменты последовательности, характерные для ряда АТР-связывающих белков и АТРаз. Мотивы Уолкера участвуют в связывании нуклеотида и иона магния и присутствуют во всех АТР-зависимых протеиназах E. coli. В АТРазном домене локализован также дополнительный центр связывания белкового субстрата, который, как предполагается, участвует в распознавании белка-мишени.
Прямая корреляция эффективности функционирования протеолитического и АТРазного центров Lon-протеиназы отсутствует. При физиологических концентрациях АТР и ионов Mg (3 и 15 мМ, соответственно) свободные ионы металла проявляют регуляторные свойства, активируя протеолитическую и пептидгидролазную функции фермента и ингибируя базовую АТРазную функцию. Показано, что комплекс ADP-Mg – ингибитор АТРазной и протеолитической активности нативной Lon-протеиназы – активирует пептидгидролазный центр мутантной формы фермента с заменой K362Q, функционирующей в форме мономера. Это позволило сформулировать предположение о существовании двух путей передачи сигнала от АТРазных центров к протеолитическим – внутрисубъединичного и межсубъединичного: 1) внутри субъединиц пептидгидролазные центры активируются при связывании нуклеотида любого типа в присутствии ионов магния; 2) при межсубъединичной передаче сигнала пептидгидролазные центры активируются при связывании в “сопряженных” субъединицах комплекса ATP-Mg и ингибируются при связывании ADP-Mg (действие последнего носит доминирующий характер).
Функция N-концевого домена (N-домен, Met1-Gly107, рис. 4.4.2) еще не определена. Однако следует отметить, что у большого количества Lon-протеиназ, выявленных в настоящее время в различных эволюционно отдаленных источниках (в том числе и в клетках эукариот), именно N-концевые домены являются наиболее вариабельными по размеру (от 96 до 287 а.о.) и по первичной структуре. Степень подобия в протеолитических (от 206 до 239 а.о.) и в АТР-азных (от 458 до 538 а.о.) доменах весьма высока.
Отличительной особенностью Lon-протеиназы является ее способность к связыванию ДНК, однако до сих пор ДНК-связывающий участок не локализован.
FtsH-протеиназа – единственная мембрано-связанная АТР-зависимая протеиназа E.coli, относится к семейству Zn-зависимых металлопротеиназ. Первичная структура фермента (644 а.о.) опубликована в 1993 г. В N-концевой части фермента локализованы два богатых гидрофобными аминокислотами участка, образующих a-спиральные трансмембранные сегменты ТМ1 и ТМ2 (рис. 4.4.2), с помощью которых FtsH-протеиназа дважды пересекает цитоплазматическую мембрану, при этом фрагмент последовательности между сегментами ТМ1 и ТМ2 локализуется в периплазматическом пространстве. Основная часть молекулы (а.о. 121-644) – цитоплазматическая. Центральный ее фрагмент (около 200 а.о.) проявляет высокую гомологию с рядом АТРаз и содержит две пары мотивов Уолкера (А1-В1 и А2-В2, рис. 4.4.2). В С-концевом фрагменте FtsH-протеиназы обнаружена характерная для металлопротеиназ Zn-связывающая последовательность с двумя остатками гистидина (H414EAGH418). Предполагается, что фермент функционирует как димер или тетрамер и расщепляет, в основном, регуляторные белки (таблица). Получены данные в пользу участия молекулярных шаперонов (в частности, DnaK, DnaJ, GrpE) в презентации белков-мишеней для деградации ферментом. Показано, что FtsH-протеиназа является единственной АТР-зависимой протеиназой, наличие которой необходимо для жизнеспособности клеток E. coli. Возможно, это связано с собственной шапероноподобной активностью фермента.
Семейство Clp-протеиназ (т.е казеинолитических, или шапероноподобных протеиназ) в клетках E. coli представлено тремя ферментами. Все они – гетероолигомеры, состоящие из протеолитических (ClpP и HslV) и АТРазных (ClpA или ClpX и HslU) субъединиц.
ClpP-субъединица – общая для ClpAP- и ClpXP-протеиназ. В аминокислотной последовательности ClpP (193 а.о.) обнаружены каталитически активные остатки Ser97, His122 и Asp171. Изолированная ClpP-субъединица не способна гидролизовать белковые субстраты, но обладает пептидгидролазной активностью. АТРазные субъединицы ClpA и ClpX относят к двум различным классам Clp-белков: ClpA (784 а.о.) [57] принадлежит к белкам первого класса, которые содержат два нуклеотид-триггерных центра, разделенных вариабельной спейсерной областью, ClpX (424 а.о.) – белок второго класса, представители которого существенно меньше по размеру и содержат один АТРазный центр. Таким образом, протеолитические комплексы ClpAP и ClpXP представляют собой АТР-зависимые сериновые протеиназы с классической каталитической триадой.
HslUV принадлежит к недавно открытому подсемейству протеиназ, каталитически активным остатком которых является N-концевой остаток треонина. АТРазный компонент HslUV-протеиназы (HslU) относится к Clp-белкам второго класса, содержит мотивы Уолкера и обладает высокой гомологией с ClpX-субъединицей. Протеолитическая HslV-субъединица состоит из 176 а.о., несет каталитически активный остаток Thr1 и проявляет пептидгидролазную активность.
На первых этапах (стадии 1 и 2) функционирования протеиназ Clp-семейства происходит сборка активного мультисубъединичного комплекса фермента. По данным электронной микроскопии и рентгеноструктурного анализа ClpР образует структуру из двух гептамерных колец, наложенных друг на друга. У HslV кольца состоят из 6 субъединиц. АТРазные субъединицы представляют смесь нестабильных мономеров и димеров, которые в присутствии АТР образуют стабильные структуры из гексамерных колец (для HslU возможен также вариант с гептамерными кольцами). Вслед за этим в присутствии АТР окончательно формируется полный фермент, состоящий из колец протеолитических субъединиц, фланкированных кольцами АТРазных субъединиц (стадия 2).
Распознавание и связывание белка-субстрата осуществляется регуляторным АТРазным компонентом – либо его свободной формой, либо в составе полноразмерного фермента (стадия 3). То, что именно АТРазный компонент определяет селективность действия фермента подтверждается тем фактом, что ClpAP и ClpXP, имеющие общий протеолитический компонент, гидролизуют разные внутриклеточные субстраты. Следующим шагом в функционировании фермента считается разворачивание молекулы субстрата и транслокация ее в область протеолитических центров (стадия 4). Надо отметить, что на этом этапе АТРазные субъединицы могут проявлять шапероноподобную активность и участвовать в рефолдинге белков. Далее происходит процессивное расщепление субстрата внутри мультисубъединичного ферментного комплекса и высвобождение продуктов (стадия 5).
Таким образом, пять рассмотренных выше АТР-зависимых протеиназ E. coli представляют четыре различных подсемейства протеолитических ферментов и, следовательно, не проявляют структурной гомологии в своих протеолитических компонентах. АТРазные субъединицы и домены этих протеиназ также не проявляют выраженной гомологии.
