
Биохимия растений
.pdf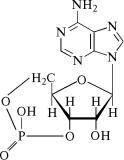
4.1. Названия важнейших нуклеотидов
Азотистое |
|
|
Сокращен- |
|
Дезоксирибонуклео- |
Сокращен- |
|
Рибонуклеотид |
íîå îáî- |
|
íîå îáî- |
||
основание |
|
|
òèä |
|||
|
|
значение |
|
значение |
||
|
|
|
|
|
||
Аденин |
Адениловая кислота |
ÀÌÔ |
Дезоксиадениловая |
äÀÌÔ |
||
|
(аденозинмоно- |
|
кислота (дезокси- |
|
||
|
фосфат) |
|
аденозинмоно- |
|
||
|
|
|
|
фосфат) |
|
|
Гуанин |
Гуаниловая кислота |
ÃÌÔ |
Дезоксигуаниловая |
äÃÌÔ |
||
|
(гуанозинмоно- |
|
кислота (дезокси- |
|
||
|
фосфат) |
|
гуанозинмоно- |
|
||
|
|
|
|
фосфат) |
|
|
Цитозин |
Цитидиловая кис- |
ÖÌÔ |
Дезоксицитидило- |
äÖÌÔ |
||
|
лота (цитидинмоно- |
|
вая кислота (дезо- |
|
||
|
фосфат) |
|
ксицитидинмоно- |
|
||
|
|
|
|
фосфат) |
|
|
Урацил |
Уридиловая кислота |
ÓÌÔ |
|
— |
— |
|
|
(уридинмонофосфат) |
|
|
|
|
|
Тимин |
|
— |
— |
Дезокситимидило- |
äÒÌÔ |
|
|
|
|
|
вая кислота (дезо- |
|
|
|
|
|
|
кситимидинмоно- |
|
|
|
|
|
|
фосфат) |
|
|
Гипоксантин |
Инозиновая кислота |
ÈÌÔ |
|
— |
— |
|
|
(инозинмонофосфат) |
|
|
|
|
|
В растениях обнаружены циклические формы нуклеотидов —˝ аденозинмонофосфата и гуанозинмонофосфата, которые, по-в˝и-
димому, выполняют регуляторные функции. Строение цикличе˝-
ского АМФ можно представить следующей формулой:
Путем фосфорилирования нуклеотиды превращаются в более˝
активные формы — нуклеозиддифосфаты и нуклеозидтрифос˝фа-
ты, в виде которых, как мы увидим далее, они участвуют в разл˝ич-
ных биохимических процессах — синтезе нуклеиновых кисл˝от,
сложных углеводов и липидов, коферментов и витаминов; зап˝асании и переносе энергии.
71
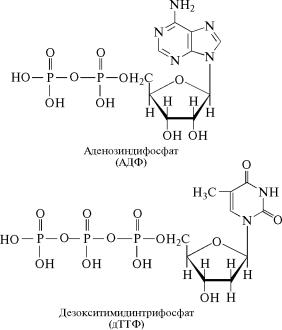
Из адениловой кислоты образуются аденозинди- и аденозинтрифосфат (АДФ и АТФ); из гуаниловой кислоты — гуанозинди˝- и гуанозинтрифосфат (ГДФ и ГТФ); из цитидиловой кислоты — цитидинди- и цитидинтрифосфат (ЦДФ и ЦТФ); из уридиловой
кислоты — уридинди- и уридинтрифосфат (УДФ и УТФ); из инозиновой кислоты — инозинди- и инозинтрифосфат (ИДФ и ИТФ˝). Из дезоксирибонуклеотидов также синтезируются соответс˝твую-
щие ди- и трифосфаты: дезоксиаденозинди- и дезоксиаденози˝н- трифосфат (дАДФ и дАТФ); дезоксигуанозинди- и дезоксигуано˝- зинтрифосфат (дГДФ и дГТФ); дезоксицитидинди- и дезоксицитидинтрифосфат (дЦДФ и дЦТФ); дезокситимидинди- и дезокси-˝ тимидинтрифосфат (дТДФ и дТТФ). Строение ди- и трифосфатов˝ нуклеозидов можно представить следующими формулами:
Свободные нуклеотиды содержатся во всех растительных кл˝етках. Они возникают или в процессе активного синтеза азоти˝стых
веществ, или в результате распада нуклеиновых кислот, кот˝орый
может интенсивно происходить при неблагоприятных услов˝иях произрастания, а также при хранении и переработке растите˝льных продуктов. Так, например, при разваривании клубней картоф˝еля
72
образующиеся в результате распада нуклеиновых кислот св˝обод-
ные нуклеотиды оказывают влияние на формирование вкусов˝ых
качеств вареного картофеля.
По интенсивности образования различных фракций нуклеот˝и-
дов можно судить о направленности биохимических процесс˝ов в организме. Если в клетках и тканях организма повышается с˝одержание трифосфатпроизводных нуклеотидов, то это свидетел˝ьству-
ет об активизации его жизнедеятельности, тогда как накопл˝ение монофосфатов наблюдается при усилении процессов распад˝а веществ, характерных для стареющего организма.
Контрольные вопросы. 1. Из каких структурных компонентов состоят рибонуклеотиды и дезоксирибонуклеотиды? 2. Какие конформации мол˝екул имеют разные нуклеотиды? 3. Как образуются нуклеозиды и их фосфорнок˝ислые эфиры? 4. Каковы химические свойства нуклеотидов и какие они выполняют биологиче- ские функции? 5. Как называют нуклеотиды и их ди- и трифосфат˝ы? 6. Каковы структурные особенности пуриновых и пиримидиновых осно˝ваний, входящих в состав нуклеотидов?
73

5. БЕЛКИ
∙
Белки — неотъемлемые компоненты любой живой клетки, которые обеспечивают и поддерживают ее жизнедеятельность˝. Мо-
лекулы белков представляют собой биополимеры, построенн˝ые в основном из аминокислот. Кроме аминокислот в состав белко˝вых молекул могут входить другие органические и неорганичес˝кие
компоненты. В белках содержится, %: углерода — 50—55, кислорода — 20—24, водорода — 7, серы — 0,5—3; в состав некоторых
белков могут также входить фосфор и различные металлы. Огромное структурное разнообразие белков и широкий диап˝а-
зон изменения их физико-химических свойств позволяют эти˝м
биополимерам выполнять разнообразные и жизненно важные˝ функции в живом организме. В каждой растительной клетке о˝дно-
временно функционируют несколько тысяч различных белко˝в. Все биохимические реакции в клетке происходят с участием˝ каталитических белков — ферментов. Структурная основа биол˝огиче-
ских мембран цитоплазмы и внутриклеточных органелл такж˝е построена с участием белков. Защитную функцию выполняют бел˝- ковые антитела и стрессовые белки, образующиеся под возде˝й- ствием стрессовых факторов. Важную роль выполняют в растительных клетках регуляторные и транспортные белки˝, спо-
собные обратимо изменять свою конформацию и таким образо˝м
активно участвовать в поддерживании жизнедеятельности ˝растения как саморегулирующейся системы.
В семенах и других органах растений откладываются запасн˝ые
белки, которые в значительной степени определяют питател˝ьную, кормовую и технологическую ценность растительной проду˝кции. Много белков накапливается в зерне зернобобовых культур˝ — 20— 30 %, в сое и люпине — 30—40, в семенах масличных культур —
15—30 %. Содержание белков в другой растительной продукции
составляет, %: зерновках злаковых растений — 9—18; кукурузы ˝и риса — 6—10; клубнях картофеля — 1,5—2; корнеплодах — 1—1,5;
овощах, плодах и ягодах — 0,5—2; цветной капусте — 2—3; брюс-
74
сельской капусте и чесноке — 6—8; вегетативной массе мятл˝иковых трав — 5—15, бобовых трав — 15—25 (последние два показате-˝ ля даны в расчете на сухую массу).
5.1. СТРОЕНИЕ БЕЛКОВЫХ МОЛЕКУЛ
Первый белковый препарат был выделен из пшеничной муки в
1728 г. Я. Б. Беккари и назван клейковиной. В 1809—1810 гг. появились первые сведения об элементном составе белков, а в˝ 1836 г.
предложена их первая эмпирическая формула. В дальнейшем
многие исследователи довольно активно изучали продукты˝ распа-
да белковых веществ и появлялось все больше и больше свед˝ений
о том, что основными продуктами гидролитического разложе˝ния белков являются аминокислоты. К 1899 г. уже было известно
13 аминокислот, большинство из которых были идентифицирова-
ны как продукты гидролиза белков.
Основополагающий вклад в разработку теории строения бел˝ков
внесли работы Э. Фишера, который в 1901 г. предположил и затем экспериментально обосновал положение о том, что белковые˝ мо-
лекулы построены из аминокислот, остатки которых соедине˝ны
пептидными связями. Образующиеся таким путем полимеры
обычно называют полипептидами, а учение о построении белк˝о-
вых молекул из аминокислот, соединенных пептидными связя˝- ми, — полипептидной теорией строения белков.
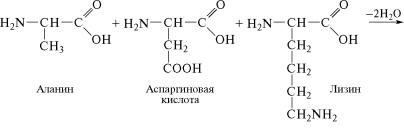
В образовании пептидной связи участвуют α-аминокислоты,
которые взаимодействуют своими аминными и карбоксильны˝ми
группами, при этом высвобождаются молекулы воды. У диамин˝о- монокарбоновых кислот пептидную связь может образовать˝ только аминогруппа, находящаяся в α-положении, а у моноаминодикарбоновых кислот — карбоксильная группа, содержащая в˝α-ïî-
ложении аминогруппу. Углеводородные радикалы аминокисл˝от-
ных остатков, соединенных пептидными связями, остаются в ˝виде боковых радикалов. Так, например, из аланина, аспарагиново˝й кислоты и лизина образуется трипептид:
75
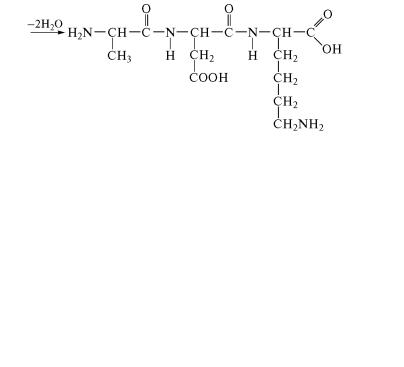
Название пептида составляется из названий образующих ег˝о
аминокислот, при этом аминокислота, содержащая свободную˝ карбоксильную группу, записывается в его конце, а у других ами-
нокислот окончание изменяют на «ил» и перечисляют их в на˝зва-
нии пептида в том порядке, в котором они расположены в стру˝к-
турной формуле полученного соединения. В соответствии с э˝тим
представленный ранее трипептид называется аланиласпара˝гиллизин.
Пептидная связь может располагаться в пространстве в öèñ-
èëè транс-конфигурации:
Методом рентгеноструктурного анализа показано, что атом˝ные
группировки пептидной связи расположены в одной плоскос˝ти, образуя у природных полипептидов преимущественно транс-кон- фигурацию относительно связи C—N, которая в значительной мере имеет характер двойной связи, и вращение вокруг этой˝ связи
сильно ограничено. В целом пространственное построение п˝оли-
пептидной цепи можно представить как последовательност˝ь плоских структур, образуемых элементами пептидной связи, кото˝рые соединены через α-углеродные атомы аминокислотных радикалов. Поскольку связи у α-углеродных атомов не являются двойны-
ми, вокруг них возможно вращение расположенных в плоскост˝и
пептидной связи группировок.
Если поменять порядок соединения аминокислот в пептиде, т˝о мы получим набор изомеров. Чаще всего в состав белковых поли-
пептидов могут входить 100—400 аминокислотных остатков, кото˝-
рые, соединяясь пептидными связями в определенном порядк˝е, могут давать большое число изомерных молекул, способных в˝ы-
полнять разнообразные биологические функции. В общем вид˝е
строение полипептида можно выразить следующей формулой˝:
76
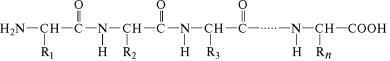
В этой формуле аминокислотные остатки соединены связями˝ —СО—NH—, которые называют пептидными, à R1, R2, R3...Rn —
радикалы аминокислотных остатков, содержащие различные˝ группировки атомов и образующие боковые ответвления в мо˝ле-
куле полипептида.
На противоположных концах полипептидной цепи имеются свободная аминная и свободная карбоксильная группы, по ко˝торым определяют направленность полипептида. Аминокислот˝а на
конце полипептидной цепи со свободной аминогруппой в α-по- ложении называется N-концевой, а аминокислота на противоп˝о-
ложном конце полипептида, содержащая свободную карбокси˝льную группу, не использованную для образования пептидной с˝вя-
зи, — C-концевой аминокислотой. Определение N- и C-концевых аминокислот имеет важное значение для выяснения строени˝я бел-
ковой молекулы, так как позволяет установить в ней число п˝олипептидных цепей.
Большинство известных белков содержат в молекуле более о˝д- ной полипептидной цепи и этим существенно отличаются от
обычных пептидов, имеющих одну полипептидную цепь и более˝ низкую молекулярную массу. Однако четкую границу между пе˝п-
тидами и белками провести довольно трудно: и те и другие имеют вполне определенную пространственную структуру и выпол˝няют
свою биохимическую функцию. Основными критериями следуе˝т считать степень полимерности молекулы, обеспечивающую е˝й необходимые коллоидные, осмотические, буферные и другие сво˝й- ства, характерные для белков, а также способность формиро˝вать определенную пространственную структуру. Самая низкая с˝тепень полимерности известных белков составляет не менее 50˝ ами-
нокислотных остатков в одной молекуле. Вместе с тем извес˝тны
некоторые белки, молекулы которых насчитывают свыше 1000 аминокислотных остатков.
Пептиды в различных организмах очень часто синтезируютс˝я с
помощью тех же механизмов, что и белки, и представляют собо˝й важные промежуточные продукты обмена веществ, многие из н˝их выполняют регуляторные функции и относятся к физиологич˝ески
активным соединениям. Однако известны пептиды, в синтезе ˝которых принимают участие аминокислоты, не входящие в соста˝в
белков, они способны образовывать циклические структуры˝. К та-
77
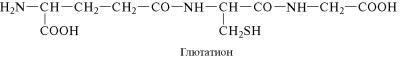
ким пептидам относятся антибиотики (грамицидин, циклоспо˝- рин, тироцидин) и токсины бледной поганки, а к пептидам, вы-
полняющим регуляторные функции, — многие гормоны челов˝ека
и животных (окситоцин, вазопрессин, адренокортикотропный˝
гормон и некоторые другие).
Из растительных пептидов наиболее хорошо изучен глютати˝он, структура которого была установлена в 1945 г. Ф. Гопкинсом. Мо˝-
лекула глютатиона включает остатки трех аминокислот — ˝глута-
миновой, цистеина и глицина. Глицин и цистеин соединены пе˝п- тидной связью, а цистеин и глутаминовая кислота — псевдоп˝еп-
тидной (или изопептидной), которая образуется при взаимод˝ей-
ствии аминогруппы цистеина с карбоксильной группой глутаминовой кислоты, не содержащей в α-положении амино-
группу и обычно находящейся в белковых полипептидах в сос˝таве
бокового радикала.
Высокая биологическая активность глютатиона обусловлен˝а его способностью участвовать в восстановительных реакц˝иях, так
как под действием фермента он может легко отщеплять водор˝од
от сульфгидрильной группы (—SH) и переходить в окисленную форму, образуя димеры, связанные дисульфидными (—S—S—) свя-
зями. Схематически образование окисленных димеров глюта˝тиона можно представить следующим образом:
Фермент
R—SH + HS—R  R—S—S—R + Фермент — H2
R—S—S—R + Фермент — H2
Глютатион содержится во всех растительных клетках и оказ˝ы- вает влияние на активность многих ферментов, катализирую˝щих
превращения белков.
Поскольку многие пептиды обладают высокой биологическо˝й активностью, разрабатываются технологии их химического˝ синтеза с целью получения искусственных гормонов, антибиотико˝в,
различных медицинских препаратов. Как показывают резуль˝таты
опытов, путем химического синтеза можно получать полипептидные цепи, содержащие до 100 аминокислотных остатков.
Наиболее значительные успехи достигнуты в результате со˝четания химического и ферментативного синтезов. Так, например˝,
78

из природных полипептидов пу- |
|
|||||||
тем частичного гидролиза выделя- |
|
|||||||
ют пептидные фрагменты требуе- |
|
|||||||
мого состава, а затем соединяют их |
|
|||||||
с помощью |
химических реакций |
|
||||||
или ферментативного синтеза, по- |
|
|||||||
лучая таким образом биологически |
|
|||||||
активные пептидные препараты. |
|
|||||||
Следующим этапом после того, |
|
|||||||
как была сформулирована и экспе- |
|
|||||||
риментально подтверждена |
ïîëè- |
|
||||||
пептидная теория строения белков, |
|
|||||||
áûëî |
определение |
структурных |
|
|||||
формул белков, показывающих по- |
|
|||||||
следовательность соединения ами- |
|
|||||||
нокислотных остатков в белковых |
|
|||||||
молекулах. |
|
Впервые |
это удалось |
|
||||
осуществить |
â |
1954 г. Ф. Сенгеру, |
|
|||||
применившему |
новые |
подходы в |
|
|||||
химической |
идентификации |
êîí- |
|
|||||
цевых |
аминокислот |
ó |
различных |
|
||||
пептидов, которые могут быть по- |
|
|||||||
лучены при частичном гидролизе |
|
|||||||
полипептидов изучаемого белка. |
|
|||||||
Сопоставление |
аминокислот- |
|
||||||
íûõ |
последовательностей |
ïåðå- |
|
|||||
крывающихся |
фрагментов |
ïîëè- |
|
|||||
пептидных цепей гормона подже- |
|
|||||||
лудочной железы инсулина позволи- |
|
|||||||
ло ученому с достаточно высокой |
Рис. 5.1. Первичная структура |
|||||||
точностью |
определить |
последова- |
||||||
тельность |
соединения |
аминокис- |
молекулы инсулина |
|||||
|
||||||||
лотных остатков в молекуле этого
белка. Как оказалось, молекула инсулина состоит из двух по˝ли-
пептидных цепей, в одной из которых содержится 30 аминокислотных остатков, в другой — 21. Полипептидные цепи в двух положениях соединены дисульфидными связями, которые образую˝тся
при взаимодействии сульфгидрильных групп (—SH) цистеиновых
радикалов точно по такому же механизму, что и у димеров глю˝та-
тиона. Положение этих цистеиновых остатков в полипептидн˝ых
цепях инсулина показано на рисунке 5.1.
Следует учитывать, что нумерацию аминокислотных остатко˝в в
полипептидах принято исчислять в направлении от N-концево˝й
79
аминокислоты к С-концевой. В короткой цепи инсулина образуется еще одна дисульфидная связь между остатками цистеин˝а в
6-м и 11-м положениях. В длинной цепи N-концевая аминокис-
лота — фенилаланин, С-концевая аминокислота — аланин; в˝ короткой цепи N-концевая аминокислота — глицин, С-концевая ˝— аспарагин. Таким образом, на примере инсулина мы видим, что˝
молекула белка может быть построена не из одного полипепт˝ида и
разные полипептидные цепи в молекуле белка могут соединя˝ться дисульфидными связями за счет цистеиновых остатков.
Вслед за инсулином были расшифрованы аминокислотные
последовательности различных пептидов и белков: окситоц˝ина, вазопрессина, РНК-полимеразы, пепсина, трипсина, лизоцима˝,
цитохромов, гемоглобина, папаина и многих других полиами-˝
нокислотных соединений. Уже к 1975 г. насчитывалось 600 белков с известными аминокислотными последовательностями, к
1985 г. — свыше 2500. В настоящее время работа по анализу ами-
нокислотных последовательностей в белках почти полност˝ью автоматизирована и число таких белков уже значительно прев˝ыша-
åò 20 òûñ.
Первичная структура белков. Последовательность соединения аминокислот в полипептидных цепях белковой молекулы при˝нято
называть первичной структурой белка. Она определяется последо-
вательностью нуклеотидов конкретного участка ДНК, кодир˝ующего данный полипептид, и называемого геном.
Замена даже одной аминокислоты в структуре белка может су˝-
щественно изменить его функцию. Поэтому полипептиды можн˝о рассматривать как «отпечатки» кодирующих их генов и испо˝льзо-
вать для распознавания генотипов, а также установления ге˝нети- ческого родства между ними. Так, например, в короткой полип˝ептидной цепи инсулина человека в положениях 8, 9 и 10 находится˝ последовательность аминокислот Thr-Ser-Ile, в инсулине овцы — Ala-Gly-Val, в инсулине коровы — Ala-Ser-Val, в инсулине собаки — Thr-Ser-Ile, т. е. такая же аминокислотная последовательность, как и у человека, что свидетельствует о меньшем филогенетическом различии между этими организмами.
В других исследованиях, связанных с изучением аномальных˝ форм гемоглобина, установлено, что во многих случаях заме˝на в одной из его полипептидных цепей хотя бы одной аминокисло˝ты на другую вызывает нарушение физиологической функции эт˝ого
белка, которое приводит к серьезным клиническим последст˝виям
для организма человека.
Вторичная структура белков. Полипептидная цепь, включающая последовательность аминокислотных остатков, характерну˝ю для
данного белка, формирует вполне определенную пространст˝вен-
80
