
Биохимия растений
.pdfПодавляющее большинство природных аминокислот синтези-˝ руется в организмах в виде L-форм, а D-формы аминокислот
встречаются редко, чаще всего в клетках микроорганизмов. ˝При
химическом синтезе образуется рацемическая смесь L- и D-изо˝- меров аминокислот.
Ферментные системы растений, человека и животных специ-
фически приспособлены катализировать биохимические реа˝кции,
происходящие с участием L-изомеров аминокислот, и не спосо˝б- ны к превращениям D-изомеров, которые могут даже ингибиро-
вать биохимические процессы в организме. В опытах установ˝лено,
что только метионин может усваиваться организмами челов˝ека и животных как в L-форме, так и D-форме.
Первые аминокислоты были открыты в начале XIX в., а к кон-
цу века уже были выделены и изучены почти все аминокислот˝ы, входящие в состав белков. В настоящее время известно боле˝е 200
аминокислот. Важнейшая биологическая роль аминокислот ˝— по-
строение белковых молекул. Аминокислоты, участвующие в си˝н- тезе белков, принято называть протеиногенными, их насчиты˝ва-
ется 18. Кроме того, в синтезе белков принимают участие два а˝ми-
да — аспарагин и глутамин.
После синтеза белковой молекулы в ней могут происходить м˝о-
дификации радикалов некоторых аминокислот, поэтому при а˝на-
лизе состава белков кроме протеиногенных обнаруживают н˝екоторые другие аминокислоты (оксипролин, оксилизин и др.).
Аминокислоты, не участвующие в синтезе белков, являются
важными метаболитами, с участием которых происходит синт˝ез протеиногенных аминокислот, а также всех других азотисты˝х ве-
ществ растительного организма: нуклеотидов, амидов, азоти˝стых оснований, алкалоидов, некоторых липидов, многих витамино˝в, хлорофилла, фитогормонов (ауксинов, цитокининов), некотор˝ых фитонцидов. Строение и биологическая роль важнейших амин˝о- кислот представлены в таблице 3.1.
Растения и природные формы микроорганизмов способны синтезировать все необходимые им аминокислоты из других˝ органических веществ, тогда как организмы человека и животных˝ не способны к синтезу некоторых аминокислот, входящих в сост˝ав белков. Эти аминокислоты называют незаменимыми, и они должны поступать в организм с пищей.
Для взрослого человека незаменимыми являются восемь ами˝-
нокислот: лизин, триптофан, метионин, треонин, лейцин, валин˝,
изолейцин, фенилаланин. У детей и некоторых групп животны˝х к
незаменимым относятся также аргинин, гистидин и цистеин. ˝При недостатке незаменимых аминокислот ослабляется синтез белков,
что может быть причиной тяжелых заболеваний, а их недоста˝ток в
61
растительных кормах снижает выход животноводческой про˝дукции в расчете на единицу массы затраченного корма, в результате
чего повышается ее себестоимость.
В целях составления правильного пищевого рациона для каж˝- дого вида организмов с учетом возрастного и физического с˝остояния определены ежедневные нормы потребления незаменимы˝х
аминокислот. В среднем для человека они составляют, г: вали˝н —
5,0; лейцин — 7,0; изолейцин — 4,0; лизин — 5,5; триптофан — 1,0; треонин — 4,0; метионин — 3,5; фенилаланин — 5,0.
Чаще всего в кормах сельскохозяйственных животных в недо˝-
статочном количестве содержатся такие незаменимые амин˝окислоты, как лизин, триптофан и метионин. Для балансирования
кормов по содержанию этих аминокислот разработаны промы˝ш-
ленные способы их получения. Поскольку лизин и триптофан ˝усваиваются животными только в виде L-изомеров, для производ-
ства кормовых препаратов указанных аминокислот применя˝ют
микробиологический синтез, при котором реализуется прир˝одный механизм образования L-изомеров аминокислот. Поскольк˝у
метионин может усваиваться животными в виде D- è L-ôîðì, äëÿ
его промышленного получения используют менее затратный˝ химический синтез, дающий рацемическую смесь оптических из˝о-
меров этой аминокислоты.
Содержание свободных аминокислот в растениях зависит от˝ вида органа или ткани, возраста растений, внешних условий˝ и
особенно подвержено большим изменениям в зависимости от˝ ин-
тенсивности протекания тех биохимических процессов, кот˝орые сопряжены с их потреблением (синтез белков, нуклеиновых к˝ислот
èдругих азотистых веществ). Концентрация аминокислот по˝вышается при ослаблении ростовых процессов, недостатке питат˝ельных элементов, избыточном азотном питании, усилении процессо˝в распада белков при старении растений или прорастании семян.
Концентрации отдельных аминокислот могут возрастать в р˝е- зультате метаболических нарушений в организме и под возд˝ействием стрессов. Так, например, при вододефицитном стресс˝е в клетках растений происходит накопление аминокислоты пр˝олина, а при избыточном аммонийном питании — аспарагина, глута˝мина
èаргинина.
3.2. СВОЙСТВА АМИНОКИСЛОТ
Чистые препараты аминокислот — белые кристаллические в˝е- щества с высокой температурой плавления (свыше 200 °С). Мно-
гие из них хорошо растворяются в воде, за исключением кисл˝от с
62

гидрофобными радикалами. В водном растворе карбоксильны˝е группы аминокислот подвергаются диссоциации с образова˝нием катионов водорода, а азот аминогруппы довольно активно пр˝исо-
единяет катионы водорода, превращаясь в заряженную групп˝и-
ровку, в результате чего образуется биполярное соединени˝е:
В сильнокислой среде диссоциация карбоксильных групп по˝- давляется высокой концентрацией ионов водорода, и в таких˝ усло-
виях заряд молекулы будет положительным, так как он опред˝еля-
ется зарядом атома азота, присоединившего протон:
При понижении концентрации ионов водорода (увеличение рН) степень диссоциации карбоксильных гpyпп yвeличивaeтcя, а
взаимодействие ионов водорода с азотом аминогруппы осла˝бева-
ет, вследствие чего при определенном значении рН большая ˝часть
карбоксильных групп будет диссоциировать и молекула ами˝но-
кислоты приобретает отрицательный заряд.
В щелочной среде под воздействием высокой концентрации
гидроксид-ионов происходит связывание катионов водород˝а,
присоединенных к аминогруппе, с образованием воды, в резу˝льта-
те чего заряд молекулы будет определяться только зарядом˝ карбоксильной группы:
При определенном значении рН среды положительный заряд
аминогрупп полностью уравновешивается отрицательным за˝рядом карбоксильных групп и молекулы аминокислоты становя˝тся электpонейтральными. Такое состояние молекулы принято на˝зывать изоэлектрической точкой. Если рН среды ниже рН изоэлект-
рической точки молекулы аминокислоты, то она заряжена пол˝о-
жительно за счет заряда аминогруппы и ведет себя в водном˝ ра-
створе как катион. При рН среды выше рН изоэлектрической т˝оч-
ки молекула аминокислоты заряжена отрицательно за счет
диссоциации карбоксильной группы и ведет себя в водном ра˝ство-
ре как анион.
63

Опытным путем определено, что изоэлектрические точки моноаминомонокарбоновых кислот находятся в слабокислой с˝реде (рН 5—6,5), так как кислотные свойства у них выражены несколько сильнее, чем оснó вные. У моноаминодикарбоновых кислот
кислотные свойства выражены значительно сильнее, поэтом˝у их изоэлектрические точки находятся в кислой среде (рН 3—3,2). У˝
диаминомонокарбоновых кислот сильнее выражены оснó вные свойства, в связи с чем их изоэлектрические точки смещены˝ в ще-
лочную сторону (рН 9,7—10,8).
Поскольку в молекулах аминокислот имеются как кислотные˝,
òàê è îñíó вные группировки, они проявляют амфотерные свой-
ства и могут взаимодействовать и с кислотами, и с основани˝ями, образуя соответствующие соли:
Своими карбоксильными и аминными группировками аминокислоты могут вступать и в другие химические реакции, с по˝мо-
щью которых можно проводить качественный и количественн˝ый
анализ этих соединений. При взаимодействии аминокислот с˝о
спиртами образуются сложные эфиры, которые подвергаются˝ ва-
куумной перегонке при разных физических параметрах. Благ˝одаря этому можно разделять смеси аминокислот путем получения˝ и фракционной перегонки их эфиров.
Весьма характерная реакция аминокислот — их взаимодейс˝твие с азотистой кислотой. В ходе этой реакции образуется окси˝кислота с выделением воды и газообразного азота, объем которог˝о можно измерить и затем определить количество прореагировав˝шей
аминокислоты (метод Д. Ван-Сляйка).
При взаимодействии аминокислот с формальдегидом происх˝о-
дит связывание его молекул с их аминными группами, а карбо˝- ксильные группы остаются свободными, поэтому полученные˝ со-
единения можно оттитровать раствором щелочи. По количест˝ву
64

щелочи, затраченной на титрование, затем определяют колич˝е- ственное содержание аминокислот в растворе (метод С. П. С˝¸ренсена):
Наиболее чувствительная и точная реакция для обнаружени˝я
α-аминокислот — их взаимодействие с нингидрином. При нагр˝е-
вании раствора аминокислоты и нингидрина образуется окр˝ашенный в синий цвет продукт конденсации двух молекул нингидр˝ина
и аминокислоты. Интенсивность окрашивания в определенны˝х
пределах связана с концентрацией аминокислоты в раствор˝е.
Пролин и оксипролин, являющиеся иминокислотами, при взаи-˝
модействии с нингидрином дают желтоокрашенные продукты˝. Именно такие реакции используют в автоматических анализ˝ато-
рах аминокислот.
Аминокислоты довольно легко вступают в реакции с редуцир˝у-
ющими сахарами, образуя при этом темноокрашенные продук-
òû — меланоидины. На первом этапе взаимодействия аминокислоты и моносахарида образуются продукты их разложения: из с˝аха-
ров — фурфурол или оксиметилфурфурол, а из аминокислоты˝ —
альдегид, диоксид углерода и аммиак. На следующем этапе
фурфурол или оксиметилфурфурол, вступая в соединение с ам˝и-
нокислотами, образует меланоидины. Интенсивность реакци˝и
усиливается при повышенной температуре, которая создает˝ся при
термической обработке рacтитeльной продукции или ее
перерaботке (сушка овощей, фруктов и продуктов из картофел˝я, выпечка хлеба, получение макарон и кондитерских изделий)˝. Аналогичные явления наблюдаются при самосогревании зерна.
Промежуточные продукты меланоидинообразования — альд˝е-
гиды создают специфический запах, характерный для тех или˝
иных пищевых продуктов. Фурфурол имеет запах яблок, оксим˝е- тилфурфурол — меда, изовалериановый альдегид, образуем˝ый из аминокислоты лейцина, — запах ржаного хлеба. Конечные пр˝о- дукты реакций взаимодействия аминокислот с редуцирующи˝ми
сахарами — меланоидины вызывают потемнение растительн˝ых продуктов, что ухудшает их товарные свойства. В процессе х˝лебо-
печения реакции образования меланоидинов влияют на форм˝ирование цвета, вкуса и аромата ржаного и пшеничного хлеба.
В результате ферментативного окисления ароматических а˝ми-
нокислот тирозина и фенилаланина также образуются темно˝окра-
65
шенные продукты — меланины, вызывающие потемнение на воздухе очищенных клубней картофеля, измельченных корнепло˝дов, овощей и фрyктoв. Эти вещества совместно с меланоидинами оп˝- ределяют темный цвет ржаного хлеба и вызывают потемнение˝ ма-
карон при сушке.
Меланины синтезируются в ходе конденсации продуктов оки˝с-
ления тирозина и фенилаланина, возникающих под действием˝ фермента тирозиназы (см. с. 555—556).
В целях предотвращения потемнения растительных продукт˝ов
при хранении, сушке и переработке применяют технологии вы˝ра-
щивания сельскохозяйственных культур, не допускающие на˝коп-
ления в товарной продукции редуцирующих сахаров и свобод˝ных аминокислот.
Контрольные вопросы. 1. Каковы основные характеристики моноаминомонокарбоновых, моноаминодикарбоновых и диаминомонокарбоновых кислот? 2. Какие стереоизомеры аминокислот синтезируются в живых орг˝анизмах? 3. Каковы структурные и биологические особенности протеиногенных˝ аминокислот? 4. Что выражает понятие «незаменимые аминокислоты»? 5. В виде как˝их форм находятся аминокислоты в растворе и как они взаимодействуют с ки˝слотами, основаниями, азотистой кислотой, формальдегидом? 6. Какие продукты об˝разуются при взаимодействии аминокислот с редуцирующими сахарами и кисл˝ородом воздуха и как они влияют на товарные свойства растительной продукц˝ии? 7. В зависимости от каких факторов меняется концентрация аминокислот в ра˝стительных тканях?
66

4. НУКЛЕОТИДЫ
∙
Наряду с аминокислотами важнейшей группой азотистых ве-
ществ являются нуклеотиды. Их биологическое значение для˝ жизнедеятельности организмов определяется тем, что они испо˝льзу-
ются для построения молекул нуклеиновых кислот — дезок˝сири-
бонуклеиновой (ДНК) и рибонуклеиновой (РНК); входят в соста˝в
каталитических центров ферментов; участвуют в биоэнерге˝тичес-
ких процессах и синтезе углеводов, липидов, белков, алкало˝идов и других веществ. Некоторые нуклеотиды способны выполнять˝ ре-
гуляторные функции.
Главные структурные компоненты нуклеотидов — азотисты˝е
основания, пентозы (рибоза или дезоксирибоза) и остаток ор˝то-
фосфорной кислоты. В зависимости от углеводного компонен˝та различают две группы нуклеотидов: рибонуклеотиды, содерж˝ащие
остаток рибозы, и дезоксирибонуклеотиды, имеющие в своем ˝со-
ставе остаток дезоксирибозы. Дезоксирибонуклеотиды исп˝ользу-
ются организмами для синтеза ДНК, а рибонуклеотиды входят˝ в состав РНК, ферментов и макроэргических нуклеозидполифо˝сфатов.
Рибоза и дезоксирибоза в составе нуклеотидов находятся
â β-D-фуранозной форме:
Нуклеотиды образуются из двух типов азотистых оснований˝ —
производных пиримидина и пурина. Свойства оснований они
проявляют в водном растворе при взаимодействии с молекул˝ами
воды. Из пиримидиновых оснований наиболее важное значени˝е имеют урацил, тимин и цитозин как основные структурные ед˝и-
67
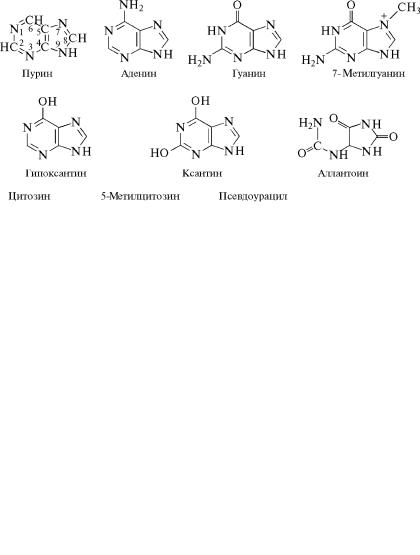
ницы нуклеотидов, образующих нуклеиновые кислоты. Кроме них известны и другие основания — 5-метилцитозин, псевдоу˝рацил, 5-оксиметилцитозин и др. 5-Метилцитозин и 5-оксиметилци- тозин в небольшом количестве могут содержаться в составе˝ нукле-
отидов ДНК и РНК, псевдоурацил — в транспортной РНК.
Из пуриновых оснований наибольшее значение имеют аденин˝ и гуанин, так как они используются для синтеза нуклеиновы˝х кис-
лот. В составе нуклеиновых кислот в небольшом количестве об-
наружены также и другие основания, которые образуются в ре-
зультате химической модификации аденина и гуанина: 7-мети˝л-
гуанин, 2-метиладенин, N-диметилгуанин и др. Важными промежуточными метаболитами являются гипоксантин, ксантин,
аллантоин. В некоторых растениях они могут накапливаться˝ в
свободном состоянии.
68
Все азотистые основания интенсивно поглощают ультрафио˝летовый свет при длинах волн 200—280 нм.
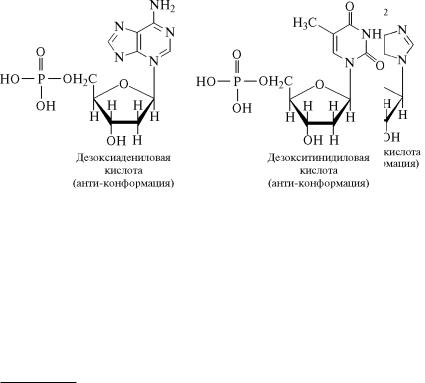
При соединении азотистых оснований с молекулой рибозы ил˝и дезоксирибозы образуются соединения, называемые нуклеозидами,
так как между пентозой и основанием возникает гликозидна˝я связь. Основания в данном случае можно рассматривать как ˝агли-
коны по отношению к пентозе.
В нуклеозидах гликозидная связь возникает между первым
углеродным атомом пентозы в β-фуранозной форме и азотом пу-
ринового (в девятом положении) или пиримидинового (в перв˝ом
положении) основания. Азотистые основания аденин, гуанин˝, ци-
тозин и урацил образуют при соединении с рибозой нуклеози˝- ды — аденозин, гуанозин, цитидин и уридин, а с дезокси-
рибозой — дезоксиаденозин, дезоксигуанозин, дезоксицит˝идин,
дезоксиуридин. Тимин, соединяясь с дезоксирибозой, дает д˝езо-
кситимидин.
* Объяснение термина см. далее. — Ïðèì. ðåä.
69
При интенсивном распаде нуклеиновых кислот азотистые ос-
нования и нуклеозиды могут накапливаться в растениях в зн˝ачи-
тельном количестве.
Фосфорнокислые эфиры нуклеозидов называют нуклеотидами. В составе нуклеотидов остатки ортофосфорной кислоты мог˝ут присоединяться к пятому или третьему атому углерода рибо˝зы или дезоксирибозы, а у некоторых рибонуклеотидов еще и ко вто˝рому
атому углерода рибозы. У свободных нуклеотидов фосфатная˝ группа обычно находится у пятого углеродного атома рибоз˝ы или
дезоксирибозы. В нейтральной среде остатки ортофосфорно˝й кислоты в молекулах нуклеотидов сильно диссоциированы, всле˝д- ствие чего могут присоединять катионы, поэтому при химиче˝ском
выделении нуклеотиды кристаллизуются в виде солей.
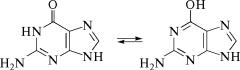
Изучение пространственной структуры азотистых основани˝й
методом рентгеноструктурного анализа показывает, что вс˝е они имеют почти плоскую конформацию. У них довольно легко про˝- исходит перегруппировка двойных связей, которая сопрово˝ждает-
ся таутомерными превращениями. Например, гуанин может суще-
ствовать в виде двух таутомерных форм:
Плоскость гетероциклического ядра основания в структуре
нуклеозидов и нуклеотидов может занимать в пространстве два
положения по отношению к пентозе, образуя две противополо˝ж- ные конформации — àíòè- è ñèí-конформацию. В àíòè-конфор-
мации структура азотистого основания развернута в сторо˝ну от
плоскости пентозы, а в ñèí-конформации ориентирована над ее плоскостью. В свободном состоянии пиримидиновые нуклеот˝иды
находятся преимущественно в àíòè-конформации, а пуриновые
довольно легко переходят из одной формы в другую.
Поскольку у нуклеотидов сильно выражены кислотные свой-
ства, их называют кислотами с учетом названий азотистых о˝снова-
ний и углеводного компонента. Так, например, рибонуклеоти˝д, имеющий остаток аденина, называют адениловой кислотой ил˝и аденозинмонофосфатом (АМФ). Дезоксирибонуклеотид, образ˝о- ванный из тимина, называют дезокситимидиловой кислотой и˝ли дезокситимидинмонофосфатом (дТМФ). Названия других нукл˝е- отидов представлены в таблице 4.1.
70
