
- •Кафедра химии и экологии в строительстве
- •Общие методические указания
- •Контрольная работа
- •Раздел 1. Моль. Эквиваленты и эквивалентные массы простых и сложных веществ. Закон эквивалентов.
- •Основные физические величины
- •Основные понятия
- •1.2. Теоретическая часть.
- •Эквиваленты и молярные массы эквивалентов
- •Контрольные задания
- •Раздел 2. Строение атома и периодическая система элементов д.И.Менделеева
- •2.1. Электронная структура атома.
- •Электроотрицательности элементов по шкале л. Полинга
- •Примеры образования ионов за счет отдачи или присоединения электронов атомами
- •Контрольные задания
- •Раздел 3. Химическая связь
- •Примеры электронных формул атомов
- •Сравнение видов химической связи.
- •Метод валентных связей
- •Метод молекулярных орбиталей
- •Контрольные задания
- •Раздел 4. Основные классы неорганических соединений. Классификация сложных неорганических веществ.
- •Оксиды и их классификация.
- •Основания. Свойства и классификация оснований. Щелочи.
- •Амфотерные основания.
- •Соли. Названия и классификация солей.
- •Соли. Получение и химические свойства.
- •Контрольные задания
- •Раздел 5. Основы химической термодинамики. Общие закономерности протекания химических процессов
- •Внутренняя энергия и энтальпия
- •Термохимия. Термохимические уравнения. Термохимические расчёты
- •Энергия гиббса
- •Контрольные задания
- •Контрольная работа № 2
- •Раздел 6. Основы химической кинетики
- •Химическая кинетика и катализ.
- •Химическое равновесие.
- •Контрольные задания
- •Раздел 7. Способы выражения концентрации растворов. Свойства растворов. Температура кипения и замерзания растворов.
- •Контрольные задания
- •Раздел 8. Окислительно-восстановительные реакции.
- •Классификация. Различают четыре типа окислительно-восстановительных реакций.
- •Контрольные задания
- •Раздел 9. Гидролиз солей.
- •Водородный показатель (рН): в воде всегда присутствует немного катионов водорода и гидроксидионов, которые образуются в результате обратимой диссоциации:
- •Контрольные задания
- •Раздел 10. Коллоидные растворы Общие сведения
- •Классификация дисперсных систем.
- •Свободная поверхностная энергия и устойчивость дисперсных систем.
- •Образование высокодисперсных систем.
- •Внутренняя структура коллоидных частиц
- •Свойства коллоидных растворов
- •Оптические свойства коллоидных растворов
- •Молекулярно-кинетические свойства коллоидных растворов
- •Электрические свойства коллоидных растворов
- •Коагуляция
- •Контрольные задания
- •Варианты контрольных заданий
Эквиваленты и молярные массы эквивалентов
|
Элемент или сложное вещество |
Эквивалент Э, |
Молярная масса (М экв.) эквивалента, [г/моль] |
|
Элемент Например, Са |
Ээл = 1∙ f =1/В Э (Ca) = 1/2 |
Мэкв =M ∙ f = M/В М(½Ca) = 40/2 = = 20 г/моль |
|
Кислота Например, H2S |
Э кислоты = 1∙ f = = 1/основность Э кислоты = 1∙ f = =1/основность |
Мэкв =M ∙ f = M/основность М(½Н2S).=34 ∙ 1/2 = = 17 г/моль |
|
Основание Например, Са(OH)2 |
Эосн = 1∙ f = = 1/кислотность Э [Ca(OH)2] = 1/2 |
Мэкв =M ∙ f = = M/кислотность М[½Ca(OH)2] = = 74 / 2 = 37 г/моль |
|
Соль Например, Al2S3 |
Эсоли = 1∙ f = 1 / n ∙ В = = Э [Al2S3] = 1/2 ∙ 3 = 1/6 |
М экв =M ∙ f = = M / n ∙ В М(1/6 Al2S3) = = 150 / 6 = 25 г/моль |
Эквивалент и молярная масса эквивалента сложного вещества определяются конкретной реакцией, в которой участвует данное вещество.
Пример 1.
Чему равен эквивалент и молярная масса эквивалента серной кислоты в реакциях с раствором щелочи, если образуется:
а) NаНSО4 и б) Nа2SО4?
Решение.
А) В реакции с образованием гидросульфата натрия серная кислота нейтрализуется не полностью:
Н2SО4 + NаОН = NаНSO4 + Н2О.
В этой реакции серная кислота проявляет основность равную 1. Из этого следует, что фактор эквивалентности этой кислоты в данной реакции равен 1. Найдем значение эквивалента кислоты в данной реакции:
Э (H2SO4) =1∙ f = 1/основность = 1.
Найдем значение молярной массы эквивалента кислоты:
Мэкв (H2SO4) =M ∙ f = M/основность = 98/1 = 98 г/экв,
б) Сульфат натрия образуется при полной нейтрализации кислоты:
Н2SО4 + 2NаОН = Na2SO4 +2Н2О.
В этой реакции основность, проявляемая Н2SO4, равна 2 и значение фактора эквивалентности в этом случае равно 2.
Отсюда:
Э (H2SO4) =1 ∙ f = 1/основность = 1/2 моль,
Мэкв (½H2SO4) = M/основность = 98/2= 49 г/моль.
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента (Vэкв).
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях. Размерность молярного объема эквивалента [л/моль].
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г.
Пример 2.
Используя следствие из закона Авогадро, рассчитать объем, занимаемый одним эквивалентом водорода.
Решение.
1 моль молекул Н2 имеет массу 2 г и занимает объем 22,4 л, а объем, занимаемый одним эквивалентом водорода (одним моль атомов элемента водорода), который имеет массу 1 г, найдем из пропорции:
2 г Н2 → 22,4 л
1 г Н2 → х л
x = 11,2 л, т.е. Vэкв (H) =11,2 л/моль.
Аналогично можно рассчитать молярный объем эквивалента для кислорода, который будет равен:
Vэкв (½O) = 5,6 л/моль.
Введение в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов: массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:
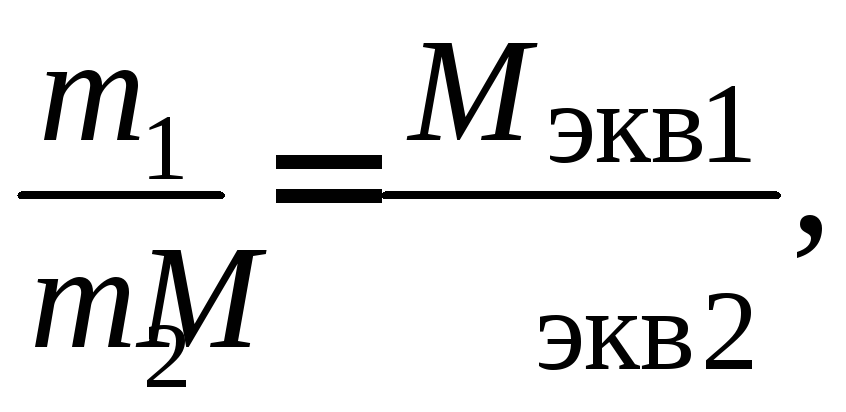
где m1 и m2 - массы взаимодействующих веществ; Мэкв.1 и Мэкв.2 - молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием «молярный объем эквивалента» и следующей формулировкой закона эквивалентов: объемы реагирующих друг с другом газообразных веществ пропорциональны молярным объемам их эквивалентов.
V1/V2 = Vэкв1/Vэкв2 , где
V1 и V2 - объемы реагирующих газообразных веществ,
Vэкв1 и Vэкв2 - молярные объемы их эквивалентов.
Пример 3.
Выразите в молях:
а) 6,02·1021 молекул СО2;
б) 1,20·1024 атомов кислорода;
в) 2,00·1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02·1023). Отсюда
а) 6,02·1021, т.е. 0,01 моль;
б) 1,20·1024, т.е. 2 моль;
в) 2,00·1023, т.е. 1 /З моль.
Масса моля вещества выражается в г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а.е.м., то их мольные (молярные) массы равны:
а) 44 г/моль;
б) 18г/моль;
в) 16 г/моль.
Пример 4.
Вычислите значение грамм-эквивалента серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
ЭH2SO4 =МH2SO4 /2=98/2=49г ЭСа(OH)2 =МСа(OH)2 /2=74/2=37г Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Пример 5.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Решение.
Нормальные
условия по Международной системе единиц
(СИ): давление 1,013·105 Па
(760 мм
Согласно закону эквивалентов
m1/Мэ(1) = m2/Мэ(2)
m(МеО)/Мэ(МеО) = m(Н2)/Мэ(Н2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (мл, л, м 3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. Отношение mH2 /МЭ(Н2) заменяем равным ему отношением VH2 /VЭ(Н2), где VH2 – объем водорода, VЭ(Н2) эквивалентный объем водорода:
m(МеО)/Мэ(МеО) = V(Н2)/Vэ(Н2)
Находим эквивалентную массу оксида металла МЭ(МеО)
7,09/МЭ(МеО) = 2,24/11,2; МЭ(МеО) = 7,09·11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов МЭ(МeO) = МЭ(Мe) + МЭ(O2),
отсюда МЭ(Мe) = МЭ(МeО) – МЭ(O2) = 35,45 – 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения:
МЭ = А/В,
где: МЭ – эквивалентная масса, г/моль
А – мольная масса металла, г/моль
В – валентность элемента;
А = Мэ·В = 27,45•2 = 54,9 г/моль.
Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 6.
При
25 0С
и давлении
93 кПа. (745 мм
Решение.
Подставляя данные задачи в последнее уравнение, получаем:
![]()
