
- •545 :: 546 :: 547 :: 548 :: 549 :: Содержание
- •I. Основные системы регуляции метаболизма и межклеточной коммуникации
- •545 :: 546 :: 547 :: 548 :: 549 :: Содержание
- •549 :: 550 :: 551 :: 552 :: 553 :: 554 :: 555 :: 556 :: 557 :: Содержание
- •II. Взаимодействие гормонов с рецепторами и механизмы передачи гормональных сигналов в клетки
- •549 :: 550 :: 551 :: 552 :: 553 :: 554 :: 555 :: 556 :: 557 :: Содержание
- •III. Строение, биосинтез и биологическое действие гормонов
- •2. Кортиколиберин
- •1. Биосинтез йодтиронинов
- •1. Синтез и секреция катехоламинов
- •1. Инсулин. Строение, синтез и секреция
- •5. Другие гормоны желудочно-кишечного тракта
- •587 :: 588 :: 589 :: 590 :: 591 :: 592 :: Содержание
- •IV. Регуляция обмена основных энергоносителей
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •1. Обмен углеводов
- •1. Симптомы сахарного диабета
- •597 :: 598 :: 599 :: 600 :: 601 :: 602 :: 603 :: 604 :: Содержание
- •604 :: 605 :: 606 :: 607 :: 608 :: 609 :: Содержание
- •VII. Регуляция обмена ионов кальция и фосфатов
- •1. Синтез и секреция птг
- •609 :: 610 :: 611 :: 612 :: 613 :: 614 :: 615 :: Содержание
597 :: 598 :: 599 :: 600 :: 601 :: 602 :: 603 :: 604 :: Содержание
604 :: 605 :: 606 :: 607 :: 608 :: 609 :: Содержание
VII. Регуляция обмена ионов кальция и фосфатов
В организме взрослого человека содержится в среднем 1000 г кальция. Основным депо кальция в организме (99% всего кальция от общей массы) являются кости. В костях около 99% кальция присутствует в малорастворимой форме кристаллов гидроксиапатита [Са10(РО4)6(ОН)2Н2О]. В виде фосфатных солей в костях находится лишь 1% кальция, который может легко обмениваться и играть роль буфера при изменениях концентрации кальция в плазме крови. Другой фонд кальция (1% от общей массы кальция) - кальций плазмы крови. В плазму крови кальций поступает из кишечника (с водой и пищей) и из костной ткани (в процессе резорбции).
Кальций - не только структурный компонент костной ткани. Ионы кальция играют ключевую роль в мышечном сокращении, увеличивают проницаемость мембраны клеток для ионов калия, влияют на натриевую проводимость клеток, на работу ионных насосов, способствуют секреции гормонов, участвуют в каскадном механизме свёртывания крови. Кроме этого, они служат важнейшими посредниками во внутриклеточной передаче сигналов.
Концентрация кальция внутри клеток зависит от его концентрации во внеклеточной жидкости. Пределы колебаний общей концентрации Са2+в плазме крови здоровых людей составляют

Рис. 11-36. Биологическое действие ПНФ.1 - ингибирует выделение ренина; 2 - ингибирует секрецию альдостерона; 3 - ингибирует секрецию АДГ; 4 - вызывает релаксацию сосудов.
2,12-2,6 ммоль/л, или 9-11 мг/дл. Кальций плазмы крови представлен в виде:
несвязанного, ионизированного кальция (около 50%);
ионов кальция, соединённых с белками, главным образом, с альбумином (45%);
недиссоциирующих комплексов с цитратом, сульфатом, фосфатом и карбонатом (5%).
Биологически активной фракцией является ионизированный кальций, концентрация которого поддерживается в пределах 1,1-1,3 ммоль/л.
Изменение уровня кальция может привести к нарушению многих процессов: изменению порога возбудимости нервных и мышечных клеток, нарушению функционирования кальциевого насоса, снижению активности ферментов и нарушению гормональной регуляции метаболизма. Концентрация Са2+в плазме регулируется с высокой точностью: изменение её всего на 1% приводит в действие гомеостатические механизмы, восстанавливающие равновесие.
604
Основными регуляторами обмена Са2+в крови являются паратгормон, калыщтриол и каль-цитонин.
А. Паратгормон
Паратгормон (ПТГ) - одноцепочечный полипептид, состоящий из 84 аминокислотных остатков (около 9,5 кД), действие которого направлено на повышение концентрации ионов кальция и снижение концентрации фосфатов в плазме крови.
1. Синтез и секреция птг
ПТГ синтезируется в паращитовидных железах в виде предшественника - препрогормона, содержащего 115 аминокислотных остатков. Во время переноса в ЭР от препрогормона отщепляется сигнальный пептид, содержащий 25 аминокислотных остатков. Образующийся прогормон транспортируется в аппарат Гольджи, где происходит превращение предшественника в зрелый гормон, включающий 84 аминокислотных остатка (ПТГ1-84). Паратгормон упаковывается и хранится в секреторных гранулах (везикулах). Интактный паратгормон может расщепляться на короткие пептиды: N-концевые, С-концевые и срединные фрагменты. N-концевые пептиды, содержащие 34 аминокислотных остатка, обладают полной биологической активностью и секретируются железами наряду со зрелым паратгормоном. Именно N-концевой пептид отвечает за связывание с рецепторами на клетках-мишенях. Роль С-концевого фрагмента точно не установлена. Скорость распада гормона уменьшается при низкой концентрации ионов кальция и увеличивается, если концентрация ионов кальция высока.
Секреция ПТГ регулируется уровнем ионов кальция в плазме: гормон секретируется в ответ на снижение концентрации кальция в крови.
2. Роль паратгормона в регуляции обмена кальция и фосфатов
Органы-мишени для ПТГ - кости и почки. В клетках почек и костной ткани локализованы специфические рецепторы, которые взаимодействуют с паратгормоном, в результате чего инициируется каскад событий, приводящий к активации аденилатциклазы. Внутри клетки возрастает концентрация молекул цАМФ, действие которых стимулирует мобилизацию ионов кальция из внутриклеточных запасов. Ионы кальция активируют киназы, которые фосфорилируют особые белки, индуцирующие транскрипцию специфических генов.
В костной ткани рецепторы ПТГ локализованы на остеобластах и остеоцитах, но не обнаружены на остеокластах. При связывании паратгормона с рецепторами клеток-мишеней остеобласты начинают усиленно секретировать инсулиноподобный фактор роста 1 и цитокины. Эти вещества стимулируют метаболическую активность остеокластов. В частности, ускоряется образование ферментов, таких как щелочная фосфатаза и коллагеназа, которые воздействуют на компоненты костного матрикса, вызывают его распад, в результате чего происходит мобилизация Са2+и фосфатов из кости во внеклеточную жидкость (рис. 11-37).
В почках ПТГ стимулирует реабсорбцию кальция в дистальных извитых канальцах и тем самым снижает экскрецию кальция с мочой, уменьшает реабсорбцию фосфатов.
Кроме того, паратгормон индуцирует синтез кальцитриола (1,25(OH)2D3), который усиливает всасывание кальция в кишечнике.
Таким образом, паратгормон восстанавливает нормальный уровень ионов кальция во внеклеточной жидкости как путём прямого воздействия на кости и почки, так и действуя опосредованно (через стимуляцию синтеза кальцитриола) на слизистую оболочку кишечника, увеличивая в этом случае эффективность всасывания Са2+в кишечнике. Снижая реабсорбцию фосфатов из почек, паратгормон способствует уменьшению концентрации фосфатов во внеклеточной жидкости.
3. Гиперпаратиреоз
При первичном гиперпаратиреозе нарушается механизм подавления секреции паратгормона в ответ на гиперкальциемию. Это заболевание встречается с частотой 1:1000. Причинами могут быть опухоль околощитовидной железы (80%) или диффузная гиперплазия желёз, в некоторых случаях рак паращитовидной железы (менее 2%). Избыточная секреция паратгормона приводит к повышению мобилизации кальция и фосфатов из костной ткани, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия,
605
которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляются общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья. Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии.
Вторичный гиперпаратиреоз встречается при хронической почечной недостаточности и дефиците витамина D3и сопровождается гипокальциемией, связанной в основном с нарушением всасывания кальция в кишечнике из-за угнетения образования кальцитриола поражёнными почками. В этом случае секреция паратгормона увеличивается. Однако повышенный уровень паратгормона не может нормализовать концентрацию ионов кальция в плазме крови вследствие нарушения синтеза кальцитриола и снижения всасывания кальция в кишечнике. Наряду с гипокальциемией, нередко наблюдают гиперфостатемию. У больных развивается повреждение скелета (остеопороз) вследствие повышения мобилизации кальция из костной ткани. В некоторых случаях (при развитии аденомы или гиперплазии околощитовидных желёз) автономная гиперсекреция паратгормона компенсирует гипокальциемию и приводит к гипер-кальциемии (третичный гиперпаратиреоз).
4. Гипопаратиреоз
Основной симптом гипопаратиреоза, обусловленный недостаточностью паращитовидных желёз, - гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические нарушения и нарушения ССС, а также поражения соединительной ткани. У больного гипопарати-реозом отмечают повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
Б. Кальцитриол
Как и другие стероидные гормоны, кальцитриол синтезируется из холестерола.

Рис. 11-37. Биологическое действие паратгормона.1 - стимулирует мобилизацию кальция из кости; 2 - стимулирует реабсорбцию ионов кальция в дистальных канальцах почек; 3 - активирует образование кальцитриола, 1,25(OH)2D3в почках, что приводит к стимуляции всасывания Са2+в кишечнике; 4 - повышает концентрацию кальция в межклеточной жидкости, тормозит секрецию ПТГ. МКЖ - межклеточная жидкость.
Действие гормона направлено на повышение концентрации кальция в плазме крови.
1. Строение и синтез кальцитриола
В коже 7-дегидрохолестерол (провитамин D3) превращается в непосредственного предшественника кальцитриола - холекальциферол (витамин D3). В ходе этой неферментативной реакции под влиянием УФ-излучения связь между девятым и десятым атомами углерода в молекуле холестерола разрывается, раскрывается кольцо В, и образуется холекальциферол (рис. 11-38). Так образуется в организме человека большая часть витамина D3, однако небольшое его количество поступает с пищей и всасывается в тонком кишечнике вместе с другими жирорастворимыми витаминами.
606

Рис. 11-38. Схема синтеза кальцитриола.1 - холестерол является предшественником кальцитриола; 2 - в коже 7-дегидрохолестерол неферментативно превращается в холекальциферол; 3 - в печени 25-гидроксилаза превращает холекальциферол в кальцидиол; 4 - в почках образование кальцитриола катализируется 1α-гидроксилазой.
607
В эпидермисе холекальциферол связывается со специфическим витамин D-связывающим белком (транскальциферином), поступает в кровь и переносится в печень, где происходит гидроксилирование по 25-му атому углерода с образованием кальцидиола [25-гидроксихолекальциферол, 25(OH)D3]. В комплексе с витамин D-связывающим белком кальцидиол транспортируется в почки и гидроксилируется по первому углеродному атому с образованием кальцитриола [1,25(OH)2D3]. Именно 1,25(OH)2D3представляет собой активную форму витамина D3.
Гидроксилирование, протекающее в почках, является скорость-лимитирующей стадией. Эта реакция катализируется митохондриальным ферментом lα-гидроксилазой. Паратгормон индуцирует la-гидроксилазу, тем самым стимулируя синтез 1,25(OH)2D3. Низкая концентрация фосфатов и ионов Са2+ в крови также ускоряет синтез кальцитриола, причём ионы кальция действуют опосредованно через парат-гормон.
При гиперкальциемии активность 1α-гидроксилазы снижается, но повышается активность 24α-гидроксилазы. В этом случае увеличивается продукция метаболита 24,25(OH)2D3, который, возможно, и обладает биологической активностью, но роль его окончательно не выяснена.
2. Механизм действия кальцитриола
Кальцитриол оказывает воздействие на тонкий кишечник, почки и кости. Подобно другим стероидным гормонам, кальцитриол связывается с внутриклеточным рецептором клетки-мишени. Образуется комплекс гормон-рецептор, который взаимодействует с хроматином и индуцирует транскрипцию структурных генов, в результате чего синтезируются белки, опосредующие действие кальцитриола. Так, например, в клетках кишечника кальцитриол индуцирует синтез Са2+-переносящих белков, которые обеспечивают всасывание ионов кальция и фосфатов из полости кишечника в эпителиальную клетку кишечника и далее транспорт из клетки в кровь, благодаря чему концентрация ионов кальция во внеклеточной жидкости поддерживается на уровне, необходимом для минерализации органического матрикса костной ткани. В почках кальцитриол стимулирует реабсорбцию ионов кальция и фосфатов. При недостатке кальцитриола нарушается образование аморфного фосфата кальция и кристаллов гидроксиапатитов в органическом матриксе костной ткани, что приводит к развитию рахита и остеомаляции. Обнаружено также, что при низкой концентрации ионов кальция кальцитриол способствует мобилизации кальция из костной ткани.
3. Рахит
Рахит - заболевание детского возраста, связанное с недостаточной минерализацией костной ткани. Нарушение минерализации кости - следствие дефицита кальция. Рахит может быть обусловлен следующими причинами: недостатком витамина D3в пищевом рационе, нарушением всасывания витамина D3в тонком кишечнике, снижением синтеза предшественников кальцитриГола из-за недостаточного времени пребывания на солнце, дефектом 1α-гидроксилазы, дефектом рецепторов кальцитриола в клетках-мишенях. Всё это вызывает снижение всасывания кальция в кишечнике и снижение его концентрации в крови, стимуляцию секреции паратгормона и вследствие этого мобилизацию ионов кальция из кости. При рахите поражаются кости черепа; грудная клетка вместе с грудиной выступает вперёд; деформируются трубчатые кости и суставы рук и ног; увеличивается и выпячивается живот; задерживается моторное развитие. Основные способы предупреждения рахита - правильное питание и достаточная инсоляция.
В. РОЛЬ КАЛЬЦИТОНИНА В РЕГУЛЯЦИИ ОБМЕНА КАЛЬЦИЯ
Кальцитонин - полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью. Гормон секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации Са2+и уменьшается при понижении концентрации Са2+в крови. Кальцитонин - антагонист паратгормона. Он ингибирует высвобождение Са2+из кости, снижая активность остеокластов. Кроме того, кальцитонин подавляет канальцевую реабсорбцию
608
ионов кальция в почках, тем самым стимулируя их экскрецию почками с мочой. Скорость секреции кальцитонина у женщин сильно зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает ускорение мобилизации кальция из костной ткани, что приводит к развитию остеопороза.
609
604 :: 605 :: 606 :: 607 :: 608 :: 609 :: Содержание
609 :: 610 :: 611 :: 612 :: 613 :: 614 :: 615 :: Содержание
VIII. РОЛЬ ГОРМОНОВ В РЕГУЛЯЦИИ РЕПРОДУКТИВНОЙ ФУНКЦИИ ОРГАНИЗМА
Репродуктивные функции организма регулируются половыми гормонами: у мужчин - тестостероном, у женщин - эстрогенами и прогестинами. Синтез и секреция половых гормонов, в свою очередь, находятся под контролем фол-ликулостимулирующего и лютеинизирующего гормонов.
А. Гонадотропные гормоны гипофиза, стимулирующие синтез и секрецию половых гормонов
Фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ) - гонадотропные гормоны гипофиза. Представляют собой гликопротеины с молекулярной массой около 30 кД, состоящие из α- и β-субъединиц. α-Субъединицы содержат 92 аминокислоты и две боковые углеводные цепи и идентичны α-субъединице тиреотропина, β-Субъединицы индивидуальны для каждого гормона.
1. Регуляция секреции ФСГ и ЛГ
Образование и освобождение обоих гормонов стимулируется гипоталамическим декапеп-тидом - гонадотропин-рилизинг-гормоном, секреция которого происходит эпизодически, что в основном и определяет импульсный характер секреции ЛГ и ФСГ.
У женщин эстрогены и прогестерон по механизму обратной связи влияют на секрецию ЛГ и ФСГ как на гипоталамическом, так и на гипофизарном уровне.
У мужчин тестостерон и эстроген, образованный в клетках Лейдига и в процессе метаболизма тестостерона, блокируют по механизму обратной связи синтез и секрецию гонадолиберина и гонадотропных гормонов гипофиза. Кроме этого, клетками гранулёзы фолликулов и клетками Сертоли вырабатывается белок ингибин, который тормозит гипофизарную секрецию ФСГ.
Т1/2ФСГ составляет примерно 150 мин, а Т1/2ЛГ - 30 мин.
2. Механизм действия и эффекты ФСГ и ЛГ
Гонадотропные гормоны ЛГ и ФСГ связываются с рецепторами на мембранах своих клеток-мишеней в яичниках и яичках, в результате чего происходит активация аденилатциклазной системы. Образующийся цАМФ активирует протеинкиназу, которая фосфорилирует белки, опосредующие эффекты ЛГ и ФСГ.
У женщин лютеинизирующий гормон стимулирует образование прогестерона клетками жёлтого тела, у мужчин - синтез тестостерона интерстициальными клетками Лейдига. ФСГ ускоряет развитие фолликулов в яичниках и образование эстрогенов, а действуя на клетки Сертоли, запускает процесс сперматогенеза.
Б. Мужские половые гормоны
Мужские половые гормоны (рис. 11-39) вырабатываются в основном в мужских половых железах - в интерстициальных клетках Лейдига семенников (95%). Небольшое количество андрогенов образуется в коре надпочечников.
1. Синтез андрогенов
Путь биосинтеза андрогенов в яичках и коре надпочечников одинаков. Предшественником андрогенов, как и других стероидных гормонов, служит холестерол (рис. 11-40), который либо поступает из плазмы в составе ЛПНП, либо синтезируется в самих железах из ацетил-КоА.
Отщепление боковой цепи холестерола и образование прегненолона -скорость-лимитирующая реакция. Однако, в отличие от аналогичной реакции, протекающей в надпочечниках, эта стадия стимулируется ЛГ (а не АКТГ). ЛГ, связываясь с рецептором плазматической мембраны клеток Лейдига, активирует аденилатциклазу, увеличивая тем самым внутриклеточную концентрацию цАМФ, что в конечном итоге вызывает активацию фермента, который расщепляет боковую цепь холестерола между С-20 и С-22.
609

Рис. 11-39. Мужские половые гормоны.

Рис. 11-40. Схема синтеза половых гормонов.Предшественником половых гормонов служит холестерол. Образование прегненолона происходит в результате отщепления боковой цепи холестерола (1). Превращение прегненолона в тестостерон может протекать двумя путями: через образование прогестерона (2) или дегидроэпиандростерона (3). Тестостерон служит предшественником дигидротестостерона (4). В некоторых периферических тканях небольшое количество тестостерона превращается в эстрадиол (5). В яичниках синтезируются женские половые гормоны, эстрогены и прогестины, среди которых наиболее активными являются 17β-эстрадиол и прогестерон. Ароматизация андрогенов протекает под действием ароматазного комплекса, содержащего цитохром Р450-оксидазу, и включает 3 реакции гидроксилирования с участием О2и NADPH.
610
Тестостерон. Превращение прегненолона в тестостерон катализируется пятью микросо-мальными ферментами и может протекать двумя путями: через образование дегидроэпиандростерона или через образование прогестерона (что, по-видимому, преобладает в семенниках человека).
Суточная секреция тестостерона у мужчин составляет в норме примерно 5 мг и сохраняется на протяжении всей жизни организма. Гормон циркулирует в крови в связанном с белками плазмы состоянии: альбумином (40%) и специфически связывающим половые гормоны р-глобулином (называемым секс-гормонсвязывающим глобулином, СГСГ). Лишь 2% от общего количества гормона в крови транспортируется в свободном виде, и именно такие молекулы проявляют биологическую активность.
Дигидротестостерон. В семенных канальцах, предстательной железе, коже, наружных половых органах тестостерон служит предшественником более активного адцрогена - дигидротестостерона (рис. 11-41, 11-42). Это превращение, в котором участвует примерно 4% тестостерона, происходит в результате восстановления двойной связи кольца А и 3-кетогруппы при участии цитоплазматического фермента - NADPH-зависимой 5α-редуктазы. Семенники человека секретируют в сутки до 50-100 мкг дигидротестостерона. Однако большее количество гормона - следствие периферических превращений, и суммарная сугочная секреция дигидротестостерона составляет 400 мкг, что почти в 10 раз меньше уровня секреции тестостерона.
В некоторых периферических тканях небольшое количество тестостерона превращается в эстрадиол. В качестве побочных продуктов клетки Лейдига также постоянно секретируют эстрадиол и прогестерон, хотя роль этих гормонов в развитии и поддержании функций размножения и формирования полового поведения у мужчин до настоящего времени не выяснена.
2. Регуляция синтеза и секреции андрогенов
В препубертатный период секреция андрогенов подавляет по механизму отрицательной обратной связи секрецию гонадотропина до начала пубертатного периода, когда гипофизарные клетки становятся менее чувствительными к ингибирующему действию циркулирующих в крови андрогенов. Эта потеря чувствительности приводит к циклически импульсному освобождению ЛГ и ФСГ. ЛГ, связьюаясь с рецепторами клеток Лейдига, стимулирует образование тестостерона интерстициальными клетками Лейдига, а ФСГ, связываясь с рецепторами клеток Сертоли в семенниках, стимулирует сперматогенез (рис. 11-41).
Тестостерон замыкает отрицательную обратную связь на уровне гипофиза и гипоталамуса, уменьшая частоту секреторных импульсов ЛГ. Торможение секреции ФСГ аденогипофизом происходит под действием белка ингибина, вырабатываемого клетками Сертоли. ФСГ стимулирует синтез этого белка, который по механизму отрицательной обратной связи тормозит дальнейшую секрецию ФСГ.
3. Мишени для андрогенов
К мишеням тестостерона относят эмбриональные вольфовы структуры, сперматогонии, мышцы, кости, почки, мозг. Подобно другим стероидным гормонам, андрогены образуют внутри клетки комплекс с рецептором, который связывается с определённым участком хроматина, активируя специфические гены, белковые продукты которых опосредуют биологические эффекты андрогенов.
4. Эффекты андрогенов
Физиологическое действие андрогенов различно в разные периоды жизни организма. У эмбриона под действием андрогенов из вольфова протока образуются придаток яичка (эпидидимис), семявыносящий проток и семенной пузырёк. У плода мужского пола происходит маскулинизация мозга. Поскольку андрогены в организме обладают мощным анаболическим действием и стимулируют клеточное деление, повышенный уровень андрогенов в препубертатный период приводит к скачкообразному увеличению линейных размеров тела, увеличению скелетных мышц, росту костей, но одновременно способствуют и остановке роста, так как стимулируют сращение эпифизов длинных костей с их стволами. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса вследствие утолщения голосовых связок и увеличения объёма гортани, стимулируют секрецию сальных желёз.
611
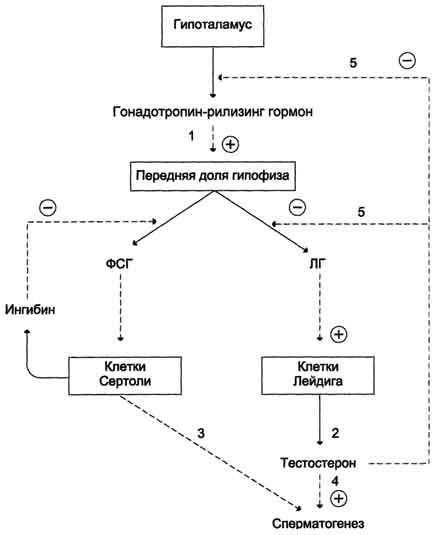
Рис. 11-41. Регуляция синтеза и секреции мужских половых гормонов.Синтез и секреция мужских половых гормонов регулируется гипоталамо-гипофизарной системой по механизму отрицательной обратной связи. Секреция ЛГ и ФСГ стимулируется гонадотропин-рилизинг гормоном. ЛГ ускоряет синтез и секрецию тестостерона клетками Лейдига, ФСГ стимулирует сперматогенез. Тестостерон стимулирует сперматогенез, ингибирует синтез и секрецию гонадотропин-рилизинг гормона и ЛГ.
В. Женские половые гормоны
В яичниках синтезируются женские половые гормоны - эстрогены и прогестины, среди которых наиболее активны 17β-эстрадиол и прогестерон (рис. 11-42).
1. Образование эстрогенов
Согласно современным представлениям, образование эстрогенов яичников предполагает выработку андрогенов (андростендиона) в клетках теки фолликулов с последующей ароматизацией андрогенов в клетках гранулёзы. В клетках теки синтезируются рецепторы ЛГ. Рецепторы ФСГ образуются в клетках гранулёзы. ЛГ, связываясь с рецепторами клеток теки и активируя фермент, который катализирует отщепление боковой цепи холестерола и превращение его в прегненолон, тем самым стимулирует образование основного андрогена яичников - андростендиона. ФСГ, взаимодействуя с рецепторами клеток гранулёзы, активирует содержащийся в этих клетках ароматазный ферментативный комплекс и стимулирует превращение андрогенов, вырабатываемых клетками теки, в эстрогены. Ароматизация андрогенов под действием ароматазного комплекса, содержащего цитохром Р450-оксидазу, включает 3 реакции гидроксилирования,
612

Рис. 11-42. Женские половые гормоны.
которые протекают с участием О2и NADPH.
Непосредственно в клетках теки синтезируется очень небольшое количество эстрогенов. Значительная часть эстрогенов продуцируется путём периферической ароматизации андрогенов в жёлтом теле, фетоплацентарном комплексе (во время беременности), корой надпочечников, в жировых клетках, печени, коже и других тканях, где обнаружена повышенная ароматазная активность.
В клетках гранулёзы может синтезироваться менее активный эстроген - эстрон, а ещё менее активный эстриол образуется из эстрона в крови. В печени β-эстрадиол инактивируется в результате гидроксилирования ароматического кольца по атому углерода С2и образования конъюгатов с серной или глюкуроновой кислотами, которые и выводятся из организма с жёлчью или мочой.
Примерно 95% циркулирующих в крови эстрогенов связано с транспортными белками - СГСЁ (секс-гормонсвязывающий белок) и альбумином. Биологической активностью обладает только свободная форма эстрогенов.
2.Регуляция секреции эстрогенов
В детском возрасте незрелые яичники вырабатывают небольшое количество гормонов, поэтому концентрация эстрогенов в крови низкая. В пубертатный период чувствительность гипоталамо-гипофизарной системы к действию ЛГ и ФСГ снижается. Импульсная секреция гонадотропин-рилизинг-гормона устанавливает суточный ритм секреции ЛГ и ФСГ. В начале каждого менструального цикла секреция ФСГ и ЛГ вызывает развитие первичных фолликулов. Созревающий фолликул в результате совместного действия ЛГ, стимулирующего продукцию андрогенов клетками теки, и ФСГ, стимулирующего ароматизацию андрогенов, секретирует эстрогены, которые по механизму отрицательной обратной связи угнетают секрецию ФСГ. Концентрация ФСГ в крови остаётся низкой ещё и в результате торможения секреции этого гормона белком ингибином, выделяемым яичниками (рис. 11-43).
По мере созревания фолликула (фолликулярная фаза) концентрация эстрадиола повышается, чувствительность гипофизарных клеток к гонадолиберину возрастает, и эстрадиол по механизму положительной обратной связи повышает секрецию ЛГ и ФСГ.
Повышение секреции ЛГ приводит к овуляции - освобождению яйцеклетки из лопнувшего фолликула. После овуляции клетки гранулёзы превращаются в жёлтое тело, которое, помимо эстрадиола, начинает вырабатывать
613

Рис. 11-43. Регуляция секреции женских половых гормонов.Гонадотропин-рилизинг гормон стимулирует секрецию ЛГ и ФСГ, которые совместно с эстрогеном и прогестероном регулируют половой цикл у женщин. Эстрадиол и прогестерон по механизму отрицательной обратной связи регулируют синтез и секрецию ЛГ и ФСГ.
всё большее количество основного гормона лютеиновой фазы - прогестерона (прогестина). Если возникает беременность, жёлтое тело продолжает функционировать и секретировать прогестерон, однако на более поздних этапах беременности прогестерон в основном продуцируется плацентой. Если оплодотворение не происходит, высокая концентрация прогестерона в плазме крови по механизму отрицательной обратной связи угнетает активность гипоталамо-гипофизарной системы, тормозится секреция ЛГ и ФСГ, жёлтое тело разрушается, и снижается продукция стероидов яичниками. Наступает менструация, которая длится примерно 5 дней, после чего начинает формироваться новый поверхностный слой эндометрия, и возникает новый цикл.
3. Механизм действия и биологические эффекты эстрогенов
Эстрогены связываются с внутриклеточными рецепторами и, подобно другим стероидным гормонам, регулируют транскрипцию структурных генов. Предполагается, что эстрогены индуцируют синтез свыше 50 различных белков, участвующих в проявлении физиологических эффектов эстрогенов.
Эстрогены стимулируют развитие тканей, участвующих в размножении, определяют развитие многих женских вторичных половых признаков, регулируют транскрипцию гена рецептора прогестина. В лютеиновой фазе под действием эстрогенов вместе с прогестинами пролиферативный эндометрий (эпителий матки) превращается в секреторный, подготавливая его к имплантации оплодотворённой яйцеклетки.
614
Совместно с простагландином F2α эстрогены увеличивают чувствительность миометрия к действию окситоцина во время родов. Эстрогены оказывают анаболическое действие на кости и хрящи. Другие метаболические эффекты эстрогенов включают поддержание нормальной структуры кожи и кровеносных сосудов у женщин, способствуют образованию оксида азота в сосудах гладких мышц, что вызывает их расширение и усиливает теплоотдачу. Эстрогены стимулируют синтез транспортных белков тиреоидных и половых гормонов. Эстрогены могут индуцировать синтез факторов свёртывания крови II, VII, IX и X, уменьшать концентрацию антитромбина III.
Эстрогены оказывают влияние на обмен липидов. Так, увеличение скорости синтеза ЛПВП и торможение образования ЛПНП, вызываемое эстрогенами, приводит к снижению содержания холестерола в крови.
4. Образование прогестерона
Прогестерон, образующийся главным образом жёлтым телом во время менструации в лю-теиновую фазу, секретируется также фетоплацентарным комплексом во время беременности. В небольших количествах он вырабатывается у женщин и мужчин корой надпочечников. В фолликулярной фазе менструального цикла концентрация прогестерона в плазме обычно не превышает 5 нмоль/л, а в лютеиновой фазе увеличивается до 40-50 нмоль/л. В крови прогестерон связывается с транспортным глобулином транскортином и альбумином, и только 2% гормона находится в свободной биологически активной форме. Диффундируя в клетки-мишени, прогестерон связывается со специфическим ядерным рецептором. Образующийся комплекс гормон-рецептор взаимодействует с промоторным участком ДНК и активирует транскрипцию генов. Т1/2прогестерона в крови составляет 5 мин. В печени гормон конъюгируется с глюкуроновой кислотой и выводится с мочой.
5. Биологические эффекты прогестерона
Действие прогестерона в основном направлено на репродуктивную функцию организма. Образование прогестерона отвечает за увеличение базальной температуры тела на 0,2-0,5 °С, которое происходит сразу после овуляции и сохраняется на протяжении лютеиновой фазы менструального цикла. При высоких концентрациях прогестерон взаимодействует с рецепторами, локализованными в клетках почечных канальцев, конкурируя таким образом с альдостероном. В результате конкурентного игибирования альдостерон теряет возможность стимулировать реабсорбцию натрия.
Прогестерон может также оказывать действие и на ЦНС, в частности вызывать некоторые особенности поведения в предменструальный период.
615
