
Нейрохирургия
.pdf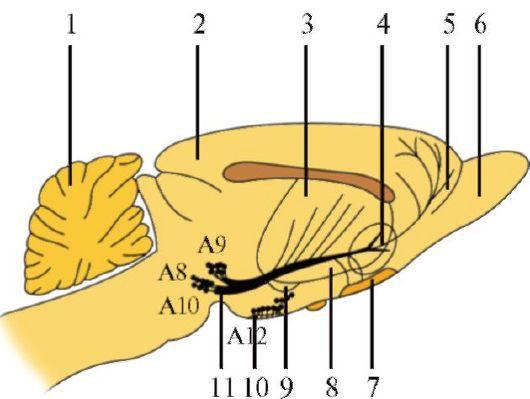
порядке, соответственно расположению в стволе мозга от нижних отделов к верхним.
Дофаминергические нейроны Дофаминсинтезирующие клетки (А8-А15) располагаются в среднем, промежуточном и конечном мозге (рис. 1.29). Наибольшая группа дофаминергических клеток - компактная часть черной субстанции (А9). Их аксоны формируют восходящий путь, проходящий через латеральную часть гипоталамуса и внутреннюю капсулу, нигростриарные пучки воло-
Рис.
1.29. Локализация дофаминергических нейронов и их путей в головном мозге крыс. 1 - мозжечок; 2 - кора головного мозга; 3 - полосатое тело; 4 - прилежащее ядро; 5 - лобная кора; 6 - обонятельная луковица; 7 - обонятельный бугор; 8 - хвостатое ядро; 9 - миндалевидное ядро; 10 - срединное возвышение; 11 - нигростриарный пучок. Основной путь (нигростриарный пучок) начинается в черном веществе (А8, А9) и проходит вперед к полосатому телу кон достигают хвостатого ядра и скорлупы. Совместно с дофаминергическими
нейронами ретикулярной субстанции (А8) они формируют нигростриарную систему. Основной путь (нигростриарный пучок) начинается в черном веществе (А8, А9) и проходит вперед к полосатому телу.
Мезолимбическая группа дофаминергических нейронов (А10) простирается от мезэнцефалических отделов до лимбической системы. Группа А10 формирует вентральную вершину у межножковых ядер в покрышке среднего мозга. Аксоны направляются к внутренним ядрам конечной борозды, перегородки, обонятельным бугоркам, прилежащему ядру (n. accumbens), поясной извилине.
Третья дофаминергическая система (А12), называемая тубероинфундибулярной, находится в промежуточном мозге, располагается в сером бугре и простирается до воронки. Эта система связана с нейроэндокринными функциями. Другие диэнцефальные группы клеток (А11, А13 и А14) и их клетки-мишени также располагаются в гипоталамусе. Маленькая группа А15 рассредоточена в обонятельной луковице и является единственной дофаминергической группой нейронов в конечном мозге.

Все дофаминовые рецепторы действуют через систему вторичных мессенджеров. Их постсинаптическое действие может быть возбуждающим или тормозным. Дофамин быстро захватывается обратно в пресинаптическое окончание, где метаболизируется моноаминоксидазой (МАО) и катехол-О-метилтрансферазой (КОМТ).
Норадренергические нейроны Норадренергические нервные клетки находятся только в узкой переднелатеральной зоне покрышки продолговатого мозга и моста
(рис. 1.30). Во-
Рис.
1.30. Локализация норадренергических нейронов и их путей в головном мозге крыс (парасагиттальный срез).
1 - мозжечок; 2 - дорсальный пучок; 3 - вентральный пучок; 4 - гиппокамп; 5 - кора головного мозга; 6 - обонятельная луковица; 7 - перегородка; 8 - медиальный переднемозговой пучок; 9 - концевая полоска; 10 - гипоталамус.
Основной путь начинается в голубом пятне (А6) и проходит вперед несколькими пучками, давая ответвления к различным отделам головного мозга. Также норадренергические ядра расположены в вентральной части ствола мозга (A1, A2, А5 и А7). Большинство их волокон идет вместе с волокнами нейронов голубого пятна, однако часть проецируется в дорсальном направлении локна, идущие от этих нейронов, поднимаются к среднему мозгу или нисходят к
спинному мозгу. Кроме того, норадренергические клетки имеют связи с мозжечком. Норадренергические волокна разветвляются обширнее, чем дофаминергические. Считается, что они играют роль в регуляции мозгового кровотока.
Самая большая группа норадренергических клеток (А6) расположена в составе голубого пятна (locus cereleus) и включает почти половину всех норадренергических клеток (рис. 1.31). Ядро расположено в верхней части моста у дна IV желудочка и простирается вверх вплоть до нижних холмиков четверохолмия. Аксоны клеток голубого пятна многократно ветвятся, их адренергические окончания можно найти во многих отделах ЦНС. Они оказывают модулирующее влияние на процессы созревания и обучения, переработку информации в мозге, регуляцию сна и эндогенное торможение боли.
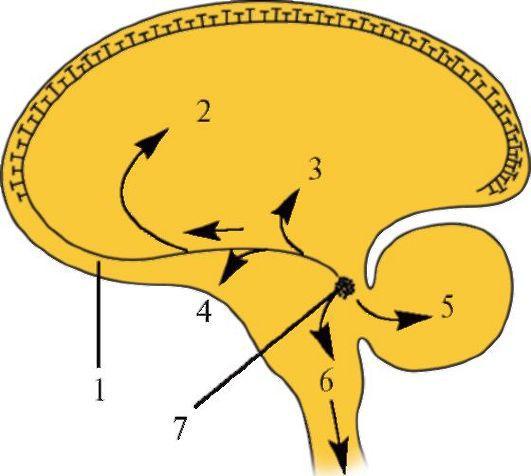
Задний норадренергический пучок берет свое начало от группы А6 и соединяется в среднем мозге с ядрами заднего шва, верхними и нижними бугорками четверохолмия; в промежуточном мозге - с передними ядрами таламуса, медиальным и латеральным коленчатыми телами; в конечном мозге - с миндалевидным телом, гиппокампом, неокортексом, поясной извилиной. Дополнительные волокна от клеток группы А6 идут к мозжечку через его верхнюю ножку (см. рис. 1.31). Нисходящие волокна от голубого пятна совместно с волокнами соседней группы клеток А7 идут к заднему ядру блуждающего нерва, нижней оливе и спинному мозгу. Переднебоко-
Рис.
1.31. Схема проводящих норадренергических путей от голубого ядра (пятна), расположенного в сером веществе моста.
1 - волокна проводящего пути; 2 - гиппокамп; 3 - таламус; 4 - гипоталамус и миндалевидное ядро; 5 - мозжечок; 6 - спинной мозг; 7 - голубое пятно вой нисходящий пучок от голубого пятна отдает волокна к передним и задним рогам спинного мозга.
Нейроны групп А1 и А2 располагаются в продолговатом мозге. Совместно с группами клеток моста (А5 и А7) они формируют передние восходящие норадренергические пути. В среднем мозге они проецируются на серое околоводопроводное ядро и ретикулярную формацию, в промежуточном мозге - на весь гипоталамус, в конечном мозге - на обонятельную луковицу. Кроме того, от этих групп клеток (А1, А2, А5, А7) бульбоспинальные волокна идут также к спинному мозгу.
В ПНС норадреналин (и в меньшей степени адреналин) является важным нейротрансмиттером симпатических постганглионарных окончаний вегетативной нервной системы.
Адренергические нейроны
Адреналинсинтезирующие нейроны находятся только в продолговатом мозге, в узкой переднелатеральной области. Наибольшая группа клеток С1 лежит позади заднего оливного ядра, средняя группа клеток С2 - рядом с ядром одиночного пути, группа клеток С3 - непосредственно под околоводопроводным серым веществом. Эфферентные пути от С1-С3 идут к заднему ядру блуждающего нерва, ядру одиночного пути, голубому пятну, околоводопроводному серому веществу моста и среднего мозга, гипоталамусу.
Существует 4 основных типа катехоламинергических рецепторов, различающихся по реакции на действие агонистов или антагонистов и по постсинаптическим эффектам. Рецепторы α1 управляют кальциевыми каналами при помощи вторичного мессенджера инозитолфосфата-3 и при активации повышают внутриклеточную концентрацию ионов Са2+. Стимуляция β2-рецепторов ведет к уменьшению концентрации вторичного
мессенджера цАМФ, что сопровождается различными эффектами. Рецепторы в посредством вторичного мессенджера цАМФ повышают проводимость мембран для ионов К+ генерируя тормозной постсинаптический потенциал. Серотонинергические нейроны Серотонин (5-гидрокситриптамин) образуется из аминокислоты триптофана.
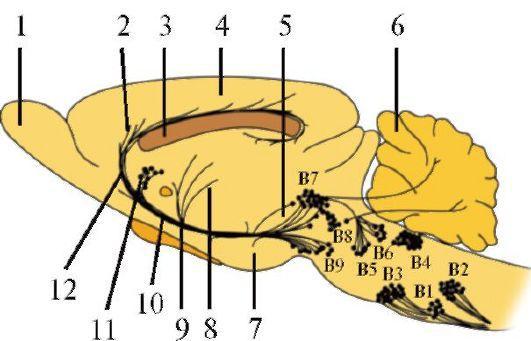
Большинство серотонинергических нейронов локализуются в медиальных отделах ствола мозга, образуя так называемые ядра шва (рис. 1.32). Группы В1 и В2 располагаются в продолговатом мозге, В3 - в пограничной зоне между продолговатым мозгом и мостом, В5 - в мосту, В7 - в среднем мозге. Нейроны шва В6 и В8 находятся в покрышке моста и среднем мозге. В ядрах шва также находятся нервные клетки, содержащие и другие нейротрансмиттеры, такие как дофамин, норадреналин, ГАМК, энкефалин и субстанция Р. По этой причине ядра шва называются также многотрансмиттерными центрами.
Проекции серотонинергических нейронов соответствуют ходу норадреналинергических волокон. Основная масса волокон направляется к структурам лимбической системы, ретикулярной формации и спинному мозгу. Существует связь с голубым пятном - основным сосредоточением норадреналинергических нейронов.
Большой передний восходящий тракт поднимается от клеток группы В6, В7 и В8. Он идет кпереди сквозь покрышку среднего мозга и латерально сквозь гипоталамус, затем отдает ветви по направлению к своду и поясной извилине. Посредством этого пути группы В6, В7 и В8 связаны в среднем мозге с межножковыми ядрами и черной субстанцией, в промежуточном мозге - с ядрами поводка, таламуса и гипоталамусом, в конечном мозге - с ядрами перегородки и обонятельной луковицей.
Существуют многочисленные проекции серотонинергических нейронов на гипоталамус, поясную извилину и обонятельную кору, а также связи со стриатумом и лобной корой. Более короткий задний восходящий тракт соединяет клетки групп В3, В5 и В7 посредством заднего продольного пучка с околоводопроводным серым веществом и задней гипоталамической областью. Помимо этого, существуют серотонинергические проекции на мозжечок (от В6 и В7) и спинной мозг (от В1 до В3), а также многочисленные волокна, соединяющиеся с ретикулярной формацией. Высвобождение серотонина происходит обычным способом. На постсинаптической мембране располагаются рецепторы, которые с помощью вторичных мессенджеров открывают каналы для ионов К+ и Са2+. Выделяют 7 классов рецепторов к серотонину: 5-НТ1 - 5-НТ7, поразному отвечающих на действие агонистов и антагонистов. Рецепторы 5-HT1, 5-HT2 и 5-НТ4 расположены в головном мозге, рецепторы 5- НТ3 - в ПНС. Действие серотонина заканчивается с помощью механизма обратного захвата нейротрансмиттера пресинаптическим окончанием.
Серотонин, не поступивший в везикулы, дезаминируется с помощью МАО. Существует ингибиторное влияние нисходящих серотонинергических волокон на первые симпатические нейроны спинного мозга. Предполагается, что таким образом нейроны шва продолговатого мозга контролируют проведение болевых импульсов в антеролатеральной системе. Дефицит серотонина связан с возникновением депрессии.
Рис.
1.32. Локализация серотонинергических нейронов и их путей в головном мозге крыс (парасагиттальный срез).
1 - обонятельная луковица; 2 - пояс; 3 - мозолистое тело; 4 - кора головного мозга; 5 - медиальный продольный пучок; 6 - мозжечок; 7 - медиальный переднемозговой пучок; 8 - мозговая полоска; 9 - концевая полоска; 10 - свод; 11 - хвостатое ядро; 12 - наружная капсула. Серотонинергические нейроны сгруппированы в девяти ядрах, расположенных в стволе мозга. Ядра В6-В9 проецируются кпереди в промежуточный и конечный мозг, тогда как каудальные ядра проецируются в продолговатый и спинной мозг Гистаминергические нейроны
Гистаминергические нервные клетки располагаются в нижней части гипоталамуса близко к воронке. Гистамин метаболизируется ферментом гистидиновой декарбоксилазой из аминокислоты гистидина. Длинные и короткие пучки волокон гистаминергических нервных клеток в нижней части гипоталамуса идут к стволу мозга в составе задней и перивентрикулярной зоны. Гистаминергические волокна достигают околоводопроводного серого вещества, заднего ядра шва, медиального вестибулярного ядра, ядра одиночного пути, заднего ядра блуждающего нерва, ядра лицевого нерва, переднего и заднего кохлеарных ядер, латеральной петли и
нижнего бугорка четверохолмия. Кроме того, волокна направляются к промежуточному мозгу - задним, латеральным и передним отделам гипоталамуса, сосцевидным телам, зрительному бугру, перивентрикулярным ядрам, латеральным коленчатым телам и к конечному мозгу - диагональной извилине Брока, n. accumbens, миндалевидному телу и коре большого мозга.
Холинергические нейроны Альфа (α)- и гамма (γ)-мотонейроны глазодвигательного, блоковидного,
тройничного, отводящего, лицевого, языкоглогочного, блуждающего, добавочного и подъязычного нервов и спинномозговых нервов - холинергические (рис. 1.33).

Ацетилхолин влияет на сокращение скелетной мускулатуры. Преганглионарные нейроны вегетативной нервной системы холинергические, они стимулируют постганглионарные нейроны вегетативной нервной системы. Прочие холинергические нервные клетки получили буквенно-цифровое обозначение в направлении сверху вниз (в обратном порядке по сравнению с катехоламинергическими и серотонинергическими нейронами). Холинергические нейроны Ch1 формируют около 10% клеток срединных ядер перегородки, нейроны Ch2 составляют 70% клеток вертикального лимба диагональной борозды Брока, нейроны Ch3 составляют 1% клеток горизонтального лимба диагональной борозды Брока. Все три группы нейронов проецируются вниз на медиальные ядра поводка и межножковые ядра. Нейроны Ch1 соединяются восходящими волокнами через свод с гиппокампом. Группа клеток Ch3 синаптически связана с нервными клетками обонятельной луковицы.
В мозге человека группа клеток Ch4 относительно обширна и соответствует базальному ядру Мейнерта, в котором 90% всех клеток - холинергические. Эти ядра получают афферентные импульсы от субкортикальных диэнцефальнотелэнцефалических отделов и формируют лимбико-паралимбическую кору мозга. Передние клетки базального ядра проецируются на фронтальный и париетальный неокортекс, а задние клетки - на окципитальный и височный неокортекс. Таким образом, базальное ядро является передающим звеном между лимбикопаралимбическими отделами и неокортексом. Две небольшие группы холинергических клеток (Ch5 и Ch6) располагаются в мосту и рассматриваются как часть восходящей ретикулярной системы.
Небольшая группа клеток периоливарного ядра, частично состоящая из холинергических клеток, расположена у края трапециевидного тела в нижних отделах моста. Ее эфферентные волокна идут к рецепторным клеткам слуховой системы. Эта холинергическая система влияет на передачу звуковых сигналов. Аминацидергические нейроны Нейротрансмиттерные свойства доказаны для четырех аминокислот: возбуждающие
для глутаминовой (глутамат), аспарагиновой (аспартат) кислот, тормозные - для g- аминомаслянной кислоты и глицина. Предполагаются нейротрансмиттерные свойства цистеина (возбуждающие); таурина, серина и р-аланина (тормозные).
Рис.
1.33. Локализация холинергических нейронов и их путей в головном мозге у крыс (парасагиттальный срез). 1 - миндалевидное ядро; 2 - переднее обонятельное ядро; 3 - дугообразное ядро; 4 - базальное ядро Мейнерта; 5 - кора головного мозга; 6 - скорлупа хвостатого ядра; 7 - диагональный пучок Брока; 8 - отогнутый пучок (пучок Мейнерта); 9 - гиппокамп; 10 - межножковое ядро; 11 - латерально-дорсальное ядро покрышки; 12 - медиальное ядро поводка; 13 - обонятельная луковица; 14 - обонятельный бугор; 15 - ретикулярная формация; 16 - мозговая полоска; 17 - таламус; 18 - ретикулярная формация покрышки
Глутаматергические и аспартатергические нейроны Структурно сходные аминокислоты глутамат и аспартат (рис. 1.34) электрофизиологически классифицируются как возбуждающие нейротрансмиттеры. Нервные клетки, содержащие глутамат и/или аспартат в качестве нейротрансмиттеров, имеются в слуховой системе (нейроны первого порядка), в обонятельной системе (объединяют обонятельную луковицу с корой большого мозга), в лимбической системе, в неокортексе (пирамидные клетки). Глутамат обнаруживается также в нейронах проводящих путей, идущих от пирамидных клеток: кортикостриарном, кортикоталамическом, кортикотектальном, кортикомостовом и кортикоспинальном трактах.
Важную роль в функционировании глутаматной системы играют астроциты, не являющиеся пассивными элементами нервной системы, а участвующие в обеспечении нейронов энергетическими субстратами в ответ на увеличение синаптической активности. Астроцитарные отрост-
Рис.
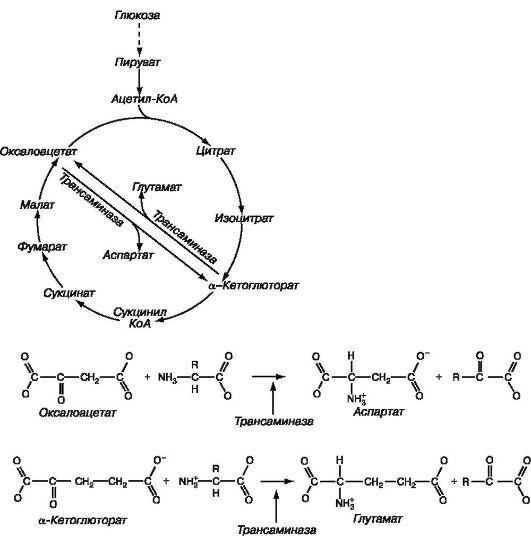
1.34. Синтез глутаминовой и аспарагиновой кислот.
Путем гликолиза происходит превращение глюкозы в пируват, который в присутствии ацетил-КоА вступает в цикл Кребса. Далее путем трансаминирования оксалоацетат и α-кетоглутарат превращаются в аспартат и глутамат соответственно (реакции представлены в нижней части рисунка)
ки расположены вокруг синаптических контактов, что позволяет им улавливать увеличение синаптической концентрации нейротрансмиттеров (рис. 1.35). Перенос глутамата из синаптической щели опосредуется специфическими транспортными системами, две из которых глиальноспецифичны (GLT- 1 и GLAST- переносчики).

Третья транспортная система (ЕААС-1), находящаяся исключительно в нейронах, не вовлекается в перенос высвободившегося из синапсов глутамата. Переход глутамата в астроциты происходит по электрохимическому градиенту ионов Na+.
В нормальных условиях поддерживается относительное постоянство внеклеточных концентраций глутамата и аспартата. Их повышение включает компенсаторные механизмы: захват нейронами и астроцитами избытков из межклеточного пространства, пресинаптическое торможение выброса нейротрансмиттеров, метаболическую утилизацию и
Рис.
1.35. Строение глутаматергического синапса.
Глутамат высвобождается из синаптических везикул в синаптическую щель. На рисунке изображены два механизма обратного захвата: 1 - обратно в пресинаптическое окончание; 2 - в соседнюю глиальную клетку; 3 - глиальная клетка; 4 - аксон; 5 - глутамин; 6 - глутамин-синтетаза; 7 - АТФ+NH4+; 8 - глутаминаза; 9 - глутамат + NH4+; 10 - глутамат; 11 - постсинаптическая мембрана. В глиальных клетках глутаминсинтаза превращает глутамат в глутамин, который далее переходит в пресинаптическое окончание. В пресинаптическом окончании глутамин превращается обратно в глутамат ферментом глутаминазой. Свободный глутамат также синтезируется в реакциях цикла Кребса в митохондриях. Свободный глутамат собирается в синаптических везикулах до возникновения следующего потенциала действия. В правой части рисунка представлены реакции превращения глутамата и глутамина, опосредованные глутаминсинтетазой и глутаминазой др. При нарушении их элиминации из синаптической щели абсолютная концентрация и время пребывания глутамата и аспартата в синаптической щели превышают допустимые пределы, и процесс деполяризации мембран нейронов становится необратимым.
В ЦНС млекопитающих существуют семейства ионотропных и метаботропных глутаматных рецепторов. Ионотропные рецепторы регулируют проницаемость ионных каналов и классифицируются в зависимости от чувствительности к действию N-метил-D-аспартата (NMDA), α-амино-3-гидрокси-5-метил-4-изоксазол- пропионовой кислоты (АМРА), каиновой кислоты (К) и L-2-амино-4- фосфономасляной кислоты (L-AP4) - наиболее селективных лигандов данного типа рецепторов. Названия этих соединений и были присвоены соответствующим типам рецепторов: NMDA, АМРА, КиL-AP4.
Наиболее изучены рецепторы NMDA-типа (рис. 1.36). Постсинаптический рецептор NMDA представляет собой сложное надмолекулярное образование, включающее несколько сайтов (участков) регуляции: сайт специфического
связывания медиатора (L-глутаминовой кислоты), сайт специфического связывания коагониста (глицина) и аллостерические модуляторные сайты, расположенные как на мембране (полиаминовый), так и в ионном канале, сопряженном с рецептором
(сайты связывания двухвалентных катионов и «фенциклидиновый» сайт - участок связывания неконкурентных антагонистов).
Ионотропные рецепторы играют ключевую роль в осуществлении возбуждающей нейропередачи в ЦНС, реализации нейропластичности, образовании новых синапсов (синаптогенез), в повышении эффективности функционирования уже имеющихся синапсов. С указанными процессами во многом связаны механизмы памяти, обучения (приобретение новых навыков), компенсации функций, нарушенных вследствие органического поражения мозга.
Возбуждающим аминоацидергическим нейротрансмиттерам (глутамату и аспартату) при определенных условиях свойственна цитотоксичность. При их взаимодействии с перевозбужденными постсинаптическими рецепторами развиваются дендросоматические поражения без изменений проводящей части нервной клетки. Условия, создающие такое перевозбуждение, характеризуются повышенным выделением и/или уменьшенным повторным захватом переносчика. Перевозбуждение глутаматом именно рецепторов NMDA приводит к открытию аго- нист-зависимых кальциевых каналов и мощному притоку Ca2+ в нейроны с внезапным увеличением его концентрации до пороговой. Вызываемая избыточным действием аминоацидергических нейротрансмиттеров «эксайтотоксическая смерть нейронов» является универсальным механизмом повреждения нервной ткани. Она лежит в основе некротической смерти нейронов при различных заболеваниях головного мозга, как острых (ишемический инсульт), так и хронических (ней-
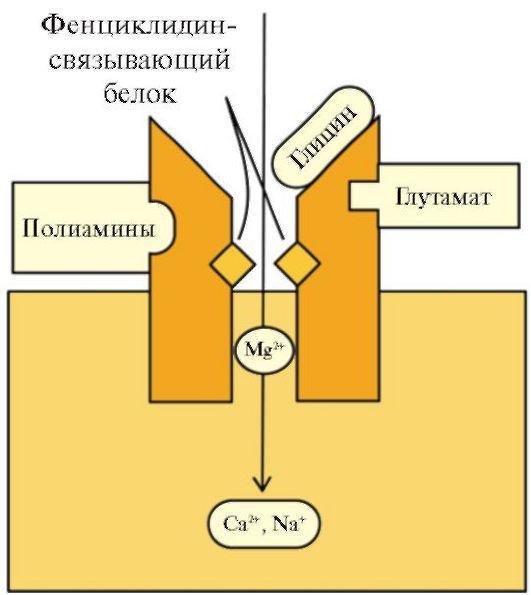
Рис.
1.36. Глутаматный NMDA-ре- цептор
родегенерации). На экстрацеллюлярные уровни аспартата и глутамата, а следовательно, и на выраженность эксайтотоксичности влияют температура и рН головного мозга, внеклеточные концентрации одновалентных ионов С1- и Na+. Метаболический ацидоз угнетает транспортные системы глутамата из синаптической щели.
Имеются данные о нейротоксических свойствах глутамата, связанных с активацией АМРА- и К-рецепторов, приводящей к изменению проницаемости постсинаптической мембраны для одновалентных катионов К+ и Na+, усилению входящего тока ионов Na+ и кратковременной деполяризации постсинаптической мембраны, что, в свою очередь, вызывает усиление притока Са2+ в клетку через агонист-зависимые (рецепторы NMDA) и потенциалзависимые каналы. Поток ионов Na+ сопровождается входом в клетки воды, что обусловливает набухание апикальных дендритов и лизис нейронов (осмолитическое повреждение нейронов). Метаботропные глутаматные рецепторы, связанные с G-белком, играют важную роль в регуляции внутриклеточного кальциевого тока, вызванного активацией NMDA-рецепторов, и выполняют модуляторные функции, вызывая тем самым изменения в деятельности клетки. Эти рецепторы не влияют на функционирование ионных каналов, но стимулируют образование внутриклеточных посредников
