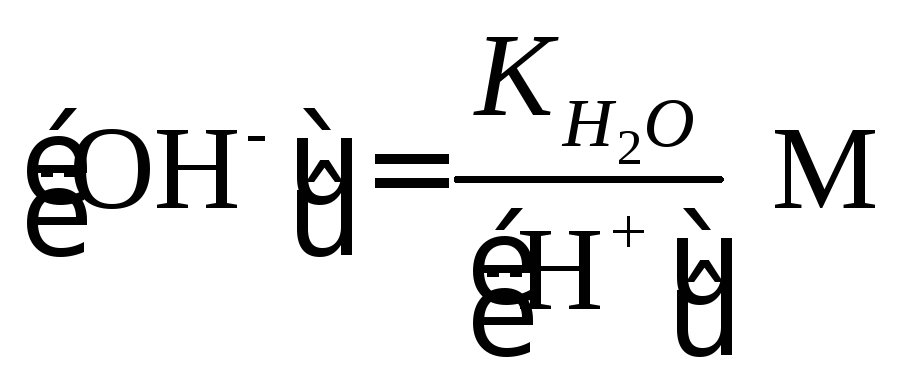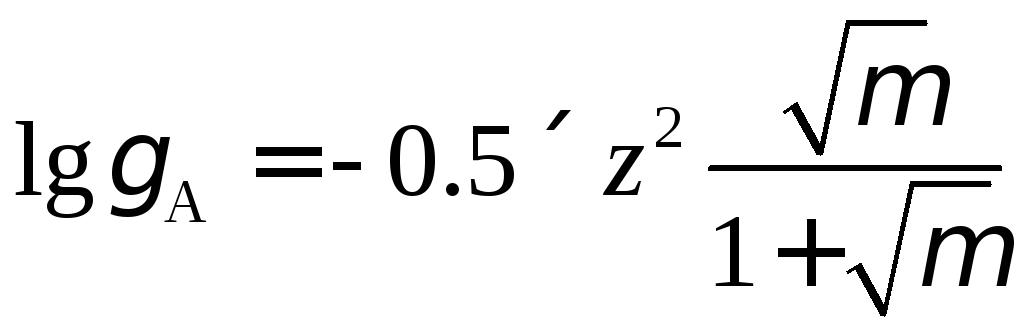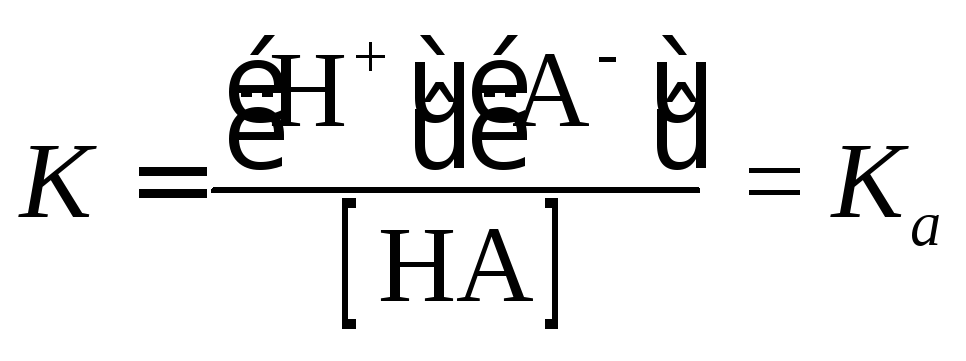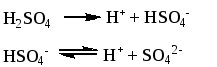- •1. Равновесия в гомогенных системах
- •1.1. Равновесия в водных растворах кислот и оснований
- •З а д а ч и
- •1.2. Гидролиз солей
- •З а д а ч и
- •1.3. Равновесия в растворах кислых солей
- •З а д а ч и
- •1.4. Влияние одноименного иона на степень диссоциации слабых кислот и оснований
- •З а д а ч и
- •Вычислить степень диссоциации и концентрацию ионов слабых кислот и оснований
- •1.5. Буферные растворы
- •З а д а ч и
- •1.6. Равновесия в растворах комплексных соединений
- •З а д а ч и
1. Равновесия в гомогенных системах
1.1. Равновесия в водных растворах кислот и оснований
Согласно протолитической теории к кислотам относятся химические соединения, способные в растворах отдавать протоны, а к основаниям - вещества, способные присоединять протоны. Для того чтобы кислота могла отдать протон, необходимо присутствие основания, принимающего этот протон. Отдавая протон, кислота образует сопряженное с ней основание, а основание, принимая протон, образует сопряженную с ним кислоту.
В водных растворах кислот имеет место следующее равновесие:
|
|
(1.1) |
В воде, которая является кислотой и основанием одновременно, устанавливается равновесие
|
|
(1.2) |
в сокращенном виде
|
|
(1.3) |
Константа равновесия этой реакции при температуре 25° С равна
|
|
(1.4) |
В водных растворах масса воды в большинстве случаев очень велика по сравнению с массой растворенного вещества, количество ее в 1 л раствора можно считать постоянным. Тогда выражение для константы равновесия запишется следующим образом:
К [Н2О] = [Н+] [ОН-] (1.5)
Из уравнения (1.5) следует, что ионное произведение является величиной постоянной при постоянной температуре. Эту константу называют ионным произведением воды, которое при температуре 25° С равно
|
|
(1.6) |
В чистой воде [H+] = [OH-] = 1×10-7 M . При избытке [OH-]
|
|
(1.7) |
При избытке [Н+]
|
|
(1.8) |
Концентрацию водородных ионов обычно используют для характеристики среды. В большинстве расчетов, относящихся к кислотно-основному равновесию, концентрации (и другие величины) удобно выражать в виде отрицательных логарифмов этих величин, обозначаемых знаком "р". Тогда
|
-lg[H+] = pH |
(1.9) |
|
-lg[OH-] = pOH |
(1.10) |
Ионное произведение воды тоже можно выразить в логарифмическом виде
|
рН
+ рОН =
|
(1.11) |
Пример 1. Вычислить рН раствора, концентрация водородных ионов в котором равна 0.02 М.
Решение.
рН = - lg[Н+] = -lg(2×10-2) = 1.70
Решая обратную задачу, по известному значению рН легко найти концентрации водородных и гидроксид-ионов.
Пример 2. Вычислить [Н+] и [ОН-] раствора, рН которого равен 10.33.
Решение.
[Н+] = 1×10-10.33 = 4.7×10-11 М.
рОН = 14 - 10.33 = 3.67.
[ОН-] = 1×10-3.67 = 2.1×10-4 М.
Сильные кислоты (НХ) и сильные основания (МОН) в водных растворах практически полностью диссоциированы.
|
HX = H+ + X- |
(1.12) |
|
MOH = M+ + OH- |
(1.13) |
Концентрации Н+ и ОН- в этих растворах в первом приближении можно считать равными общей концентрации СА кислоты (НХ) и соответственно основания (МОН). Следовательно,
|
pH = -lgCHX |
(1.14) |
|
pOH = -lgCMOH |
(1.15) |
Эти выражения являются приближенными. В более строгих расчетах концентрацию электролитов следует заменять активностью ионов. Между концентрацией иона и активностью его существует следующая зависимость:
|
aA = γA×CA |
(1.16) |
где γA - коэффициент активности. Коэффициент активности зависит от ионной силы раствора (μ)
|
|
(1.17) |
где
![]() -
концентрации ионов - катионов и анионов
(М),
-
концентрации ионов - катионов и анионов
(М),
![]() -
заряды ионов.
-
заряды ионов.
Если
![]() ,
коэффициент активности в водных
растворах рассчитывается по формуле
,
коэффициент активности в водных
растворах рассчитывается по формуле
|
|
(1.18) |
При
![]() расчет
проводится по более сложному уравнению
расчет
проводится по более сложному уравнению
|
|
(1.19) |
Для сильных электролитов только в очень разбавленных растворах (~ 0.0001 М) γA = 1 и аА = СА. Коэффициент активности можно не учитывать также для недиссоциированных молекул.
Для простоты расчетов в дальнейшем во всех случаях, кроме оговоренных, вместо активностей используются концентрации.
Пример 3. Вычислить рН 0.0018%-ного раствора хлороводородной кислоты.
Решение. Найдем концентрацию НС1, выраженную в М, учитывая, что молекулярная масса НС1 36.46:
![]()
рН = - lg(4.94×10-4) = 3.31.
Пример 4. В 250 мл раствора содержится 0.1 г гидроксида натрия. Вычислить рН раствора.
Решение. Найдем концентрацию NaOH, выраженную в моль/л. Молекулярная масса NaOH 40.
![]()
Ионная сила 0.01 М раствора гидроксида натрия равна:

pOH = -lg(8.9×10-3) = 2.05
pH = 14-2.05 = 11.95
Пример 5. К 3 л воды прибавлен 1 г HNO3 (ρ = l.4). Вычислить рН раствора.
Решение. По таблицам находим, что в 100 г азотной кислоты (ρ = 1.4) содержится 65.3 г HNO3. Тогда концентрация HNO3 в М будет равна
![]()
pH = -lg(3.4×10-3) = 2.47
В случае слабых кислот константа равновесия реакции {1.2) может быть выражена следующим уравнением:
|
|
(1.20) |
где Ка - константа диссоциации кислоты НА.
Если общую концентрацию кислоты обозначить СНА, а равновесную [НА], то
|
[НА] = СНА - [Н+]. |
(1.21) |
Из уравнения (1.2) следует, что [Н+] = [А-]. Тогда выражение константы диссоциации слабой кислоты можно записать следующим образом:
|
|
(1.22) |
Отсюда легко найти концентрацию [Н+]
|
|
(1.23) |
Если
кислота диссоциирована в незначительной
степени (![]() ),
то приближенно можно считать, что.
),
то приближенно можно считать, что.
|
|
(1.24) |
|
|
(1.25) |
Слабое основание, как и слабая кислота, в водных растворах диссоциирует неполностью
|
|
(1.26) |
как и для слабой кислоты,
|
[BOH] = СBOH - [OН-]. |
(1.27) |
Поскольку [В+] = [ОН-], уравнение для константы диссоциации слабого основания будет иметь вид
|
|
(1.28) |
и
|
|
(1.29) |
Когда [OH-] << Свон (102 [ОН-] < Свон), можно принять
|
|
(1.30) |
|
|
(1.31) |
|
|
(1.32) |
Пример 6. Вычислить рН 0.017 М раствора муравьиной кислоты.
Решение.
|
|
|
CHCOOH = 0. = 1.7×10-2 М

рН = -lg(1.7×10-3 ) = 2.76.
Пример 7. Вычислить рН 0.06 М раствора аммиака.
Решение.
|
|
|
![]() =
0.06
= 6×10-2
М
=
0.06
= 6×10-2
М

рOН = -lg(1.04×10-3 ) = 2.98; pH = 14 - pOH = 11.02.
Диссоциация слабых электролитов количественно характеризуется также степенью электролитической диссоциации (α). Степень диссоциации представляет собой отношение концентрации вещества, распавшегося на ионы, к общей его концентрации в растворе. Между константой диссоциации электролита КА и α существует следующая зависимость:
|
|
(1.33) |
где С
- молярная концентрация слабого~электролита.
Если α мала (α < 5%), применимо приближенное
уравнение ![]() ,
откуда
,
откуда
|
|
(1.33) |
Пример 8. Вычислить степень диссоциации муравьиной кислоты в 1.5%-ном растворе.
Решение. Находим молярную концентрацию НСООН (М. м. = 46)
![]()
Формиат-ион и ион водорода образуются только в результате диссоциации муравьиной кислоты, следовательно, их концентрации равны
[H+] = [HCOО-] = х M,
[НСООН] = (3.26×10-1- х) М, отсюда
![]()
Если концентрация диссоциированной части мала по сравнению с общей концентрацией кислоты, то в знаменателе ею, как алгебраическим слагаемым, можно пренебречь. Тогда
![]()
![]()
Пример 9. При какой концентрации бензойная кислота диссоциирована на 10%?
Решение.
Если неизвестную общую концентрацию
обозначить
![]() ,
то концентрация каждого из ионов будет
равна
,
то концентрация каждого из ионов будет
равна
[Н+]
= [С6Н5СОО-]
=
![]() ,
,
а концентрация недиссоциированной части будет составлять
[С6Н5СООН] =С(1 - 1×10-1) = 9×10-1 С М ,
отсюда
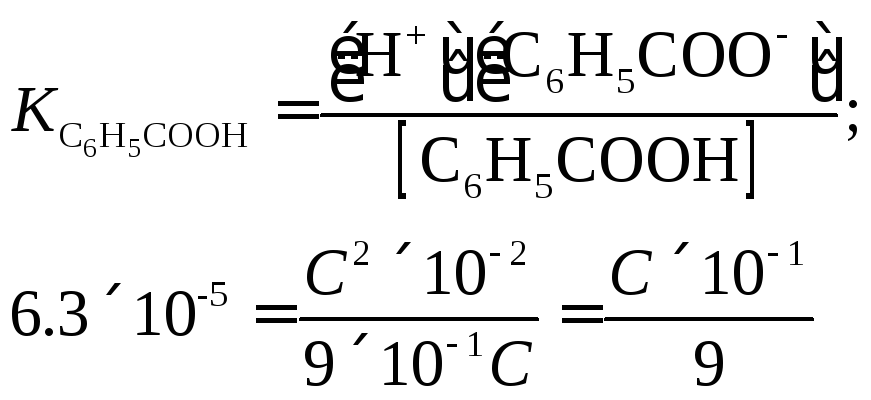
или
![]()
Пример 10. Уксусная кислота в 3%-ном растворе диссоциирована на 0.59 %. Вычислить приближенное значение константы диссоциации.
Решение. Находим молярную концентрацию СН3СООН (М. м. = 60.05).
![]()
|
|
|
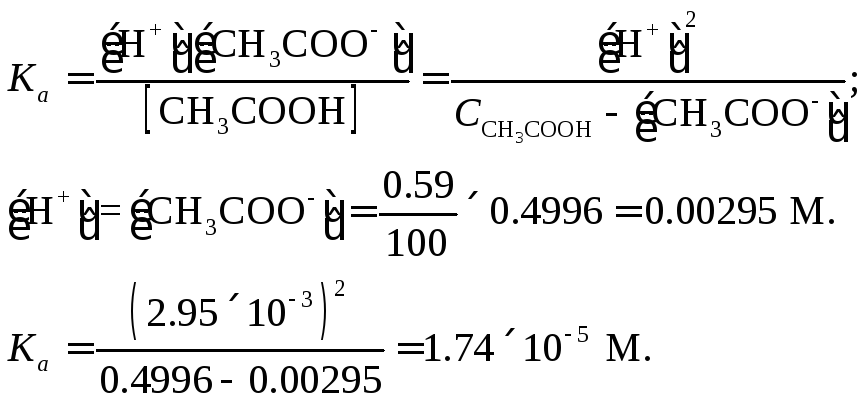
Пример 11. 0.5 М раствор гидразина имеет рН = 10.83. Вычислить константу диссоциации гидразина.
Решение.
рОН = 14-10.83 = 3.17; [ОН-] = 1×10-3.17 = 6.76×10-4 М,
|
|
|

Многоосновные кислоты (H2SO4, H2SO3, H2CO3, Н2С2О4, Н3РО4 и др.) в водных растворах диссоциируют ступенчато
|
|
(1.35) |
|
|
(1.36) |
|
|
(1.37) |
|
|
(1.38) |
Константы
диссоциации по первой ступени всегда
больше, чем по второй ступени:
![]() .
Если
.
Если
![]() во
много раз больше
во
много раз больше![]() (
(![]() )
то
концентрация ионов водорода определяется
главным образом диссоциацией кислоты
по первой ступени.
)
то
концентрация ионов водорода определяется
главным образом диссоциацией кислоты
по первой ступени.
Обозначим через х концентрацию диссоциированной части кислоты. Тогда, при начальной концентрации кислоты С равновесные концентрации будут равны
[Н2А] = С- х М;
[Н+] = х М;
[HA-] = х М.
Подставив эти значения в уравнение (1.36), получим:
|
|
(1.39) |
отсюда
|
|
(1.40) |
Если
![]() мала,
то приближенно можно считать, что
мала,
то приближенно можно считать, что
|
|
(1.41) |
Поскольку [Н+]~[НА-], то из уравнения (1.38) находим
|
|
(1.42) |
Пример 12. Вычислить концентрацию ионов водорода и анионов в 0.1 М растворе селенистой кислоты (К1 =l.8×10-3, К2 = 3.2×10-9).
Решение. Вычисляем концентрацию Н+и НSeО3- по уравнению (1 40)

Концентрация
SeO32-
равна ![]() (3.2×10-9
M).
(3.2×10-9
M).
Особо следует рассмотреть равновесия в растворе серной кислоты. По первой ступени H2SO4 диссоциирует полностью. По второй ступени константа диссоциации равна 1.15×10-2.
|
|
(1.43) |
Пример 13. Найти концентрации H+, HSO4- и SO42- в 0.1 М растворе H2SO4.
Решение. Диссоциация H2SO4 может быть представлена следующими уравнениями:
|
|
|
Обозначим концентрацию SO42- через х. Общая концентрация Н+ может быть выражена как сумма начальной концентрации H2SO4 (в соответствии с диссоциацией по первой ступени) и концентрации SO42-, образующихся по второй ступени
[Н+] = 0.1 + х
Очевидно, что концентрация HSO4- будет равна разности между начальной концентрацией H2SO4 и концентрацией SO42-
[HSO4-] = 0.l - х
Подставляя эти данные в уравнение (1.43), получим

Следовательно,
[SO42-] = 8.8×10-3 M
[Н+] = 0.109 М,
[HSO4-] = 0.091 М.