
- •Техническая термодинамика
- •Внутренняя энергия и энтальпия тела как функции состояния
- •Дросселирование. Эффект Джоуля-Томпсона.
- •Реальный газ и уравнения состояния реального газа. Опыты Эндрюса. Критическая точка. Уравнение Ван-дер-Ваальса.
- •Пары. Испарение. Кипение.
- •Условие устойчивости и равновесие в изолированной однородной системе
- •Термические и калорические свойства жидкостей
- •Регенеративный цикл
Пары. Испарение. Кипение.
Газообразные тела с примесью одноимённой жидкости в виде взвешенных мелкодисперсных частиц или без них принято называть парами.
Испарением называется парообразование, происходящее только с поверхности жидкости.
Кипение – это процесс парообразования, происходящий во всей массе жидкости.
При кипении образуются пузырьки пара как на поверхности, так и внутри жидкости. Они поднимаются вверх, объединяясь с другими пузырьками и по достижении поверхности схлопываются.
Н асыщенный
пар – такой пар, который образуется в
присутствии жидкости и находится с ней
в равновесном состоянии. Его давление
зависит от температуры.
асыщенный
пар – такой пар, который образуется в
присутствии жидкости и находится с ней
в равновесном состоянии. Его давление
зависит от температуры.
Сухим насыщенным паром называется такой пар, который не содержит капелек жидкости.
Влажным насыщенным паром называется смесь сухого пара и кипящей жидкости.
Перегретый пар – пар, имеющий более высокую температуру, чем насыщенный пар при том же давлении.
Для воды
![]() .
.
Т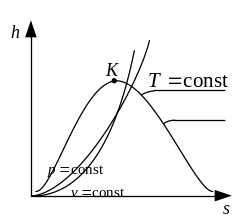 еплота
парообразования
еплота
парообразования
![]() ,
где
,
где
![]() – энтальпия сухого насыщенного пара,
– энтальпия сухого насыщенного пара,
![]() – энтальпия кипящей жидкости.
– энтальпия кипящей жидкости.
Степень влажности
![]() (где v, h
и s – удельный объём,
энтальпия и энтропия смеси).
(где v, h
и s – удельный объём,
энтальпия и энтропия смеси).
Равновесие термодинамических систем и фазовые переходы
Гомогенные и гетерогенные термодинамические системы
Гомогенной называется такая система, физические свойства и химический состав которой постоянны или изменяется непрерывно.
Гетерогенной называется система, состоящая из двух или более гомогенных областей. Эти области называются фазами.
Состояние равновесия – такое состояние, к которому при данных внешних условиях стремиться термодинамическая система.
Состояние устойчивого равновесия (стабильное состояние) характерно тем, что если каким-либо внешним воздействием вывести из него систему, а затем снять воздействие, то система снова вернётся в состояние равновесия.
Если систему, находящуюся в состоянии неустойчивого равновесия (лабильном состоянии), из него вывести, то она в это состояние уже не вернётся.
Относительно устойчивое (метастабильное) состояние – состояние, в котором система может находиться длительное время и небольшие воздействия не выводят её из этого состояния.
В равновесном состоянии энтропия принимает минимальное значение.
Равновесные состояния:
 ,
т.е. при приближении к состоянию
равновесия внутренняя энергия убывает,
достигая минимума в состоянии равновесия.
,
т.е. при приближении к состоянию
равновесия внутренняя энергия убывает,
достигая минимума в состоянии равновесия. .
. ,
F
– изохорно-изотермический потенциал
(или свободная энергия).
,
F
– изохорно-изотермический потенциал
(или свободная энергия). ,
– изобарно-изотермический
потенциал.
,
– изобарно-изотермический
потенциал.
![]() .
Удельный изобарно-изотермический
потенциал называется химическим
потенциалом.
.
Удельный изобарно-изотермический
потенциал называется химическим
потенциалом.
Условие устойчивости и равновесие в изолированной однородной системе
Для любого газа выполняются неравенства
![]() и
и
![]() .
Первое неравенство называется условием
термической устойчивости, второе –
механической устойчивостью.
.
Первое неравенство называется условием
термической устойчивости, второе –
механической устойчивостью.
Принцип Ле Шателье-Брауна: Если система, находящаяся в равновесии, выводится из него, то все её параметры изменяются таким образом, чтобы система вернулась в состояние равновесия.
Пусть система состоит из двух систем с
заданными параметрами. Тогда
![]() ,
следовательно,
,
следовательно,
![]() .
Т.к.
.
Т.к.
![]() ,
то
,
то
![]()
![]() .
Пусть
.
Пусть
![]()
![]() ,
где f – некоторая
функция. Тогда
,
где f – некоторая
функция. Тогда
![]() .
Т.к.
.
Т.к.
![]() ( – химический
потенциал), то
( – химический
потенциал), то
![]() и, т.к.
и, т.к.
![]() ,
то
,
то
![]() ,
следовательно, равновесия происходит,
когда
,
следовательно, равновесия происходит,
когда
![]()
![]() .
.
Фазовые переходы
Фазовым переходом называется переход из оной фазы в другую, сосуществующую с ней.
Фазовый переход из твёрдого состояния в жидкость называется плавлением, твердое состояние пар – сублимацией, жидкость твёрдое состояние – затвердеванием, жидкость пар – кипением, пар твёрдое тело – возгонкой, пар жидкость – конденсацией.
Правило Гиббса:
![]() ,
где
– число степеней свободы системы, n
– число компонентов, r
– число фаз.
,
где
– число степеней свободы системы, n
– число компонентов, r
– число фаз.
Т очка
O называется тройной.
очка
O называется тройной.
Уравнение Клапейрона-Клаузиуса
Пусть есть две вазы 1 и 2, находящиеся в
равновесии при давлении p
и температуре T:
![]() ,
где
,
где
![]() – химический потенциал.
– химический потенциал.
![]() ,
т.к.
,
т.к.
![]() и
и
![]() – бесконечно малые изменения. Тогда,
т.к.
– бесконечно малые изменения. Тогда,
т.к.
![]()
![]() (последнее – из уравнений Максвелла),
то
(последнее – из уравнений Максвелла),
то
![]()
![]() или
или
![]() – уравнение кривой фазового перехода
(уравнение Клапейрона-Клаузиуса). Оно
однозначно связывает наклон линии
фазового перехода в p-T
диаграмме с разностью удельных энтропий
и объёмов этих фаз.
– уравнение кривой фазового перехода
(уравнение Клапейрона-Клаузиуса). Оно
однозначно связывает наклон линии
фазового перехода в p-T
диаграмме с разностью удельных энтропий
и объёмов этих фаз.
Из второго и первого законов термодинамики
следует, что
![]() или
или
![]() при постоянном давлении. Тогда
при постоянном давлении. Тогда
![]() ,
где r – удельная
теплота перехода из одной фазы в другую.
При переходе из жидкости в пар
,
где r – удельная
теплота перехода из одной фазы в другую.
При переходе из жидкости в пар
![]() .
Обычно
.
Обычно
![]() ,
следовательно,
,
следовательно,
![]() .
Если давление мало, то выполняется
неравенство
и можно пользоваться уравнением состояния
идеального газа:
.
Если давление мало, то выполняется
неравенство
и можно пользоваться уравнением состояния
идеального газа:
![]() .
При низких давлениях r
не зависит от температуры, следовательно,
.
При низких давлениях r
не зависит от температуры, следовательно,
![]() ,
где C – некоторая
постоянная. Обычно это рассматривается
при нормальных условиях и тогда
,
где C – некоторая
постоянная. Обычно это рассматривается
при нормальных условиях и тогда
![]() и
и
![]() .
.
Устойчивость фаз
Т .к.
.к.
![]() ,
то
,
то
![]() .
Пусть 1 – жидкость, а 2 – насыщенный пар
( – химический
потенциал). Тогда изобарно-изотермический
потенциал системы
.
Пусть 1 – жидкость, а 2 – насыщенный пар
( – химический
потенциал). Тогда изобарно-изотермический
потенциал системы
![]() .
В состоянии равновесия
.
В состоянии равновесия
![]() .
Кроме того,
.
Кроме того,
![]() .
В процессе установления равновесия в
изобарно-изотермической системе
.
В процессе установления равновесия в
изобарно-изотермической системе
![]() всегда, следовательно, если
всегда, следовательно, если
![]() ,
то происходит конденсация, иначе –
испарение.
,
то происходит конденсация, иначе –
испарение.
Термодинамические свойства веществ
Термические и калорические свойства твёрдых тел
Для большинства твёрдых тел коэффициент
изотермической сжимаемости
![]() .
Удельный объём твёрдых тел существенно
изменяется только в случае сжатия
большими давлениями.
.
Удельный объём твёрдых тел существенно
изменяется только в случае сжатия
большими давлениями.
Температурный коэффициент объёмного
расширения:
![]() ,
кроме областей вблизи фазового
превращения. Для анизотропных тел
вводится коэффициент линейного расширения
,
кроме областей вблизи фазового
превращения. Для анизотропных тел
вводится коэффициент линейного расширения
![]() ,
где l – ось анизотропности.
,
где l – ось анизотропности.
При средних и высоких температурах
![]() – уравнение Дюлонга и Пти (здесь A
– атомарная масса). Формула Дебая:
– уравнение Дюлонга и Пти (здесь A
– атомарная масса). Формула Дебая:
![]() ,
где T – текущая
температура,
– дебаевская температура, которая
является характеристикой вещества.
Т.к. v практически не
зависит от p, то
,
где T – текущая
температура,
– дебаевская температура, которая
является характеристикой вещества.
Т.к. v практически не
зависит от p, то
![]() .
.
Вещество в твёрдой фазе может существовать в различных аллотропических модификациях. При этом каждая модификации существует лишь в некоторых областях параметров состояния и переход из одной модификации в другую эквивалентен переходу из одной фазы в другую.
