
- •16. Средняя степень полимеризации крахмала составляет 1800. Средняя относительная молекулярная масса крахмала равна: 241
- •1. Химическая термодинамика. 304
- •2. Строение атома, химическая связь. 304
- •Введение.
- •Тема: Вводное занятие.
- •Техника выполнения лабораторных работ и техника безопасности
- •Первая помощь при ожогах и отравлениях. *
- •Фундаментальные единицы измерения.
- •Лабораторная посуда
- •1. Обозначьте на рисунках:
- •Что из перечисленного выше относится к мерной посуде?
- •Методические указания к занятию № 2.
- •Химический эквивалент.
- •Молярная масса эквивалентов вещества
- •Химическое количество эквивалентов вещества
- •Молярная концентрация эквивалентов вещества
- •Закон эквивалентов
- •1. Примеры расчета молярной концентрации эквивалента (нормальной концентрации).
- •2. Контролирующие задания
- •3. Выполнение индивидуальных заданий.
- •Методические указания к занятию № 3
- •Титриметрический анализ. Общая характеристика метода
- •Требования, предъявляемые к реакциям, которые используют в титриметрии
- •Способы титрования
- •Способы приготовления рабочих растворов
- •Правила работы с мерной посудой при проведении аналитических измерений
- •Мерные колбы
- •Пипетки
- •Бюретки
- •Проведение титрования
- •Методические указания к занятию № 4
- •Кислотно-основное титрование. Общая характеристика метода
- •Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
- •Титрование сильной кислоты сильным основанием:
- •Титрование слабой кислоты сильным основанием:
- •Титрование слабого основания сильной кислотой:
- •Подбор индикаторов при кислотно-основном титровании
- •Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
- •Применение кислотно-основного титрования
- •Расчет: вычисляют средний объем (V) кислоты, пошедшей на титрование с точностью до сотых мл
- •Методические указания к занятию № 5
- •Редоксиметрия. Общая характеристика и классификация методов
- •Кривые титрования в редоксиметрии
- •Способы определения точки эквивалентности
- •Перманганатометрия
- •Иодометрия
- •Расчет: вычисляют средний объем (V) kMnO4,, пошедший на титрование с точностью до сотых
- •Тесты к теме: Закон эквивалентов. Титриметрия.
- •Учение о растворах. Методические указания к занятию № 6
- •1. Задачи для самостоятельного решения
- •Методические указания к занятию № 7.
- •1. Задачи для самостоятельного решения
- •Тесты к теме: Растворы. Электролитическая диссоциация. Буферные растворы.
- •Методические указания к занятию № 8.
- •Лабораторная работа № 2: Прочность и разрушение комплексных ионов.
- •Тесты к теме: Комплексные соединения.
- •Химическая кинетика и катализ. Методические указания к занятию № 9.
- •1. Задачи для самостоятельного решения
- •Тесты к теме: Скорость химических реакций.
- •Методические указания к занятию № 10.
- •Тесты к теме: Катализ.
- •Электрохимия. Методические указания к занятию № 11.
- •Методические указания к занятию № 12.
- •Тесты к теме: Электрохимия. Электропроводимость растворов.
- •Поверхностные явления. Методические указания к занятию № 13.
- •Методические указания к занятию № 14.
- •Тесты к теме: Поверхностные явления. Адсорбция.
- •Физическая химия дисперсных систем. Методические указания к занятию № 15.
- •Методические указания к занятию № 16.
- •Тесты к теме: Дисперсные системы. Коллоидные растворы.
- •Методические указания к занятию № 17.
- •Тесты к теме: Растворы биополимеров.
- •Химия биогенных элементов. Методические указания к занятию № 18.
- •Общая характеристика биогенных элементов
- •Общая характеристика групп элементов Общая характеристика неметаллов
- •Общая характеристика элементов viiа группы Нахождение в природе
- •Строение атомов галогенов, их физические и химические свойства
- •Биологическая роль элементов viiа группы
- •Общая характеристика элементов viа группы Нахождение в природе
- •Строение атомов, химические и физические свойства халькогенов
- •Биологическая роль элементов viа группы
- •Общая характеристика элементов va группы Нахождение в природе
- •Строение атомов, физические и химические свойства пниктогенов
- •Биологическая роль элементов vа группы
- •Общая харатеристика элементов ivа группы Нахождение в природе
- •Физические и химические свойства элементов iva группы
- •Биологическая роль элементов ivа группы
- •Общая характеристика металлов
- •Общая характеристика элементов iiia группы Нахождение в природе
- •Строение атомов, физические и химические свойства элементов iiia группы
- •Биологическая роль элементов iiia группы
- •Общая характеристика элементов iiа группы Нахождение в природе
- •Общая характеристика элементов iiа группы на основании строения их атомов и положения в таблице д.И. Менделеева
- •Биологическая роль элементов iiа группы
- •Общая харатеристика элементов iа группы Нахождение в природе
- •Общая характеристика щелочных металлов на основании строения их атомов и положения в таблице д.И. Менделеева
- •Физические свойства простых веществ
- •Биологическая роль элементов iа группы
- •Общая харатеристика d-элементов
- •Качественные реакции на важнейшие биогенные элементы
- •1. Химическая термодинамика.
- •2. Строение атома, химическая связь.
- •Химическая термодинамика.
- •Вопросы для подготовки к экзамену по общей химии для лечебного и педиатрического факультетов.
- •Вопросы для подготовки к экзамену по общей химии для медико-психологического факультета.
Общая характеристика элементов viа группы Нахождение в природе
В VIА группу входят следующие элементы: кислород O, сера S, селен Se, теллур Te и полоний Po, (последний является радиоактивным, период полураспада наиболее стабильного изотопа равен ≈ 140 суток). Все эти элементы (за исключением полония) носят общее название «халькогены», что означает «образующие руды». Халькогены относятся к семейству р-элементов.
Кислород и сера широко распространены в природе и встречаются как в свободном состоянии, так и в связанном виде. Селен и теллур представлены гораздо реже (их массовая доля в земной коре составляет, соответственно, 6 ∙ 10-5% и 1 ∙ 10-6%) и существуют, главным образом, в связанном виде.
Каждый халькоген состоит из нескольких нерадиоактивных нуклидов, причем их число у элементов в группе возрастает сверху вниз. Так, для кислорода известны 3 стабильных нуклида, а для теллура – 8.
Строение атомов, химические и физические свойства халькогенов
Электронно-графическая формула внешнего энергетического уровня для атомов элементов VI A группы выглядит следующим образом.
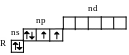
Атомы кислорода отличаются от атомов всех остальных элементов VIА группы тем, что у них на внешнем слое отсутствует d-подуровень.
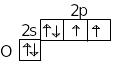
В невозбужденном состоянии атомы халькогенов имеют на внешнем слое по два неспаренных электрона, поэтому они могут образовать две ковалентные связи по обменному механизму. Их валентность в этом случае равна 2.
При возбуждении число неспаренных электронов увеличивается до 4 или 6 за счет распаривания электронных пар.
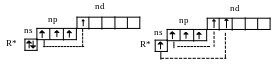
Соответственно, и возможные значения валентности также будут равны при этом 4 или 6.
Кислород, в отличие от всех остальных халькогенов, в соединениях обычно проявляет только валентность 2, так как у его атомов на внешнем слое нет вакантных d-орбиталей и электронные пары не могут распариться. Однако в некоторых соединениях (Н3О+) валентность кислорода может быть равна 3. Дополнительная третья связь образуется не по обменному, а по донорно-акцепторному механизму, причем атомы О выступают в роли донора электронной пары.
Все элементы VIА группы (кроме полония) – типичные неметаллы, хотя и менее активные, чем галогены. Поэтому в своих соединениях они могут проявлять как положительную, так и отрицательную степень окисления.
Положительную степень окисления халькогены проявляют при взаимодействии с более электроотрицательными элементами, чем сами. В этом случае они выступают в роли восстановителей и отдают другим атомам с внешнего слоя свои неспаренные электроны. Величина степени окисления при этом может быть равна +2 (в невозбужденном состоянии), +4 или +6 (в возбужденном состоянии).
Степень окисления +2 для халькогенов мало характерна. Такие их соединения обычно неустойчивы, и в момент образования легко превращаются в соединения, где степень окисления данных элементов равна +4. Однако с увеличением атомного номера элемента в группе устойчивость этих соединений несколько возрастает.
Кислород, как второй по электроотрицательности элемент, только в соединениях со фтором (F2O+2, F2О2+1) проявляет положительную степень окисления +2 или +1.
Отрицательную степень окисления атомы элементов VIА группы проявляют при взаимодействии с атомами менее электроотрицательных элементов, чем сами. В этом случае они выступают в роли окислителей и забирают от других атомов 2 недостающих до завершения своего внешнего слоя электрона. Величина их степени окисления при этом равна -2.
С водородом халькогены образуют соединения вида H2R. При обычных условиях это газообразные вещества. Исключение составляет Н2О, которая за счет межмолекулярных водородных связей находится в жидком агрегатном состоянии.
Термическая устойчивость водородных соединений в группе уменьшается сверху вниз.
При растворении в Н2О халькогеноводороды проявляют слабые кислотные свойства, отщепляя ионы Н+. Причем диссоциация протекает преимущественно по первой стадии:
H2R H+ + HR−
В группе сверху вниз сила этих кислот возрастает, что объясняется уменьшением прочности связи R-H из-за увеличения радиусов атомов халькогенов (табл. 14).
Так, Н2S является одной из самых слабых минеральных кислот (K1 дисс. = 6 ∙ 10-8), а для Н2Те величина K1 дисс. = 2 ∙ 10-3.
С кислородом халькогены могут образовать 3 вида оксидов: RO, RO2, RO3.
Оксид RO является для большинства халькогенов неустойчивым оксидом и в момент образования превращается в RO2. Так, выделенный SO уже при обычных условиях быстро распадается:
2SO → SO2 + S.
Оксиды RO2 и RO3 являются кислотными оксидами, которым соответствуют кислоты общего вида H2RO3 и H2RO4. Сила этих кислот в подгруппе сверху вниз закономерно уменьшается, что объясняется увеличением в аналогичном направлении металлических свойств у элементов и, как следствие этого, возрастанием основности их кислородсодержащих соединений. Причем для каждого элемента кислота H2RO4 является более сильной, чем кислота H2RO3, так как в первом случае халькогены имеют большую степень окисления (+ 6), чем во втором (+ 4).
Таблица 14. Некоторые физические свойства атомов элементов VI А группы и образуемых ими наиболее устойчивых аллотропных модификаций
Символ элемента |
O |
S |
Se |
Te |
Радиус атома, нм |
0,066 |
0,104 |
0,117 |
0,137 |
Энергия ионизации атома, кДж/моль |
1300 |
1000 |
940 |
870 |
Энергия сродства к электрону, кДж/моль |
140 |
200 |
195 |
190 |
Относительная электроотрицательность |
3,5 |
2,6 |
2,5 |
2,1 |
Плотность простого вещества, г/см3 |
0,0014 |
2,06 |
4,82 |
6,25 |
Агрегатное состояние простого вещества при н.у. |
газ |
тв. тело |
тв. тело |
тв. тело |
Температура плавления простого вещества, оС |
-218,9 |
119,3 |
220 |
450 |
Как следует из таблиц 13 и 14, величины энергии ионизации, энергии сродства к электрону, электроотрицательности у элементов VI А группы меньше, чем у галогенов, но, как и для галогенов, значения этих величин в группе сверху вниз уменьшаются, что свидетельствует об ослаблении неметаллических свойств элементов и их простых веществ (а, значит, и их окислительной и реакционной способности) при переходе от кислорода к теллуру.
