
- •Лекция 1. Вопросы лекции:
- •Лекция 2. Вопросы лекции:
- •Химические свойства аминокислот
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Лекция 3. Вопросы лекции:
- •Лекция 4. Вопросы лекции:
- •Лекция 5 Вопросы лекции:
- •Лекция 7. Вопросы лекции:
- •Единицы и формы выражения активности ферментов
- •Первичная структура нуклеиновых кислот
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Третичная структура днк (двойная спираль)
- •Вторичная (а) и третичная (б) структура тРнк
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Гликолипиды: цереброзиды и ганглиозиды
- •Стероиды
- •Анисимов, а. А. Основы биохимии / а. А. Анисимов. М. : Высшая школа, 1987.
- •Березов, т. Т. Биологическая химия / т. Т. Березов, б. Ф. Коровкин. М. : Медицина, 1990.
- •Комов, в. П. Биохимия / в. П. Комов, в. Н. Шведова. М. : Дрофа, 2004.
- •Лекция 14. Вопросы лекции:
- •Жирорастворимые витамины
- •Водорастворимые витамины их производные
- •Лекция 15. Вопросы лекции:
- •Структура атф
- •Катаболизм пуриновых нуклеозидов
- •Катаболизм пиримидиновых нуклеозидов
- •Лекция 17. Вопросы лекции:
- •Репликация днк
- •Синтез рнк
- •Лекция 19. Вопросы лекции:
- •Окислительное дезаминирование
- •Трансаминирование аминокислот
- •Лекция 21. Вопросы лекции:
- •Метаболизм глюкозы-6-фосфат – ключевого метаболита углеводного обмена
- •Стадия генерации атф
- •1. Образование фосфоенолпирувата
- •Фосфоролиз тиоэфирной связи
- •Субстратное фосфорилирование гдф
- •Лекция 24. Вопросы лекции:
- •Пентозомонофосфатный путь
- •Окислительная стадия
- •Неокислительная стадия
- •1. Активация жирных кислоты в цитоплазме
- •Транспорт ацильной группы в митохондрии
- •Собственно -окисление
- •Энергетический баланс -окисления
- •Окисление ненасыщенных жирных кислот
- •1. Активация жирных кислоты в цитоплазме
- •2. Транспорт ацильной группы в митохондрии
- •3. Собственно окисление:
- •Лекция 26. Вопросы лекции:
- •Биосинтез жирных кислот
- •1. Транспорт внутримитохондриального ацетил-КоА в цитоплазму:
- •2. Образование малонил-КоА
- •3. Собственно синтез жирных кислот:
- •Ацетил-апб-малонил ацетил
- •Строение протонной атФазы митохондрий
- •Транспортные системы митохондрий.
- •Лекция 29. Вопросы лекции:
- •Лекция 30. Вопросы лекции:
- •Классификация гормонов
- •Лекция 32. Вопросы лекции:
- •Взаимосвязь метаболизма углеводов, липидов и белков
- •Взаимосвязь ключевых метаболитов
2. Образование малонил-КоА
фермент: ацетил-КоА-карбоксилаза
А цетил-КоА
+ СО2
+ АТФ Малонил-КоА +АДФ +Фн
цетил-КоА
+ СО2
+ АТФ Малонил-КоА +АДФ +Фн
3. Собственно синтез жирных кислот:
1. фермент: ацетил-ацилпереносящий белок(АПБ)-трансфераза
HS-АПБ-SH + Ацетил-КоА ацетил-АПБ-SH + HS-КоАSH
2. фермент: малонил-АПБ-трансфераза
ацетил-АПБ-SH + малонил-КоА ацетил-АПБ-малонил + HS-КоАSH
3. фермент: -кетоацил-АПБ-синтаза
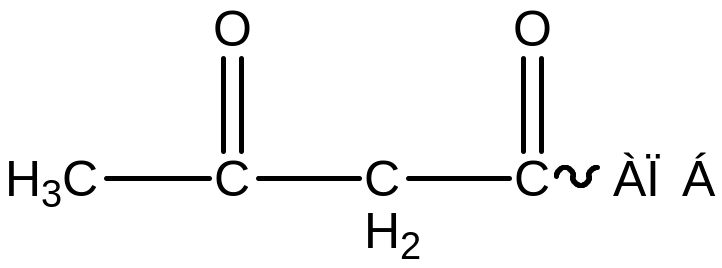
Ацетил-апб-малонил ацетил
-кетоацил-АПБ
4. фермент: -кетоацил-АПБ – редуктаза
-кетоацил-АПБ + НАДФН.Н+ -гидроксиацил-АПБ + НАДФ+
5. фермент: -гидроксиацил-АПБ – дегидратаза
-гидроксиацил-АПБ транс-еноил-АПБ
6. фермент: еноил-АПБ-редуктаза
транс-еноил-АПБ+ НАДФН.Н+ бутирил-АПБ+ НАДФ+
Литература:
Анисимов, А. А. Основы биохимии / А. А. Анисимов. М. : Высшая школа, 1987.
Березов, Т. Т. Биологическая химия / Т. Т. Березов, Б. Ф. Коровкин. М. : Медицина, 1990.
Комов, В. П. Биохимия / В. П. Комов, В. Н. Шведова. М. : Дрофа, 2004.
Филиппович, Ю. Б. Основы биохимии / Ю. Б. Филиппович. М. : Высшая школа, 1999.
Gilbert, H. Basic Concepts in biochemistry / H. Gilbert. Paperbach, 1999.
Лекция 27.
Вопросы лекции:
Основные понятия биохимической термодинамики.
Классификация реакций биологического окисления.
П
 ринципы
структурно-функциональной организации
электрон-транспортной (дыхательной)
цепи митохондрий.
ринципы
структурно-функциональной организации
электрон-транспортной (дыхательной)
цепи митохондрий.
Структура АТФ
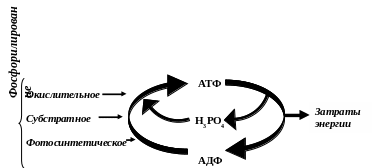
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Окисление, сопряженное с фосфорилированием АДФ:
субстратное фосфорилирование
оксилительное фосфорилирование
Свободное окисление
- окислительные реакции, энергия которых не трансформируется в энергию АТФ. Высвобождающаяся энергия переходит в тепловую и рассеивается.
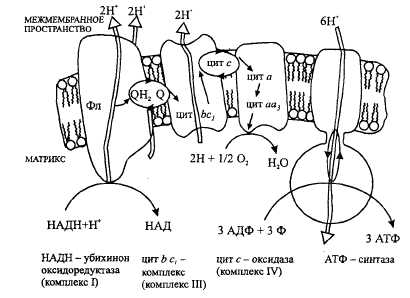
Строение дыхательной цепи митохондрий
Литература:
Анисимов, А. А. Основы биохимии / А. А. Анисимов. М. : Высшая школа, 1987.
Березов, Т. Т. Биологическая химия / Т. Т. Березов, Б. Ф. Коровкин. М. : Медицина, 1990.
Комов, В. П. Биохимия / В. П. Комов, В. Н. Шведова. М. : Дрофа, 2004.
Коничев, А. С. Биохимия и молекулярная биология. Словарь терминов / А. С. Коничев, Г. А. Севастьянова. М. : Дрофа, 2008.
Филиппович, Ю. Б. Основы биохимии / Ю. Б. Филиппович. М. : Высшая школа, 1999.
Gilbert, H. Basic Concepts in biochemistry / H. Gilbert. Paperbach, 1999.
Лекция 28.
Вопросы лекции:
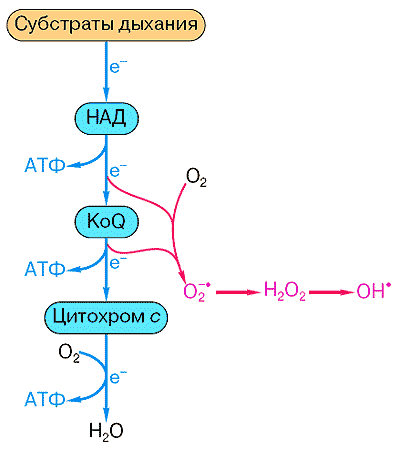
НАД- и НАДФ-зависимые дегидрогеназы, флавиновые ферменты, убихинон, цитохромы и цитохромоксидаза.
Механизмы сопряжения окисления и фосфорилирования в дыхательной цепи.
Трансмембранный потенциал протонов и работа АТФ-синтетазы.
Локализации пунктов сопряжения окисления и фосфорилирования в дыхательной цепи митохондрий
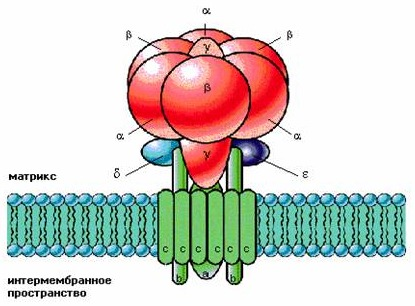
Протонная АТФаза состоит из двух отдельных частей: F0, гидрофобной части, связанной с мембраной, ответственной за транспорт протонов, и F1, гидрофильной части, ответственной за синтез и гидролиз АТФ.
Общий план строения F1-части АТФазы: α3β3∂ε. Каталитический центр образован β-субъединицы, ε-субъединица подавляет АТФазную активность фермента, α-субъединицы выполняют защитную функцию по отношению к активному центру.
