- •1. Общие положения
- •Требования к отбору проб для анализа
- •Определение физических свойств природной воды
- •2. Полевые методы анализа природных вод
- •Определение рН при помощи раствора универсального индикатора Цель работы
- •Общие сведения
- •Цель работы
- •Общие сведения
- •Определение нитрит-иона (no2-) Цель работы
- •Общие сведения
- •Определение иона окисного железа Цель работы
- •Общие сведения
- •Цель работы
- •Общие сведения
- •Определение общего содержания железа
- •Объемные методы анализа
- •Тригонометрическое определение кальция Цель работы
- •Общие сведения
- •Определение хлорид-ионов капельным способом Цель работы
- •Определение содержания кальция в воде с использованием титриметра Цель работы
- •Общие сведения
- •3. Физико-химические методы анализа
- •Фотоколориметрический метод
- •Работа на кфк-2мп
- •Измерение Eh
- •Измерение рН
- •4. Обработка и оформление результатов анализа
- •Содержание
Измерение Eh
Аппаратура, приборы, реактивы и раствор
Потенциометр рН-150
Стандартный раствор для калибровки
Электрод вспомогательный ЭВЛ-1М4
Электрод платиновый ЭПЛ-02
Стаканчики на 50 мл
Дистиллированная вода.
Ход определения
Потенциометр должен быть включен за 15 минут до проведения измерений. Установить вспомогательный и платиновый электроды. Перед началом работы надо убедиться в правильности калибровки платинового электрода. Для этого измеряют Eh стандартного раствора. Налить в стаканчик на 50 мл стандартный раствор, поставить его на откидной столик измерительной системы, вставить в стаканчик измерительную ячейку с вспомогательным и платиновым электродом, нажать клавишу MV, выждать 20-30 секунд и записать показания разности потенциалов. Его э.д.с. должна быть 230 мВ. После из-
мерения промыть электроды дистиллированной водой и обсушить фильтровальной бумагой. Таким же образом измерить окислительно-восстановительный потенциал исследуемой воды, получаем ЕЬИЗМ . Для того, чтобы определить действительное значение Eh, надо к этому значению прибавить 205 мВ - э.д.с. водородного электрода, получаем Епвыч
Измерение рН
Аппаратура, приборы, реактивы и растворы
Потенциометр рН-150
Буферные растворы для калибровки
Электрод вспомогательный ЭВЛ-1М4 Электрод стеклянный ЭСЛ-15-11
Стаканчики на 50 мл
Дистиллированная вода.
Ход определения.
Потенциометр должен быть включен за 15 минут до проведения измерений. Установить вспомогательный и стеклянный электроды. Перед началом работы надо убедиться в правильности калибровки стеклянного электрода. Для этого измеряют рН 1-2 буферных растворов, например 1.1 рН и 6.86 рН. Налить в стаканчик на 50 мл буферный раствор, поставить его на откидной столик измерительной системы, вставить в стаканчик измерительную ячейку с вспомогательным и стеклянным электродом, нажать клавишу рН, выждать 20-30 секунд, записать показания и выключить клавишу рН. После измерения промыть электроды дистиллированной водой и обсушить фильтровальной бумагой. Таким же образом измерить рН исследуемой воды.
4. Обработка и оформление результатов анализа
Основной формой выражения результатов анализа воды является ионная форма, так как природная вода является более или менее разбавленным раствором солей. Наряду с ионной формой пользуются миллиграмм-эквивалентной формой выражения анализа, как наиболее полно отражающей внутреннюю химическую природу входящих в состав воды веществ и ее важнейшие свойства.
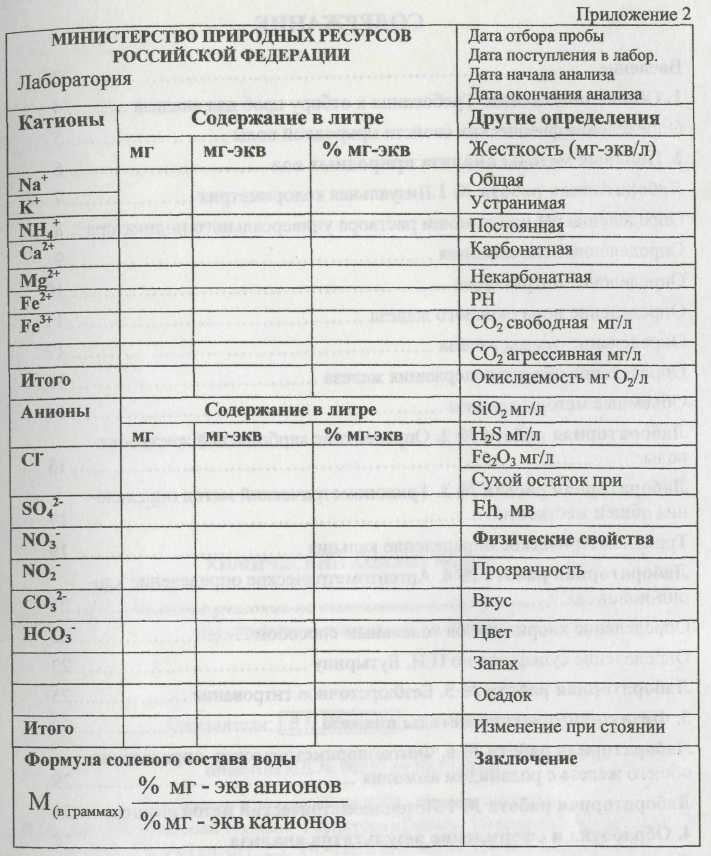
Оформление результатов анализа воды на бланке анализа воды
При проведении массовых анализов удобно пользоваться следующей таблицей при объемном методе анализа.
Таблица 3
1. Результаты должны быть представлены в таблице в мг/дм3, мг-экв/дм3, % мг-экв (приложение 2).
Для расчета мг-экв/л должны быть даны с точностью до сотых единиц (n 0,01); мг/л до целых единиц (n).
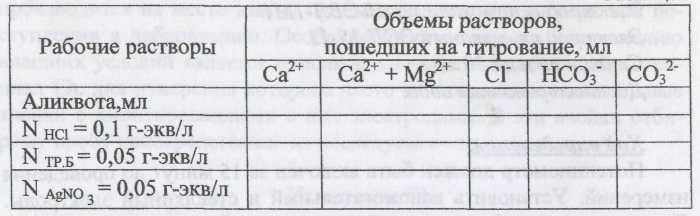
Определение содержания НСО3-
![]() ,
мг-экв/л;
,
мг-экв/л;
![]() ,мг/л;
,мг/л;
![]() .
.
где Vhci- объем раствора НС1 пошедшего на титрование, мл;
Nhci -нормальность раствора, г-экв/л;
Va - объем аликвоты 1000 - переводной коэффициент;
Э - химический эквивалент иона.
Определение содержания Сl-:
![]() ,
мг-экв/л;
,
мг-экв/л;
![]() ,
мг/л;
,
мг/л;
![]()
Определение общей жесткости
![]() ,
мг-экв/л
,
мг-экв/л
Определение содержания Са 2+
![]() ,
мг-экв/л;
,
мг-экв/л;
![]() ,
мг/л;
,
мг/л;
![]()
Определение содержания Mg 2+
![]() ,
мг-экв/л;
,
мг-экв/л;
![]() ,
мг/л;
,
мг/л;
![]()
2. Суммировать мг-экв/л анионов, эту же сумму проставить в графе катионов. Вычислить:
![]()
![]() ,
мг/л;
,
мг/л;
![]()
3. Просуммировать все анионы в мг/л, но мг/л НСО3- взять только половину, так как минерализацию рассчитывают по сухому остатку. Вычислить минерализацию в г/л.
4. Если содержание НСО3- в мг-экв/л больше или равно общей жесткости, то вся жесткость - карбонатная. Если НСО3- + СО32- < Жо, то карбонатная жесткость равна их содержанию, а некарбонатная жесткость равна Жо - Жкарб.
5. Вычислить содержание анионов и катионов, в %мг-экв/л:
Например,
![]() ,
,
Или
![]()
6. Написать формулу солевого состава воды и дать название воды.
Например,
![]()
Название воды: гидрокарбонатная кальциево-магниевая.
ПЕРЕЧЕНЬ ЛАБОРАТОРНЫХ РАБОТ
1. Визуальная колориметрия
2. Определение карбонатной жесткости воды
3. Тригонометрический метод определения общей жесткости и кальция в воде
4. Аргентометрическое определение хлорид-ионов и определение сульфат-ионов по П.Н. Бутырину
5. Безбюреточное титрование
6. Фотоколориметрическое определение общего содержания железа с роданидом аммония
7. Потенциометрический метод анализа
ЗАКЛЮЧЕНИЕ
Данные методические указания для выполнения лабораторных работ по курсу «Химический анализ воды», предназначенные для выработки практических навыков в проведении анализов воды во время учебной гидрогеологической и инженерно-геологической практики, охватывают небольшое количество определяемых компонентов в природной воде. В практической работе гидрогеологам приходится определять много других важных показателей, как, например: окисляемость, агрессивность, сернистые соединения и различные металлы. Химический анализ воды следует дополнять ионо-селективным анализом, определением окисляемости, агрессивности, фотоколориметрическими методами определения металлов в природных водах.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК Основная литература
1. Резников А. А., Мулжовская Е.П., Соколов И.Ю. Методы анализа природных вод.-М.: Недра, 1970
2. ГОСТ 2872-84 «Вода питьевая». М. Из-во стандартов, 1982
Дополнительная
3. Алексеев В.Н. Количественный анализ. М. Из-во «Химия», 1972
4. С.А. Шапиро, М.А. Шапиро. Аналитическая химия. М. «Высшая школа», 1979
5. Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М., Химия. 1974
6. Шарло Г. Методы аналитической химии. 4.2. - М.: Химия. 1969
7. СанПиН 2.1.4.559-96. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества: Санитарные правила и нормы. - М.: Инф.-изд. центр Госкомсанэпиднадаора России, 1996
Приложение 1
МИНИСТЕРСТВО ПРИРОДНЫХ Дата отбора пробы ………. РЕСУРСОВ РОССИЙСКОЙ Дата поступления в лабораторию……….. ФЕДЕРАЦИИ Дата начала анализа……….
Дата окончания анализа……….
Лаборатория АНАЛИЗ ВОДЫ №_____
1. Экспедиция, партия, отряд №___.
2. № пробы заказчика___
3. Название водопункта и его №_
4. Дебит, л/сек__________
5. Общая глубина скважины, колодца______м
6. Глубина взятия пробы_____м
7. Глубина расположения фильтров_____м
8. Глубина залегания водоносного горизонта___м
9. Краткая характеристика вмещающих пород и их геологический индекс
10. Технические условия изоляции опробованного водоносного горизонта (цемен-таж, обсадные трубы и др.)
11. Условия и методика отбора пробы
12. Наблюдались ли выделения пузырьков газа_
13. Температура воды на глубине взятия пробы_
14. Количество воды, присланной на анализ_
15. Фамилия отбиравшего пробу_________
Примечание: