
- •Лекция №3.
- •II. Номенклатура алкенов.
- •III. Изомерия.
- •1. Изомеры углеродной цепи ( структурная изомерия ).
- •2. Изомеры положения двойной связи:
- •3. Межклассовая изомерия:
- •IV Физические свойства:
- •V. Получение алкенов.
- •2.Реакциями элиминирования:
- •VI. Химические свойства.
- •Механизм реакции электрофильного присоединения.
- •3.Присоединение галогеноводородов (гидрогалогенирование).
- •Правило Морковникова: « Присоединение атома водорода происходит всегда к наиболее гидрогенизированному атому углерода ».
- •4.Присоединение воды (реакция гидратации).
- •5.Реакции окисления.
- •6.Горение.
- •7.Разложение.
- •8.Реакция полимеризации.
- •9.Реакция Гарриуса.
- •VII.Применение алкенов.
Правило Морковникова: « Присоединение атома водорода происходит всегда к наиболее гидрогенизированному атому углерода ».
4.Присоединение воды (реакция гидратации).
K=H2SO4
↓ │ t
CH2 = CH2 + H2O —————→ CH3 — CH2OH
↑ (HOH) этиловый спирт
│
 t,k
t,k
а) CH2 = CH2 + HO — SO2 — OH ———→ CH3 — CH2 — O — SO2 — OH
серная кислота этилсерная кислота
t,k
б) СH3 — CH2 — O — SO2 — OH + HOH ———→ CH3CH2OH + HO — SO2 —OH
этилсерная кислота этиловый серная
спирт кислота
5.Реакции окисления.
t=300˚C, k=Ag
а) 2СH2 = CH2 + O2 ———————→ 2CH2 — CH2

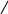
O
этоксиэтан
6.Горение.
Этилен горит светящися пламенем с образованием СО2 и Н2О, слегка коптящим пламенем.
t
а) С2Н4 + 3О2 ————→ 2СО2↑ + 2Н2О ( в струе кислорода )
избыток
t
б) С2Н4 + 2О2 ————→ СО2↑ + 2Н2О + С ( горение на воздухе )
недостаток
7.Разложение.
t
С2Н4 —————→ 2С + 2Н2↑
8.Реакция полимеризации.
H H
t,k │ │
а) n H2C = CH2 ——————→ ( — C — C— ) n
│ │
H H
полиэтилен
t,k
б) n CH2 = CH —————→ ( —CH2—CH— ) n
│ │
CN CN
акрилонитрил полиакрилонитрил
9.Реакция Гарриуса.
t менее 20˚С
Н3С—СН = СН2 + О3 ———————→ Н3С — СН — О — СН2 + Н2О →
│ │
О———— О озонид
О О
// // / ——→ СН3 — С + Н — С + Н2О2
\ \
Н Н
этаналь метаналь пероксид водорода
Озониды — сильно взрывчатые вещества.
Качественные реакции на непредельные углеводороды (реакции на двойную связь).
Реакция окисления ( реакция Вагнера ,обесцвечивание раствора КMnО4)
а) в нейтральной среде:
3СН2 = СН2 + 2КмnO4 + 4H2O——→3CH2OH — CH2OH + 2MnO2↓ + 2KOH
этилен фиолетовый этиленгликоль буров. цв.
раствор
б) в щелочной среде:
С2Н4 + 2KOH + 2KМnO4 ———→ C2H6O2 + 2K2MnO4
перманганат этиленгликоль манганат калия
калия (р-р. зелёного цвета)
2. Обесцвечивание избытка брома в бромной воде
Н2С = СН2 + Br2 ———→ CH2 — CH2
│ │
Br Br
1,2 дибромэтан
