
- •1. Физические модели в механике. Тело отсчета. Система отсчета. Операции с векторами. Время. Траектория. Путь. Перемещение.
- •2. Скорость и ускорение. Нормальное и касательное ускорение.
- •3. Угловые характеристики: перемещение (поворот), скорость и ускорение. Связь между линейными и угловыми кинематическими характеристиками.
- •5. Преобразования координат г. Галилея. Принцип относительности г. Галилея.
- •6. Сила тяжести и вес тела. Закон Гука. Модули упругости, коэффициент Пуассона.
- •7. Сухое и вязкое трение. Формула Ньютона. Виды сухого трения: покоя, скольжения, качения.
- •8. Закон Всемирного тяготения. Напряженность, работа, потенциал гравитационного поля.
- •9. Космические скорости.
- •10. Неинерциальные системы отсчета. Сила инерции. Сила Кориолиса и ее проявление в природе и технике.
- •11. Импульс. Вывод закона сохранения импульса из второго закона динамики. Центр масс системы материальных точек.
- •12. Физические основы космических полетов: законы движения тел переменной массы.
- •13. Энергия как количественная мера движения материи. Работа силы. Мощность. Кинетическая энергия и ее связь с работой.
- •14. Потенциальная энергия. Потенциальное поле. Консервативные силы. Работа в поле потенциальных сил.
- •Сумма кинетической и потенциальной энергии тел, составляющих замкнутую систему и взаимодействующих между собой силами тяготения и силами упругости, остается неизменной.
- •16. Момент инерции и момент импульса. Уравнение моментов. Основное уравнение динамики вращательного движения.
- •17. Момент инерции твердого тела относительно неподвижной оси вращения. Теорема Штейнера. Моменты инерции тел вращения.
- •18. Кинетическая энергия твердого тела.
- •19. Постулаты Эйнштейна. Преобразования Лоренца. Инварианты преобразований.
- •20. Элементы релятивистской динамики: масса, импульс и энергия. Релятивистская динамика Энергия и импульс
- •[Править]Уравнения движения
- •21. Общие свойства жидкостей и газов. Давление. Закон Паскаля, закон Архимеда. Равновесие, погруженных в жидкость, тел. Идеальная жидкость.
- •Характерные свойства газов, жидкостей и твердых тел.
- •22. Уравнение неразрывности струи. Уравнение Бернулли. Течение вязкой жидкости. Уравнение неразрывности.
- •Уравнение Бернулли.
- •23. Ламинарное и турбулентное течение. Число Рейнольдса. Движение вязкой жидкости в трубе. Формула Пуазейля. Метод Стокса.
- •25. Сложение гармонических колебаний: колебаний одного направления, взаимно перпендикулярных колебаний.
- •§2.1. Сложение гармонических колебаний одного направления.
- •§2.2. Сложение взаимно перпендикулярных колебаний.
- •26. Маятники: физический, математический и пружинный.
- •27. Свободные колебания. Коэффициент затухания, декремент затухания, добротность колебательной системы.
- •28. Вынужденные колебания. Резонанс.
- •29. Понятие волны. Продольные и поперечные волны. Волновое уравнение. Энергия бегущей волны. Вектор Умова. Стоячие волны.
- •Волновое уравнение.
- •Вектор Умова.
- •Стоячие волны.
- •30. Уравнение состояния. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам.
- •31. Классическая теория теплоемкости идеального газа.
- •33. Политропические процессы. Политропные процессы
- •34. Обратимые и необратимые тепловые процессы. Тепловые двигатели. Обратимые и необратимые тепловые процессы.
- •35. Второе начало термодинамики в формулировке Томсона и Клаузиуса. Цикл Карно. Кпд тепловой машины.
- •36. Энтропия. Закон возрастания энтропии. Цикл Карно в (t,s) – координатах.
- •1. Понятии и общая характеристика энтропии
- •2. Принцип возрастания энтропии
- •37. Термодинамические потенциалы.
- •38. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
- •Отступление от законов идеального газа. Уравнение Ван-дер-Ваальса.
- •3. Изотермы Ван дер Ваальса и их анализ.
- •39. Внутренняя энергия реального газа. Эффект Джоуля-Томсона. Энтальпия.
- •Внутренняя энергия реального газа.
- •Эффект Джоуля—Томсона.
- •40. Свойства жидкостей. Поверхностное натяжение. Явление смачивания.
- •41. Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •42. Свойства твердых тел. Моно- и поликристаллы. Типы кристаллических решеток.
- •43.Дефекты в кристаллах. Теплоемкость твердого тела.
- •44. Фазовые переходы первого рода. Условия равновесия фаз. Диаграмма фазового равновесия. Тройная точка. Фазовые переходы второго рода. Λ-переходы. Фазовые переходы первого рода
- •Примеры фазовых переходов первого рода
- •3.1. Условия равновесия фаз. Фазовые диаграммы
30. Уравнение состояния. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам.
Среди
равновесных процессов, которые происходят
с термодинамическими системами, отдельно
рассматриваются изопроцессы, при которых
один из основных параметров состояния
остается постоянным.
Изохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е. ![]() Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии: ![]() т.к.
CV=dUm/dt,
Тогда
для произвольной массы газа получим
т.к.
CV=dUm/dt,
Тогда
для произвольной массы газа получим
![]() (1)
Изобарный
процесс (p=const).
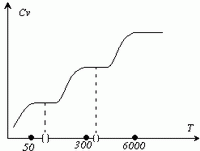
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
(2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний,
то
и
(1)
Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
(2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний,
то
и ![]() откуда
откуда
![]() Тогда
выражение (2) для работы изобарного
расширения примет вид
Тогда
выражение (2) для работы изобарного
расширения примет вид ![]() (3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если T2 —T1 =
1К, то для 1 моль газа R=A, т. е. R численно
равна работе изобарного расширения 1
моль идеального газа при нагревании
его на 1 К.
(3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если T2 —T1 =
1К, то для 1 моль газа R=A, т. е. R численно
равна работе изобарного расширения 1
моль идеального газа при нагревании
его на 1 К.
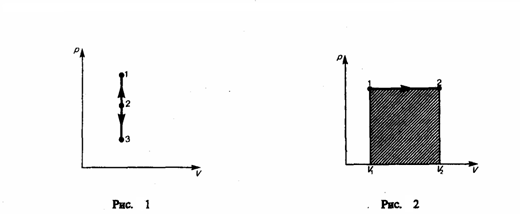
Рис.1
В
изобарном процессе при сообщении газу
массой m количества теплоты ![]() его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt)
его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt) ![]() При
этом газ совершит работу, определяемую
выражением (3).
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
Диаграмма
этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
При
этом газ совершит работу, определяемую
выражением (3).
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
Диаграмма
этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
![]() Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
Так
как при Т=const внутренняя энергия идеального
газа не изменяется: ![]() то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса
то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса ![]() т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
![]() (4)
Значит,
для того чтобы при расширении газа
температура не становилась меньше, к
газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
(4)
Значит,
для того чтобы при расширении газа
температура не становилась меньше, к
газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
31. Классическая теория теплоемкости идеального газа.
Обьект
- ИГ Теплоемкостью
тела С называется отношение бесконечно
ма юго количества тепла бQ, полученного
телом, к соответствующему приращению
dT его температуры:![]() Когда
масса тела равна единице, теплоемкость
называют удельной — ее мы будем обозначать
малой буквой с.
Более
удобна молярная теплоемкость. Так
называют теплоемкость одного моля
вещества. Эту величину мы будем обозначать
большой буквой С.
Особое значение
имеют теплоемкости при постоянном
объеме и постоянном давлении, обозначаемые
символами Сv и Ср.
Когда
масса тела равна единице, теплоемкость
называют удельной — ее мы будем обозначать
малой буквой с.
Более
удобна молярная теплоемкость. Так
называют теплоемкость одного моля
вещества. Эту величину мы будем обозначать
большой буквой С.
Особое значение
имеют теплоемкости при постоянном
объеме и постоянном давлении, обозначаемые
символами Сv и Ср.
![]()
![]() КЛАССИЧЕСКАЯ
ТЕОРИЯ ТЕПЛОЕМКОСТИ Эта теория
основывается на предполо- предположении
о равномерном распределении энергии
по степеням свободы движения молекулы.
Молекула идеал. однотомного газа,
рассматриваемая как мат. точка, может
иметь только энергию поступательного
движения. Энергией вращательного
движения такая молекула не обладает
вследствие того, что при соударениях
молекул идеального одноатомного газа
энергия вращательного движения не
передается.
Теорема Больцмана —
Максвелла утверждает далее, что такое
же количество внергии приходится на
одну степень свободы в любом газе,
независимо от числа степеней свободы,
которыми обладает молекула этого газа.
Поэтому задача о вычислении энергии
газовой молекулы, а следовательно, и об
определении его теплоемкости, сводится
к определе- определению числа степеней
свободы газовой молекулы.
Число
степеней свободы в сложных молекулах
может быть значительно больше шести,
так как имеются многочисленные степени
свободы колебательного движения атомов.
Каждое колебательное движение в молекулы
дает две степени свободы: одна из них
соответствует кинетической энергиимолекулы,
другая — потенциальной.
Трудности
классической теории:
1. Даже при
"Комнатных" температурах теплоюмкости
разных газов с одиннаковыми количеством
атомов отличаються дркг от друга, и не
кратны R.
2.
Согласно Кл. теории С газов не должно
зависить от T, на самом деле С сильно
понижаетися с понижением Т.
КЛАССИЧЕСКАЯ
ТЕОРИЯ ТЕПЛОЕМКОСТИ Эта теория
основывается на предполо- предположении
о равномерном распределении энергии
по степеням свободы движения молекулы.
Молекула идеал. однотомного газа,
рассматриваемая как мат. точка, может
иметь только энергию поступательного
движения. Энергией вращательного
движения такая молекула не обладает
вследствие того, что при соударениях
молекул идеального одноатомного газа
энергия вращательного движения не
передается.
Теорема Больцмана —
Максвелла утверждает далее, что такое
же количество внергии приходится на
одну степень свободы в любом газе,
независимо от числа степеней свободы,
которыми обладает молекула этого газа.
Поэтому задача о вычислении энергии
газовой молекулы, а следовательно, и об
определении его теплоемкости, сводится
к определе- определению числа степеней
свободы газовой молекулы.
Число
степеней свободы в сложных молекулах
может быть значительно больше шести,
так как имеются многочисленные степени
свободы колебательного движения атомов.
Каждое колебательное движение в молекулы
дает две степени свободы: одна из них
соответствует кинетической энергиимолекулы,
другая — потенциальной.
Трудности
классической теории:
1. Даже при
"Комнатных" температурах теплоюмкости
разных газов с одиннаковыми количеством
атомов отличаються дркг от друга, и не
кратны R.
2.
Согласно Кл. теории С газов не должно
зависить от T, на самом деле С сильно
понижаетися с понижением Т.
 Оказалось
что энергия врашательного и колебательного
движения молекул являеться квантовой,
тоесть может изменятися порциями или
скочками, причем расстояние между
уровнями примерно на порядок выше чем
энергия врашения.
График имеет
восходяший участок это объясняеться
тем что при повышении температуры невсе
молекулы одновременно переходят в
другую стадию движения.
Оказалось
что энергия врашательного и колебательного
движения молекул являеться квантовой,
тоесть может изменятися порциями или
скочками, причем расстояние между
уровнями примерно на порядок выше чем
энергия врашения.
График имеет
восходяший участок это объясняеться
тем что при повышении температуры невсе
молекулы одновременно переходят в
другую стадию движения.
32. Адиабатный процесс.
Адиабатный
процесс —
это процесс, происходящий без теплообмена
системы с окружающей средой, т.е. Q =
0. Первый закон термодинамики имеет
вид:![]()
Это
значит, что при адиабатном процессе
система может выполнять работу над
внешними телами только за счет убыли
своей внутренней энергии. Если А >
0, то ΔU =
-A <
0, т.е. U2 < U1,
а так как ![]() ,
то T2 < T1.
,
то T2 < T1.
Как известно, газ совершает положительную работу, если ΔV > 0.
Таким образом, при адиабатном расширении газ совершает работу и сам охлаждается. Наоборот, при адиабатном сжатии А < 0 над газом совершается работа и газ нагревается.
При
адиабатном процессе давление и объем
связаны между собой уравнением
![]()
где γ > 1 — показатель адиабаты (или коэффициент Пуассона). Это уравнение называется уравнением адиабаты или уравнением Пуассона.
Адиабатное изменение состояния газа можно выразить графически. График этого процесса называют адиабатой. При одних и тех же начальных условиях (p0, V0) при адиабатном расширении давление газа уменьшается быстрее, чем при изотермическом (рис. 1), так как падение давления вызвано не только увеличением объема (как при изотермическом расширении), но и понижением температуры. Поэтому адиабата идет ниже изотермы и газ при адиабатном расширении совершает меньшую работу, чем при изотермическом расширении.
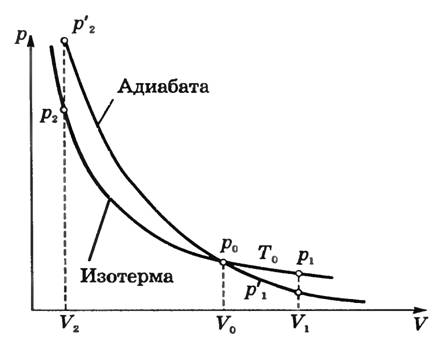 Рис.
1
Рис.
1
При быстром сжатии (расширении) теплообмен произойти не успевает и процессы можно рассматривать как адиабатные (неравновесные). Поэтому любой газ при быстром сжатии нагревается (например, нагревание насоса при накачивании велосипедной шины). При сильном и быстром сжатии воздуха температура может повыситься настолько, что при наличии в воздухе паров бензина они воспламеняются. Это используется в дизельных двигателях для зажигания горючей смеси. Этим объясняется необходимость специального охлаждения мощных компрессоров.
Охлаждение воздуха при адиабатном расширении вызывает образование облаков.
