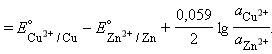Билет 30
Гальванические элементы –химический источник электрического тока,принцип действия основан на взаимодействии двух металлов через электролит,приводящем у возникновению в замкнутой цепи электрического тока.
Чтобы определить стандартный электродный потенциал металла ,измеряют электродвижущую силу гальванического элемента,дин из электродов которого-исследуемый металл,погруженный в состав его соли,а второй электрод-эталонный(водородный).
Величина электродного потенциала зависит от природы состава контактирующих фаз и от кинетических закономерностей электродных реакций на границе раздела двух фаз.
Уравнение Нернста-это уравнение связывающее окислительно-восстановительный потенциал системы с активностями веществ,входящих в уравнение и стандартными электродными потенциалами окислительно-восстановительных пар.
E=E0+RT/nF*ln Aox/Ared,где Е-электродный потенциал
Е0-стандартный электродный потенциал
F- число Фарадея 96485,35 Кл*Моль-1
n-число моль электронов,учавствующих в процессе
Aох и Ared-активности окисленной и восстановленной форм вещества
ПРИ СТАНДАРТНЫХ УСЛОВИЯХ:
Не нашла
Билет 31
Концентрационные
элементы состоят из одинаковых
электродов, отличающихся активностями
потенциалопределяющего иона
![]() Действительно,
из уравнения Нернста следует, что при
Действительно,
из уравнения Нернста следует, что при
![]() ЭДС
концентрационного элемента
ЭДС
концентрационного элемента
 В
топливных гальванических элементах
(электрохимических генераторах) процесс
окисления некоторых видов топлива
используется для непосредственного
получения электрической энергии.
Основным их преимуществом является
принципиальная возможность достижения
очень высоких КПД использования
топлив.
В
топливных гальванических элементах
(электрохимических генераторах) процесс
окисления некоторых видов топлива
используется для непосредственного
получения электрической энергии.
Основным их преимуществом является
принципиальная возможность достижения
очень высоких КПД использования
топлив.
Аккумуляторами называются обратимые гальванические элементы многоразового действия. При пропускании через них электрического тока (зарядке) они накапливают химическую энергию, которую потом при их работе (разрядке) отдают потребителю в виде электрической энергии. Наиболее распространены два вида аккумуляторов: кислотный (свинцовый) и щелочные.
Схему аккумулятора можно изобразить так:
![]()
Э.Д.С. гальванического элемента зависит от материала электродов и состава электролита. ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
![]()
![]()
Примеры.В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)
![]()
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
|
|
Билет 32
Обратимые электродные процессы-это процессы
в которых реакция не идет, а приведенные уравнения справедливы только в случае обратимого равновесия.
Необратимые электродные процессы- наблюдаются в тех случаях, когда скорость превращения в-ва на электроде определяется только скоростью электро-хим.
Обратимым электродом называют такой, у которого в месте соприкосновения электрода с электролитом, при перемене направления тока, совершается химическое прекращение, как раз обратное тому, что совершалось при первоначальном направлении тока. Э., не удовлетворяющие этому требованию, носят название необратимых. Пример обратимого электрода: тяжелый металл (медь, цинк, кадмий и др.) погруженный в раствор соли того же металла. При прохождении тока от меди к медному купоросу - растворяется медь, при обратном направлении тока медь осаждается.
Таким образом, в истинно обратимом электроде все процессы полностью обратимы
Недостаток сурьмяного электрода: не вполне обратимый электрод и измеряемые им потенциалы не вполне подчиняются уравнению Нернста