
- •1.Термодинамическая система. Основные параметры состояния.
- •2.Первый закон термодинамики, его приложение к биосистемам. Закон Гессе
- •3.Эффективность энергетических процессов. Терморегуляция.
- •4.Второе начало термодинамики, его приложение к биосистемам. Энтропия. Энергия Гиббса.
- •5.Организм как открытая термодинамическая система. Принцип Ле-Щателье. Уравнение Пригожина.
3.Эффективность энергетических процессов. Терморегуляция.
В работу может быть преобразована только часть внутренней энергии системы называется свободной энергией, остальная связанная. U=G+Eсвяз
Работа, процессы для которой (A=∆G) совершенная работа равна свободной энергии является обратимой. Для обр.проц.: А1=А2, для необр.проц.: А1‹А2
Организм человека, совершает работу используя энергию химических связей органических веществ поступающих с пищей. ∆U=Eпищи – Q – A
В норме для стационарного состояния организма человека изменение внутренней энергии = 0 (∆U=0) Eпищи= Q+A
Терморегуляция включает:
Химическая терморегуляция-это усиление обмена веществ и соответственно теплопродукции при t среды ниже +15, и ослабление при t выше +30.
Физическая терморегуляция осуществляется путем изменений отдачи тепла организмом. Особо важное значение она приобретает в поддержании постоянства температуры тела во время пребывания организма в условиях повышенной температуры окружающей среды. Теплоотдача осуществляется путем теплоизлучения (радиационная теплоотдача)(длинна волны=10мкм, в состоянии покоя при tсреды=20, 70%тепла отводится во внешнюю среду), конвекции, т. е. движения и перемешивания нагреваемого телом воздуха, теплопроведе-ния, т. е. отдачи тепла веществам, непосредственно соприкасающимся с поверхностью тела
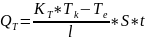 ;
И испарения
воды с
поверхности кожи и легких. QE=Lm
(L-удельная
теплота испарения)
;
И испарения
воды с
поверхности кожи и легких. QE=Lm
(L-удельная
теплота испарения)
4.Второе начало термодинамики, его приложение к биосистемам. Энтропия. Энергия Гиббса.
Теплота не может самопроизвольно переходить от тела с меньшей t к телу с большей t.
Энтропия (S) – это термодинамическая функция состояния, которая служит мерой неупорядоченного расположения частиц системы; самопроизвольные процессы характеризующиеся увеличением энтропии.
Понятие
энтропии было впервые введено в 1865 году
Рудольфом Клаузиусом. Он определил
изменение энтропии термодинамической
системы при обратимом процессе как
отношение изменения общего количества
тепла ΔQ к величине абсолютной температуры
T:
![]()
2-е начало термодинамики – энтропия изолированной системы возрастает в необратимых процессах и остается неизменной в обратимых термодинамических процессах. ∆S≥∆Q/T
Второй закон термодинамики утверждает: при любых превращениях энергия переходит в форму, наименее пригодную для использования и наиболее легко рассеивающуюся. Этот закон устанавливает, что любые превращения энергии не позволяют получить ее больше, чем было затрачено изначально, то есть любой материальный объект на Земле при любых физических, химических или иных изменениях может лишь видоизменять энергию из одного вида в другой, но не добиться ее возникновения или исчезновения. При определении любого энергетического процесса, текущего самопроизвольно, происходит переход энергии из концентрированной формы в рассеянную, то есть всегда существуют потери энергии (в виде недоступного для использования тепла), при этом стопроцентный переход из одного вида энергии в другой невозможен. Характерно действие этого закона при переходе из одной формы в другую в живых системах: солнечная энергия в растениях при помощи фотосинтеза преобразуется в органическое вещество и далее в пище консументов преобразуется в движение мышц, работу мозга и другие проявления жизни. На каждом этапе высококачественная энергия переходит с одного уровня на другой, и при этом ее основная часть превращается в низкокачественное тепло и рассеивается в окружающей среде. В открытых системах энтропия (мера количества связанной энергии, которая в изотермическом процессе недоступна для использования, мера беспорядка, неупорядоченности системы) переходит не в полезную работу, а в тепло и рассеивается в пространстве и снижается до определенной минимальной величины, но всегда большей нуля.
Энергия Гиббса
Определяет возможность самопроизвольного протекания процесса с учетом энтальпийного и энтропийного факторов ∆G=∆H-T∆S, если ∆G<0 – такой процесс разрешен и будет происходить, если ∆G>0 – запрещен и в данных условиях не может происходить.
Термодинамические запрещенные процессы могут быть реализованы за счет механизмов энергетического сопряжения.
