
- •4 Курс 1 занятие 2 семестр
- •Сердечно-легочная реанимация
- •Терминальные состояния
- •Этап с. Поддержание кровообращения
- •Этап f. Электрическая дефибрилляция
- •Фармакологическое обеспечение реанимации
- •Выделяют три типа восстановления неврологического статуса в постаноксическом периоде:
- •Целевые значения, необходимые для достижения в постреанимационном периоде:
- •Поддержание и восстановление внутримозгового гомеостаза
- •Американская Ассоциация сердечных заболеваний по слр и неотложной попощи при сердечно-сосудистых заболеваниях 2010
- •Качество слр
- •Основные задачи на начальном и последующих этапах терапии после остановки сердца
- •Основные цели терапии пациентов с окс
- •Поддержание жизнедеятельности в педиатрии,
- •Реанимационная помощь при клинической смерти.
Выделяют три типа восстановления неврологического статуса в постаноксическом периоде:
1. Восстановление происходит после непродолжительного (3 часа) периода отсутствия сознания и характеризуется быстрой нормализацией адекватной психической деятельности в течении 24 часов после клинической смерти .
2. Задержанное восстановление функций ЦНС. Нарушение сознания (сомноленция, сопор, кома различной степени) может продолжаться в течение 3 суток и зависит от развития отека головного мозга.
3.Выраженные неврологические проявления в отдаленном периоде (1-2–3 мес.) декортикационная ригидность,децеребрация,апалический синдром.
Прогностическая оценка сознания в постреанимационном периоде. Для диагностики тяжести постаноксической гипоксии исследуют: реакция зрачка на свет, Постгипоксическая энцефалопатия описывается общемозговыми и очаговыми неврологическими симптомами.
В зависимости от уровня повреждения может наблюдаться различная степень угнетения сознания вплоть до атонической комы (кома III). Прогностически важным является состояние зрачков. Сохранение двустороннего расширения зрачков с изменением правильности их формы после прекращения действия «больших» доз адреномиметиков и холинолитиков свидетельствует о тяжелой степени энцефалопатии с неблагоприятным прогнозом для жизни. Даже в случае отсутствия подобной картины сохраняется вероятность необратимого повреждения корковых структур головного мозга с формированием к исходу острого периода неврологических признаков персистирующего, а затем и хронического вегетативного состояния, роговичный рефлекс, реакция на боль, рефлекс с трахео-бронхиального дерева, сроки восстановления спонтанного дыхания. Учесть седативную терапию и протокол гипотермии. Коматозное состояние в течение 48 и более часов выступает предиктором плохого неврологического исхода. Если через 72 часа после остановки кровообращения неврологический дефицит составляет меньше 5 баллов по шкале ком Глазго в отсутствие двигательной реакции в ответ на болевое раздражение или зрачкового рефлекса, это является предиктором развития персистирующего вегетативного состояния у всех больных.
Исследуются биохимические маркеры, позволяющие определить степень повреждения головного мозга, по аналогии с кардиоспецифическими ферментами при остром инфаркте миокарда. В основном исследуют уровень двух ферментов: нейронспецифической энолазы (NSE) и астроглиального протеина S-100.Так, концентрация в плазме NSE более чем 22 мкг/л (80% чувствительность и 100% специфичность), определяемая в течение первой недели после перенесенной остановки кровообращения, ассоциируется с развитием персистирующей комы.Уровень протеина S-100 более 0,7 мкг/л в первые 24 часа постреанимационного периода ассоциируется с плохим неврологическим исходом .
Постреанимационные изменения в головном мозге укладываются в картину тотальной завершенной постгипоксической энцефалопатии. Для оценки состояния ЦНС используют клиническую оценку неврологического статуса по общепринятым шкалам (шкала ком Глазго), учитывая вероятность медикаментозного угнетения сознания препаратами, используемыми при проведении сердечно-легочной реанимации. Наличие у пациента уровня сознания менее 8 баллов (умеренная кома) свидетельствует о тяжелом повреждении мозга. Среди выживших только 15–20 % имеют быстрое восстановление адекватного уровня сознания, остальные 80 % пациентов проходят через постреанимационную болезнь.
Транскраниальная допплерография - Выраженность реперфузионного синдрома, а также косвенно судить о степени внутричерепной гипертензии. Наличие реверберирующего кровотока в крупных интра- и экстракраниальных сосудах на фоне АД, поддерживаемого на физиологическом уровне, является абсолютным признаком прекращения церебральной перфузии.
Прогрессирование постгипоксичекого отека головного мозга делает небесполезным мониторинг внутричерепного давления. Внутричерепная гипертензия представляет собой основной внутричерепной механизм прогрессирования повреждения мозга. В результате неконтролируемого увеличения внутричерепного объема крови, цитотоксического отека мозгового вещества складываются предпосылки для прогрессирования дислокационных механизмов, приводящих к вторичному повреждению подкорковых и стволовых отделов головного мозга. В целом повышение внутричерепного давления (ВЧД) или снижение системного среднего артериального давления (САД) способно уменьшать церебральное перфузионное давление и таким образом вызывать серьезное повреждение нейронов,т.е. наблюдаться клиника гипертензионно-дислокационного синдрома с артериальной гипертензией и брадикардией. Прогрессирование поражения стволовых отделов приводит к неконтролируемой артериальной гипотензии, характеризующейся резким снижением общего периферического сопротивления. Отличительным моментом такой гипотензии является отсутствие, вернее парадоксальная реакция на инотропную поддержку. Из-за утраты ауторегуляции мозгового кровотока искусственное повышение АД приводит лишь к церебральной гиперемии.
Признаком сохраняющейся (или нарастающей) гипоксии церебральной ткани является снижение сатурации, оттекающей от мозга по яремным венам крови. Падение этого показателя ниже 0,5 прогностически считается неблагоприятным.
Для объективизации морфологических изменений ЦНС в различные периоды постреанимационной болезни используют компьютерную, магнитно-резонансную, позитронно-эмиссионную томографии (КТ, МРТ, ПЭТ), При компьютерной томографии определяется сглаженность извилин, компрессия ликворных цистерн, сдавление желудочковой системы,электро-энцефалографическое (ЭЭГ) исследование, ангиографию.
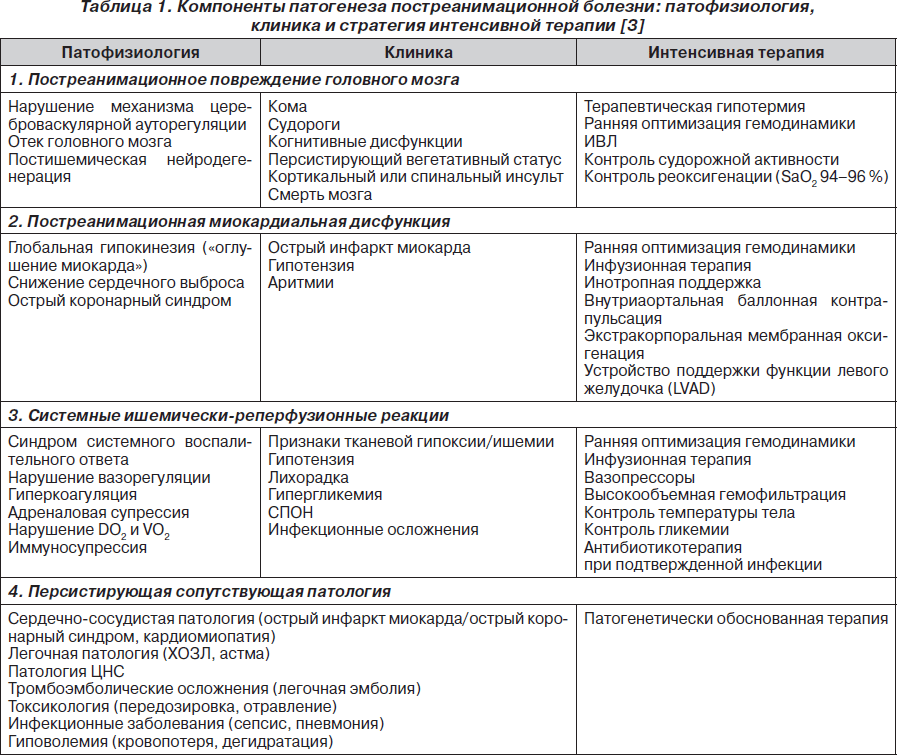
Постреанимационная болезнь затрагивает не только ЦНС, но и другие органы и системы. Отсутствие адекватного кровообращения, тканевая гипоксия,функциональные и морфологические изменения в различных сосудистых бассейнах могут приводить к развитию органной недостаточности(несостоятельности) и прежде всего миокардиальной дисфункции. Имеет различные клинические проявления. Согласно результатам исследований, у пациентов в 49 % случаев постреанимационная дисфункция миокарда манифестирует тахикардией, повышением КДД левого желудочка, а в первые 6 часов гипотензией (САД < 75 мм рт.ст.) и низким сердечным выбросом (СИ < 2,2 л/мин/м2) Нарушение КОС-мет.ацидоз замещается мет.алкалозом,водно-электролитные нарушения, которые носят самый разнообразный характер..Синдром системного воспалительного ответа. Почечная недостаточность.Пневмония.Пролежни.
III. Стадия длительного поддержания жизни
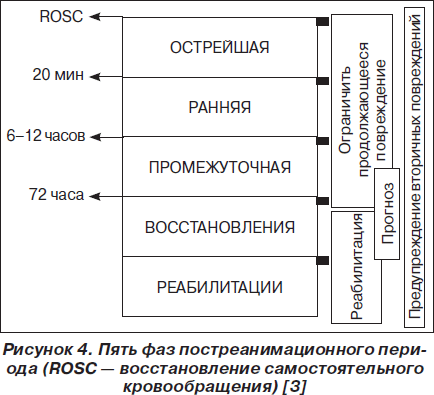
В течении клинической картины ПРБ выделяют 5 стадий :
I стадия (6–8 часов постреанимационного периода) характеризуется нестабильностью основных функций организма. Характерно снижение в 4–5 раз перфузии тканей, несмотря на стабилизацию артериального давления на безопасном уровне, наличие циркуляторной гипоксемии — снижения PvO2 при относительно нормальных показателях PaO2 и SaO2 с одновременным снижением CaO2 и CvO2 за счет анемии; лактоацидоза; повышения урквня продуктов деградации фибриногена (ПДФ) и растворимых комплексов фибрин-мономеров (РКФМ), отсутствущих в норме.
II стадия (10–12 часов постреанимационного периода) характеризуется стабилизацией основных функций организма и улучшением состояния больных, часто только временным. Сохраняются выраженные нарушения перфузии тканей, лактоацидоз, имеется дальнейшая тенденции к повышению уровня ПФФ и достоверно возрастает уровень РКФМ, замедляется фибринолитическая активность плазмы — признаки гиперкоагуляции. Это стадия «метаболических бурь» с явлениями выраженной гиперферментемии.Гиперкоагуляционный синдром.
III стадия (конец 1-х — 2-е сутки постреанимационного периода) характеризуется повторным ухудшением состояния больных по динамике клинических и лабораторных данных. Прежде всего развивается гипоксемия со снижением PaO2 до 60–70 мм рт.ст., одышка до 30/мин, тахикардия, повышение АД до 150/90–160/90 мм рт.ст. у лиц молодого и среднего возраста — признаки синдрома острого легочного повреждения или острого респираторного дистресс-синдрома (СОЛП/ОРДС) с возрастающим шунтированием крови. Максимально выражены признаки ДВС-синдрома: тромбинемия, гиперкоагуляция, нарастание уровня ПДФ на фоне прогрессирующего снижения фибринолитической активности плазмы крови, ведущие к развитию микротромбозов и блокированию органной микроциркуляции.
Превалируют повреждения почек (36,8 %), легких (24,6 %) и печени (5,5%), однако все эти нарушения еще носят функциональный характер и, следовательно, при проведении адекватной терапии имеют обратимый характер.
IV стадия (3-и — 4-е сутки постреанимационного периода) имеет различное течение: либо это период стабилизации и последующего улучшения функций организма с выздоровлением без осложнений; либо период дальнейшего ухудшения состояния больных с нарастанием синdрома полиорганной недостаточности (СПОН) в связи с прогрессированием синдрома системного воспалительного ответа (ССBО). Характеризуется гиперкатаболизмом, развитием интерстициального отека ткани легких а мозга, (углублением гипоксии и гиперкоагуляции с развитием признаков полиорганной недостаточности: кровотечений из органов ЖКТ, психозов с галлюцинаторным синдромом, вторичной сердечной недостаточности, панкреатитов и нарушении функций печени.
V стадия (5–7-е сутки и более постреанимационного периода) развивается только при неблагоприятном течении ПРБ: прогрессирование воспалительных гнойных процессов (массивные пневмонии, нередко абсцедирующие, нагноение ран, перитониты у оперированных больных и пр.), генерализация инфекции — развитие септического синдрома, несмотря на раннее проведение адекватной антибиотикотерапии. На этом этапе развивается новая волна поражения паренхиматозных органов, при этом имеют место уже дегенеративные и деструктивные изменения. Так, в легких развивается фиброз, резко сокращающий дыхательную поверхность, что ведет к необратимости критического состояния.
Принципы интенсивной терапии постреанимационного периода
1. Экстрацеребральный гомеостаз .
1.1. Ранняя оптимизация гемодинамики: поскольку происходит срыв ауторегуляции мозгового кровотока, уровень церебрального перфузионного давления (ЦПД) становится зависимым от уровня среднего артериального давления (САД):
ЦПД = САД – ВЧД.
Поэтому очень важно поддержание нормотензии — САД 70–90 мм рт.ст. Причем выраженные гипотензия и гипертензия должны быть корригированы. ЦВД должно поддерживаться в пределах 8–12 см Н2О;
1.2. Оксигенация: ИВЛ.артериальная гипероксия должна быть исключена, уровень FiO2 должен обеспечивать SaO2 94–96 %, поскольку показано, что проведение ИВЛ с FiO2 1,0 в первый час постреанимационного периода ассоциируется с плохим неврологическим исходом за счет создания дополнительного оксидативного стресса на постишемические нейроны.
1.3. Поддержание нормального уровня РаО2 (нормоксемия) и РаСО2 (нормокапния) — вазоконстрикция, вызванная гипервентиляцией, как и гиповентиляция, вызывающая повышение внутричерепного давления, приводит к усугублению церебральной ишемии; Проведение управляемой гипервентиляции рекомендуется для профилактики развития ацидоза организма (особенно головного мозга) и снижения внутричерепного давления (вследствие уменьшения внутричерепного объема крови). Следует поддерживать напряжение кислорода в артериальной крови на уровне 100 мм рт. ст., напряжение углекислого газа — на уровне 25—35 мм рт.ст.
1.4. Поддержание нормотермии тела. Риск плохого неврологического исхода повышается на каждый градус > 37 °С.
1.5. Поддержание нормогликемии — персистирующая гипергликемия ассоциирована с плохим неврологическим исходом. Пороговый уровень, при достижении которого необходимо начинать коррекцию инсулином, — 10,0 ммоль/л. Гипогликемия также должна быть исключена.
1.6. Поддержание уровня гематокрита в пределах 30–35 % — проведение гемодилюции, обеспечивающей снижение вязкости крови, которая значительно повышается в микроциркуляторном русле как следствие ишемии.
1.7. Контроль судорожной активности введением бензодиазепинов, фентоина, вальпората, а при постоянной эпиактивности — тиопентала натрия.
2. Интрацеребральный гомеостаз. Кортикостероиды. Преднизолон и другие кортикостероиды используется на протяжении первых 2—3 дней посттерминального периода. Эффективность использования кортикостероидов на этом этапе реанимации в ряде исследований подвергается сомнению.,
Растворы глюкозы. В настоящее время не рекомендуется использовать инфузию глюкозы при проведении реанимационных мероприятий в связи с тем, что она поступает в ишемизированную область мозга, где включаясь в анаэробный обмен, расщепляется до молочной кислоты. Локальное накопление в мозговой ткани лактата увеличивает ее повреждение . Более предпочтительно использование физиологического раствора или раствора Рингера.
Уже во время проведения первичного реанимационного комплекса следует применять меры по профилактике повреждений мозга. Обычно с этой целью вводятся оксибутират натрия (2— 4 г), седуксен (20—40 мг), барбитураты (2—5 мг/кг).
Необходимо обеспечить и другие гомеостатические характеристики: водный баланс, электролиты и др. Показано создание легкой гипе-росмолярности плазмы на уровне 320—330 мосмоль/л (норма — 280—290 мосмоль/л). Это достигается использованием осмотически активных препаратов и путем повышения коллоидного давления, используя плазму, протеин, альбумин и т.п. Создание превышающего норму онкотическото и осмотического давления позволяет освободить интерстиций мозга от избытка воды. значение рН крови и поддерживать его в пределах 7, 3—7, 6
2.1. Фармакологические методы. На данный момент отсутствуют эффективные и безопасные с точки зрения доказательной медицины методы фармакологического воздействия на головной мозг в постреанимационном периоде.
2.2. Физические методы. В настоящее время гипотермия является наиболее многообещающим методом нейропротекторной защиты головного мозга.
Согласно современным рекомендациям, всем пациентам без сознания, перенесшим остановку кровообращения, необходимо обеспечить проведение терапевтической гипотермии (ТГ) тела до 32–34 °С в течение 12–24 часов.
В настоящее время рекомендуется выполнение следующих требований к проведению ТГ:
— мониторинг температуры ядра (внутрипищеводной, тимпанитческой, ректальной) и поверхностной температуры, контроль параметров гемостаза, газов крови и электролитов, уровня гликемии и лактата, показателей гемодинамики;
— длительность — 12–24 часа;
— целевая температура ядра 32–34 °С;
— метод — наружное охлаждение при помощи гипотерма или внутривенная инфузия физиологического раствора или раствора Рингера лактат (4 °С) в дозе 30 мл/кг со скоростью введения 100 мл/мин;
— проведение искусственной вентиляции легких;
— для купирования холодовой дрожи — аналгоседация, миорелаксанты, применение вазодилататоров (нитраты);
— медленное согревание — не быстрее 0,2–0,5 °С/ч [20].
