
- •4 Курс 1 занятие 2 семестр
- •Сердечно-легочная реанимация
- •Терминальные состояния
- •Этап с. Поддержание кровообращения
- •Этап f. Электрическая дефибрилляция
- •Фармакологическое обеспечение реанимации
- •Выделяют три типа восстановления неврологического статуса в постаноксическом периоде:
- •Целевые значения, необходимые для достижения в постреанимационном периоде:
- •Поддержание и восстановление внутримозгового гомеостаза
- •Американская Ассоциация сердечных заболеваний по слр и неотложной попощи при сердечно-сосудистых заболеваниях 2010
- •Качество слр
- •Основные задачи на начальном и последующих этапах терапии после остановки сердца
- •Основные цели терапии пациентов с окс
- •Поддержание жизнедеятельности в педиатрии,
- •Реанимационная помощь при клинической смерти.
Фармакологическое обеспечение реанимации
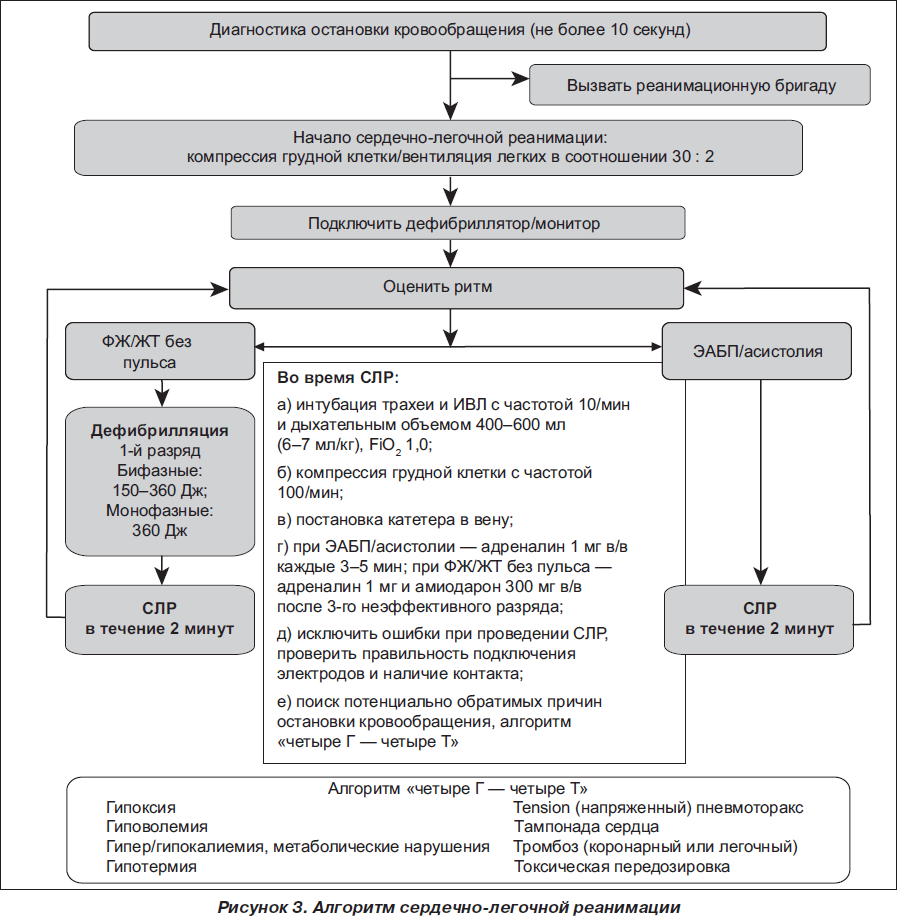
1. Адреналин:
а) при электрической активности без пульса/асистолии — 1 мг каждые 3–5 минут внутривенно;
б) при ФЖ/ЖТ без пульса амиодарон вводится только после третьего неэффективного разряда электрической дефибрилляции. В последующем данная доза вводится каждые 3–5 минут внутривенно (т.е. перед каждой второй дефибрилляцией) столь долго, сколько сохраняется ФЖ/ЖТ без пульса.
2. Амиодарон — антиаритмический препарат первой линии при ФЖ/ЖТ без пульса, рефрактерной к электроимпульсной терапии после 3-го неэффективного разряда, в начальной дозе 300 мг (разведенные в 20 мл физиологического раствора или 5% глюкозы), при необходимости- повторно вводить по 150 мг. После восстановления самостоятельного кровообращения необходимо обеспечить в/в капельное введение амиодарона в дозе 900 мг в первые 24 часа постреанимационного периода с целью профилактики рефибрилляции.
3. Лидокаин — в случае отсутствия амиодарона (при этом он не должен использоваться в качестве дополнения к амиодарону) — начальная доза 100 мг (1– 1,5 мг/кг) в/в, при необходимости дополнительно болюсно по 50 мг (при этом общая доза не должна превышать 3 мг/кг в течение 1 часа).
4. Бикарбонат натрия — рутинное применение в процессе СЛР или после восстановления самостоятельного кровообращения не рекомендуется.
Остановка кровообращения представляет собой комбинацию респираторного и метаболического ацидоза. Оптимальным методом коррекции ацидемии при остановке кровообращения является проведение компрессии грудной клетки, дополнительный положительный эффект обеспечивается проведением вентиляции под контролем рСО2(контроль качества реанимации и нахождения интубационной трубки).
Рутинное введение бикарбоната натрия в процессе СЛР за счет генерации СО2, диффундирующей в клетки, вызывает ряд неблагоприятных эффектов:
— усиление внутриклеточного ацидоза;
— отрицательное инотропное действие на ишемизированный миокард;
— нарушение кровообращения в головном мозге за счет наличия высокоосмолярного натрия;
Показанием к введению бикарбоната натрия являются случаи остановки кровообращения, ассоциированные с гиперкалиемией либо передозировкой трициклических антидепрессантов в дозе 50 ммоль (50 мл — 8,4% раствора) в/в.
5. Хлорид кальция — в дозе 10 мл 10% раствора в/в (6,8 ммоль Сa2+) при гиперкалиемии, гипокальциемии, передозировке блокаторов кальциевых каналов.
Использование атропина при проведении СЛР больше не рекомендуется.
Исследования показали отсутствие эффекта атропина при остановке кровообращения по механизму ЭАБП/асистолии.
Прекращение реанимационных мероприятий
СЛР необходимо проводить так долго, как сохраняется на ЭКГ фибрилляция желудочков, поскольку при этом сохраняется минимальный метаболизм в миокарде, что обеспечивает потенциальную возможность восстановления самостоятельного кровообращения.
В случае остановки кровообращения по механизму асистолии при отсутствии потенциально обратимой причины (согласно алгоритму «четыре Г — четыре Т») СЛР проводят в течение 30 минут, а при ее неэффективности прекращают.
СЛР более 30 минут проводят в случаях гипотермии, утопления в ледяной воде и передозировке лекарственных препаратов.
Для базовой реанимации взрослых с остановкой сердца вне медицинского учреждения было сформулировано «правило прекращения реанимации», которое допускает прекращение основных мероприятий по поддержанию жизнедеятельности до прибытия машины скорой помощи при наличии всех перечисленных ниже критериев:
• Работник службы скорой медицинской помощи или лицо, оказывающее первую медицинскую помощь, не присутствовали при остановке сердца.
• Спонтанное кровообращение не восстановлено после трех полных
циклов СЛР и применения АНД.
Время прекращения реанимационных мероприятий фиксируется как время смерти пациента.
Стадия III — длительное поддержание жизни. Заключается в послереанимационной интенсивной терапии, которая проводится в РАО и включает этапы:
G (gauging) — оценка состояния;
Н (human mentation) восстановление сознания;
I — коррекция недостаточности функций органов.
Для постреанимационной болезни характерна своя особая этиология —сочетание глобальной ишемии(аноксии) с реперфузией(гиперемия), что вызывает каскад новых патологических изменений в органах и системах и прежде всего в ц.н.с. и сердце. Возможны:переломы грудины,ребер,повреждения легких, печени, кровотечения, аспирационный синдром. Все это наслаивается на причинное заболевание и усугубляет тяжесть состояния больного. Причины смерти в постреанимационном периоде: 1/3 — кардиальные (наиболее высок риск в первые 24 часа постреанимационного периода), 1/3 — дисфункция различных экстрацеребральных органов и 1/3 — неврологические (являются причиной смерти в отдаленном периоде ПРБ) ,характерен очень высокий уровень летальности, достигающий 80 % в течение 6 месяцев постреанимационного периода. Ни одна клетка организма так не зависит от уровня кислорода и глюкозы, как нейрон. Максимальный период времени клинической смерти (то есть аноксии) в условиях нормотермии, при котором возможно переживание нейронов, составляет не более 5 минут, поскольку в течение этого промежутка времени происходит полное потребление запасов глюкозы и АТФ головным мозгом, с последующим прекращением функционирования Na+-K+-АТФаз мембран клеток. Дисфункция этих систем приводит к нарушению ионного гомеостаза и последующему запуску трех основных механизмов аноксического повреждения клеток головного мозга: свободнорадикального, кальцийзависимого и фосфолипазного. Эти механизмы по мере своей реализации в конечном итоге приводят к гибели клеток мозга путем некроза или апоптоза.
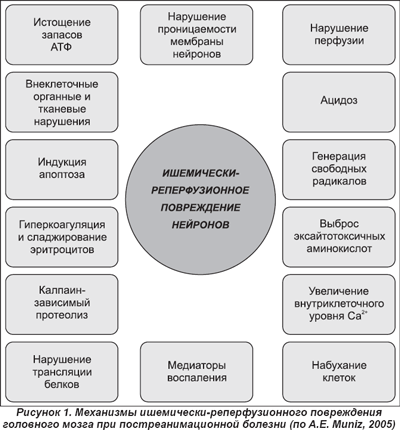
Активация анаэробного гликолиза вызывает повышение уровня неорганического фосфата, лактата и ионов Н+. Далее отмечается нарушение механизмов активного транспорта, деполяризация клеточных мембран и неуправляемый ток ионов Са2+ в цитозоль. Повышение активности ионов Са2+внутри клетки создает перегрузку митохондрий с разобщением окислительного фосфорилирования и усилением катаболических процессов. Цитотоксичность свойственна и возбуждающим аминоацидергическим нейротрансмиттерам (глутамату, аспартату), что получило название «эксайтотоксической смерти нейронов». Вовлекаются в патологический процесс зоны, менее пострадавшие от недостатка перфузии («принцип домино»). К этому присоединяют механизмы перекисного окисления, цитокиновых реакций, клеточной макрофагальной инфильтрации, нарушается реологический баланс, страдает регуляция сосудистого тонуса. В постреанимационном периоде гипергликемия приводит к более длительному неполному восстановлению рН ткани мозга и выраженному невосстановлению АТФ и креатинфосфата.
