
- •Введение
- •Лабораторная работа №1 Основные элементы работы в Excel
- •Лабораторная работа №2 Построение графиков и диаграмм
- •Лабораторная работа №3 Вычисление определенных интегралов
- •Лабораторная работа №4 Решение систем линейных уравнений
- •Лабораторная работа №5 Обработка экспериментальных данных
- •Лабораторная работа №6 Решение обыкновенных дифференциальных уравнений и систем обыкновенных дифференциальных уравнений
- •Лабораторная работа №7 Решение уравнений в частных производных методом сеток.
- •Литература
- •Оглавление
Лабораторная работа №6 Решение обыкновенных дифференциальных уравнений и систем обыкновенных дифференциальных уравнений
Задание.
1. Решить задачу Коши для уравнения y’ = f ( x, y ).
2. Решить задачу Коши для уравнения y” = f ( x, y, y’ ).
3. Составить кинетическую модель и найти концентрации компонентов данной химической реакции для заданного промежутка времени.
Пример 6. 1.
Найти решение дифференциального уравнения dy / dx = 2y + e x - x , удовлетворяющее начальному условию y ( 0 ) = 0,25, на отрезке 0; 1, представив результат не менее, чем десятью точками. Решение найти методом Эйлера и методом Рунге-Кутта четвертого порядка. Сравнить полученные результаты с точным решением, имеющим следующий вид: y ( x ) = e 2x - e x + x/2 + 0,25. Построить графики точного и приближенного решений.
Выполнение работы.
Алгоритм метода Эйлера для решения обыкновенного дифференциального уравнения первого порядка y ’ = f (x, y ) на отрезке x x 0, x max с начальным условием y ( x 0 ) = y 0 задается рекуррентной формулой
y k+1 = y k + h* f ( x k , y k ) , ( 8 )
где x k = x 0 + h*k, k = 0, 1, 2, ... , N - 1 ,
N - число интервалов, на которые разбивается отрезок x 0, x max
h - шаг интегрирования, h = (x max - x 0 ) / N .
Алгоритм метода Рунге-Кутта задается рекуррентной формулой
y k+1 = y k + ( m 1 + 2m 2 + 2m 3 + m 4 )*h /6 , ( 9 )
где m 1 = f ( x k , y k ) ,
m 2 = f (x k + h/2, y k + m 1*h/2 ) ,
m 3 = f ( x k + h/2, y k + m 2*h/2 ),
m 4 = f (x k + h, y k + m 3*h ) .
Примем N = 10. Тогда h = 0,1.
1. Введем в первую строку названия столбцов. В столбце А у нас будут находиться значения x; в столбце В - значения y, вычисленные по формуле Эйлера; в столбце С - точные значения y; в столбцах D - G - значения m1, m2, m3, m4; в столбце H - значения y, вычисленные по методу Рунге-Кутта четвертого порядка.
2. В ячейку I1 введем значение шага “0,1” и присвоим ей имя h. Для этого выделим ячейку I1 и выполним команду Вставка/Имя/Определить. В диалоговом окне Определить имя введем имя “h”.
3. В ячейку A2 введем начальное значение x, т.е. число 0; в ячейки B2, C2, H2 - начальное значение y, т.е. число 0,25.
4. В ячейки A3:H3 введем следующие формулы:
в ячейку A3 =A2+h ;
в ячейку B3 =B2+h*(2*B2+EXP(A2)-A2) ;
в ячейку C3 =EXP(2*A3)-EXP(A3)+A3/2+0,25 ;
в ячейку D3 =2*H2+EXP(A2)-A2 ;
в ячейку E3 =2*(H2+D3*h/2)+EXP(A2+h/2)-A2-h/2 ;
в ячейку F3 =2*(H2+E3*h/2)+EXP(A2+h/2)-A2-h/2 ;
в ячейку G3 =2*(H2+F3*h)+EXP(A2+h)-A2-h ;
в ячейку H3 =H2+(D3+2*E3+2*F3+G3)*h/6 .
5. Выделим интервал A3:H3, поставим курсор на маркер заполнения ячейки H3 и распространим формулы, введенные в третью строку, до двенадцатой строки включительно. Полученная таблица ( см. рис. 21 ) содержит искомые приближенные и точное решения.
Рис. 21. Решение уравнения dy/dx = 2y + ex - x.
6. Как видно из таблицы на рис.21, решение, полученное по методу Рунге-Кутта четвертого порядка, практически совпадает с точным решением. Поэтому графики построим только для точного решения и решения по методу Эйлера ( см. рис. 22).
Рис. 22. Графики точного решения и решения, полученного
по методу Эйлера, для уравнения dy/dx = 2y + ex - x.
Пример 6.2. k 1 k 2
С
 оставить
кинетическую модель химической реакции
A B C .
оставить
кинетическую модель химической реакции
A B C .
Решить методом Эйлера полученную систему дифференциальных уравнений для промежутка времени t = 0; 3 с шагом 0,2, если начальные концентрации компонентов СA ( 0 ) = 1, CB (0 ) = CC (0 ) = 0, константы скоростей k 1 = 0,6; k 2 =0,8. Построить графики кинетических кривых.
Выполнение работы.
Кинетическая модель данной химической реакции представляется следующей системой уравнений 10 :
dCA / dt = - k 1 * CA
dCB / dt = k 1 * CA - k 2 * CB
dCC / dt = k 2 * CB
1. Введем в первую строку названия столбцов. В столбце А у нас будут находиться значения времени, в столбцах B, C, D - значения концентраций компонентов A, B, C, соответственно.
2. В ячейку Е1 введем значение шага “0,2” и присвоим ей имя h.
3. Введем в ячейки A2:D2 начальные значения времени и концентраций компонентов реакции.
4. В ячейки A3:D3 введем следующие формулы:
в ячейку А3 =A2+h ;
в ячейку В3 =$B2+h*(-0,6*$B2) ;
в ячейку С3 =$C2+h*(0,6*$B2-0,8*$C2) ;
в ячейку D3 =$D2+h*(0,8*$C2)
5. Выделим интервал A3:D3 и распространим формулы, введенные в третью строку, до семнадцатой строки включительно.
6. Построим диаграмму типа График, в которой, используя блок ячеек A1:D17, отобразим зависимости концентраций компонентов реакции от времени. Отформатируем диаграмму.
Результирующая таблица и графики кинетических кривых приведены на рис.23.
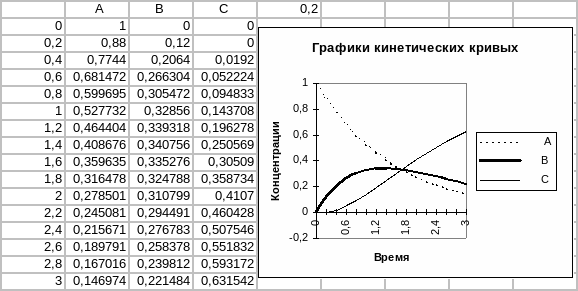
Рис. 23. Исследование кинетики химической реакции.
