
Лабораторная работа №4 / LABA4H
.DOCГОСУДАРСТВЕННЫЙ КОМИТЕТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПО ВЫСШЕМУ ОБРАЗОВАНИЮ
САНКТ-ПЕТЕРБУРЖСКАЯ АКАДЕМИЯ АЭРОКОСМИЧЕСКОГО ПРИБОРОСТРОЕНИЯ
Кафедра технологии конструкционных материалов
Отчет защищен
Преподаватель
Отчет
о лабораторной работе № 1
по курсу "Химия"
СКОРОСТЬ РЕАКЦИИ В РАСТВОРАХ РЕАКЦИИ
Х.77.22.02.3.ЛР4
Работу выполнил
студент группы 348
Санкт-Петербург 1994
- 2 -
1. ЦЕЛЬ РАБОТЫ
Изучение влияния на скорость химической реакции концентрации реагирующих веществ и температуры.
2. MEТОД ИСПЫТАНИЯ
2.1. ОПЫТ № 1
В три пробирки отмерить по 5 мл раствора тиосульфата натрия: в первую с концентрацией 0.2Н, во вторую - 0.1Н, в третью - 0.05Н. Затем поочередно в каждую пробирку прилить по 10мл 0.1Н раствора серной кислоты. Отметить время от моиента смешения растворов до появления опалсценции.
2.2. ОПЫТ № 2
В четыре пробирки отмерить по 5 мл раствора тиосульфата натрия, а в четыре другие пробирки отмерить по 5 мл 0.1Н раствора серной кислоты. Все пробирки поместить в термостат и при изменении температуры на каждые 100 слливать две из них.
2.3. МАТЕРИАЛЫ И РЕАКТИВЫ
2.3.1.Термостат, термометры, мерные циллиндры, пробирки, секундомер.
2.3.2. Растворы Na2S2O3 и H2SO4
3. РЕЗУЛЬТАТЫ
Результаты эксперимента приведены в Таблице № 1 и Таблице № 1.
4. ОБРАБОТКА РЕЗУЛЬТАТОВ
4.1.
Относительная скорость реакции рассчитывается по формуле:
V = 1/T
Константа скорости реакции рассчитывается по формуле:
![]()
K=VT
Kонстанта скорости также определяется графически ( рис. № 1 ).
Температурный коэффициент для каждого температурного интервала определяется по формуле:
![]()
Аналитическое значение энергии активации для каждого температурного интервала определяется по формуле:

где T1,T2 - конечная и начальная температуры для данного интервала.
4.2. ВЫЧИСЛЕНИЕ
4.2.1. Для опыта № 1.
K =
![]()
4.2.2. Для опыта № 2.
0.02/0.01 = j1 = 2
j1 = 2 ; j2 = 2.25 ; j3 = 2.2 ; jср. = 2.15
4.2.3.
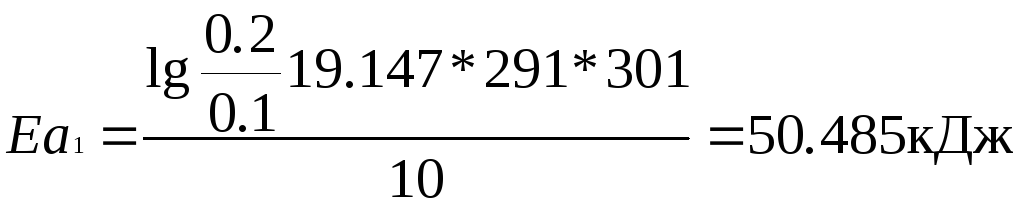
![]() = 63.124кДж
= 63.124кДж
![]() = 65.453кДж
= 65.453кДж
![]() = 59.687кДж
= 59.687кДж
- 3 -
5. ВЫВОД
После проведения расчетов по первому эксперименту можно сказать, что скорость реакции линейно зависит от концентрации. Из графика видно, что чем меньше концентрация тем меньше скорость реакции. Константа скорости полученная графически равна 0.31, а полученная аналитически 0.30.Это говорит о достаточно большой точности опыта.
Значение
![]() полученное графически равно 59.561кДж, а
полученное аналитически 59.687кДж.
полученное графически равно 59.561кДж, а
полученное аналитически 59.687кДж.
6. СПИСОК ЛИТЕРАТУРЫ
1. Кораблева А. А. "Методические указания к выполнению лабораторных работ"
2. Глинка Н. Л. "Общая химия"
Таблица № 1.
Результаты эксперимента
|
Номер опыта
|
Концентрация тиосульфата |
Время реакции ( с )
|
Относительная скорость реакции
|
Константа скорости реакции
|
|
1 |
0.2 |
17 |
0.06 |
0.3 |
|
1 |
0.1 |
37 |
0.03 |
0.3 |
|
3
|
0.05 |
79 |
0.01 |
0.26 |
Таблица № 2.
|
Номер опыта
|
Температура опыта t0 C |
Время реакции ( с )
|
Относительная скорость реакции
|
Константа скорости реакции
|
|
1 |
18 |
102 |
0.01 |
0.1 |
|
1 |
28 |
50 |
0.02 |
0.2 |
|
3 |
38 |
22 |
0.045 |
0.45 |
|
4
|
48 |
10 |
0.1 |
1 |
