
Курсовой расчет / Liza / Кур.Л
.docГосударственный комитет РФ по высшему образованию
Санкт-Петербургский Государственный Электротехнический
Университет им. В.И. Ульянова (Ленина)
Курсовая работа по Физ.Хим.МиЭЭТ:
Расчет газотранспортных и диффузионных процессов в технологии электронных приборов
Студентка группы 2211: Бескова Е.А.
Проверил: Зубко С.П.
Санкт-Петербург
2005г.
Общие сведения
Газотранспортные химические реакции широко применяются в современной полупроводниковой технологии для эпитаксиального выращивания монокристаллических слоев с высокой степенью структурного и электрофизического совершенства. Для этой цели в газовый поток, создаваемый газом-носителем (каковым часто является водород), вводится так называемый транспортный агент. Его основная функция – осуществлять травление полупроводникового материала с образованием газообразных продуктов реакции, переносимых потоком (конвекционным или диффузионным) из зоны травления в зону осаждения.
Для GaP роль транспортного агента могут выполнять пары воды H2O. Основной газотранспортной реакцией при этом является реакция с образованием летучего окисла Ga2О:
2GaP(т)+
H2O(г)![]()
![]() Ga2О(г)+P2(г)+H2(г)
(1)
Ga2О(г)+P2(г)+H2(г)
(1)
В изучаемой системе наряду с основной газотранспортной реакцией (1) возможно протекание конкурирующих реакций, препятствующих транспорту арсенида фосфора в газовой фазе с помощью паров воды. Это происходит вследствие связывания галлия в форме новой конденсированной фазы. Такими фазами являются твердый окисел Ga2О3(т) и жидкий галлий Gа (ж), образующиесяпо ракциям:
2GaP(т)+3H2O(г)
![]() Ga2О3(т)+
P2(г)+3H2(г)
(2)
Ga2О3(т)+
P2(г)+3H2(г)
(2)
2GaP(т)
![]()
![]() 2Ga(ж)+
P2(г)
(3)
2Ga(ж)+
P2(г)
(3)
Возможность осуществления кристаллизации GaР в соответствии с газотранспортной реакцией (1) при условии подавления конкурирующих реакций (2) и (3) оценивают по составу газовой фазы. Подавление конкурирующих реакций имеет место при условии, если их изобарный потенциал положителен. В этом случае реакции (2) и (3) смещены влево, так что образование твердого окисла Ga2О3(т) и жидкого галлия Gа (ж) не происходит.
Первым этапом анализ является определение температурного хода констант химического равновесия для реакций (1)-(3) на основании таблиц стандартных термодинамических таблиц.
1.Химическое осаждение арсенида галлия из газовой фазы в системе GaP – H2O – H2
|
Молекулярная формула |
dH0f , кДж/моль |
dS0 , Дж/моль |
||||
|
Крист |
Жид |
Газ |
Крист |
Жид |
Газ |
|
|
H2 |
|
|
0 |
|
|
130,7 |
|
H2O |
|
-285,8 |
-241,8 |
|
70 |
188,8 |
|
GaP |
-88 |
|
|
|
|
15,2 |
|
Ga2O |
-356 |
|
|
|
|
|
|
Ga2O3 |
-1089,1 |
|
|
85 |
|
|
|
Ga |
0 |
5,6 |
272 |
40,8 |
|
169 |
|
P2 |
|
|
144 |
|
|
218,1 |
![]()
![]()
но
мы работаем в первом приближении, т. е.:
![]() ,
а это значит:
,
а это значит:
![]() и
и
![]()
1 реакция
![]()
![]()
![]()
![]()
![]()
2 реакция
![]()
![]()
![]()
![]()
![]()
3 реакция
![]()
![]()
![]()
![]()
![]()
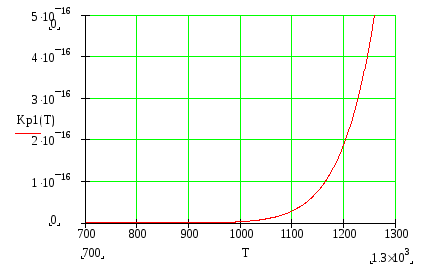
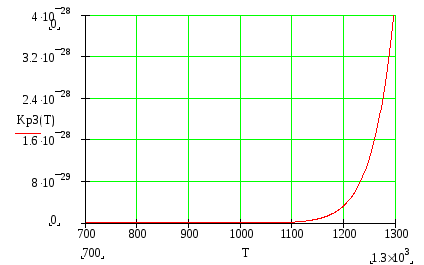
2. Расчет и построение зависимостей констант равновесия от температуры для трех реакций:Kp1(T), Kp2(T), Kp3(T):
![]()
![]()
![]()

3. Расчет степени превращения α(Т,а):
Функциональная
зависимость α=f(Т,а)
при
![]() имеет вид:
имеет вид:
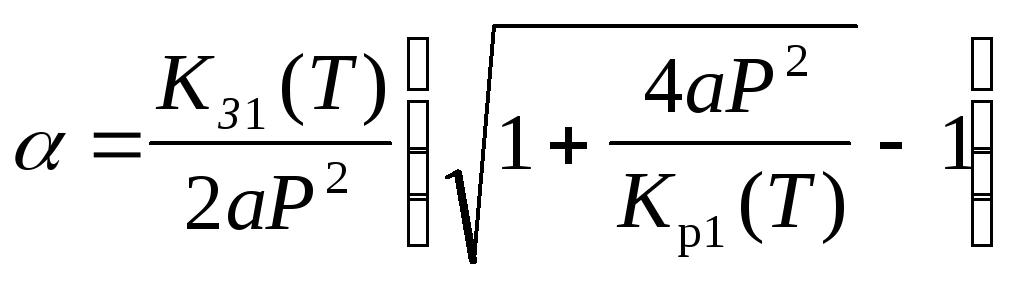
Где
![]() -относительная
влажность водорода
-относительная
влажность водорода

4. Расчет зависимостей РН2О(Т,а), РGa2O(Т,а), РР2(Т,а):
Суммарное давление в системе: Р∑= РН2+РН2О +РGa2O+РР2
На вход системы подается в качестве газа-носителя водород под давлением РН2, насыщенный парами воды с парциальным давлением РН2О путем пропускания через специальный сосуд с водой, называемый барботером. Величина РН2О регулируется при помощи температуры барботера и измеряется точкой росы увлажненного водорода. Относительная влажность водорода задается параметром
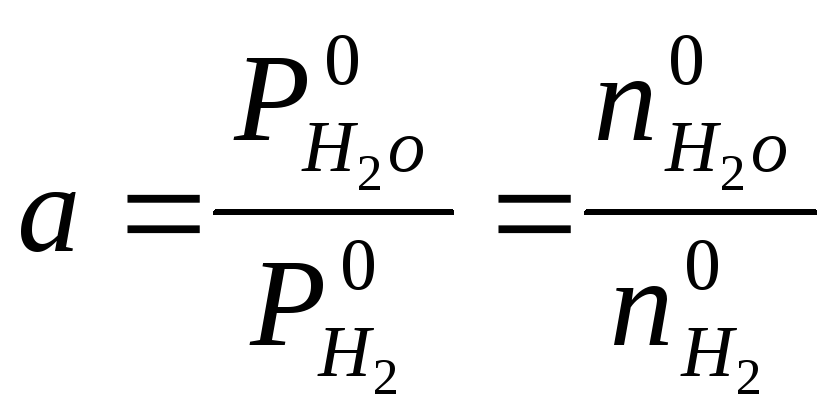 ,
,
где
![]() и
и
![]() -
число молей воды и водорода, вводимых
в систему.
-
число молей воды и водорода, вводимых
в систему.
Пусть
по реакции (1) вступило во взаимодействие
с арсенидом фосфора α
![]() молей паров воды. Тогда в соответствии
со стехиометрией реакции равновесное
число молей в системе таково:
молей паров воды. Тогда в соответствии
со стехиометрией реакции равновесное
число молей в системе таково:
![]()
![]()
![]()
![]()
Полное число молей записывается как
![]()
Отсюда полное давление каждого компонента равняется:
![]()
![]()
![]()
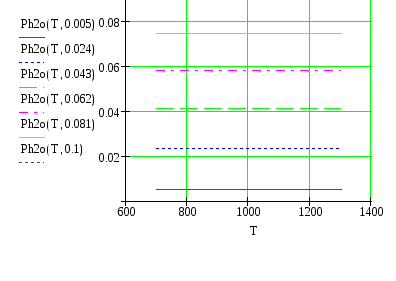

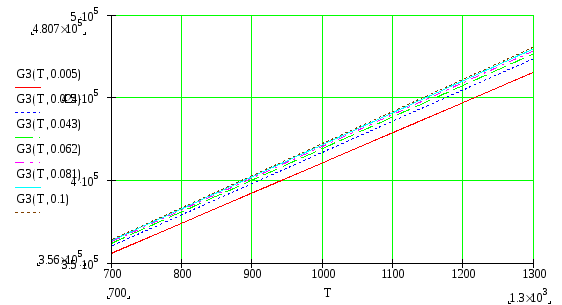
5. Расчет температурных зависимостей ΔG2(Т,а) и ΔG3(Т,а) для заданных а
Для термодинамической оценки возможности подавления конкурирующих реакций необходимо рассчитать их изобарный потенциал ΔG для давлений в системе, полученных из расчета состава газовой фазы, созданного основной реакцией (1). Такую газовую фазу принято называть стехиометрической. Уравнение Вант-Гофа для конкурирующих реакций принимает следующий вид:
а) для реакции (2)


б) для реакции (3)
![]()
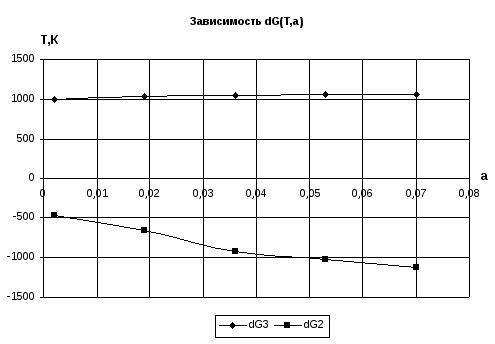
6.Определение область стехиометричности газовой фазы:
Решение уравнений ΔG2(Т,а)=0 и ΔG3(Т,а)=0, описывающих равновесие реакций (2) и (3), дает на плоскости Т-а две линии, ограничивающие область, где протекает основная реакция (1) и подавлены конкурирующие реакции. Эта область называется областью стехиометричности газовой фазы. Внутренние точки этой области соответствуют оптимальным режимам проведения эпитаксиального процесса выращивания арсенида фосфора в системе GaP-H2O-H2.
7.Диффузионное легирование полупроводников.
-
Построение зависимости коэффициента диффузии от температуры
Коэффициент диффузии D выражается в соответствии с законом Аррениуса:
![]() ,
,
где k – постоянная Больцмана; D0, Ea – постоянные значения коэффициента диффузии при стандартной температуре и энергия активации.
P:
![]()
![]()
![]()
B:
![]()
![]()
![]()


-
Расчет профиля распределения концентрации в p-n-p-структуре
![]()
![]()
![]()
Распределение примесей:

![]()

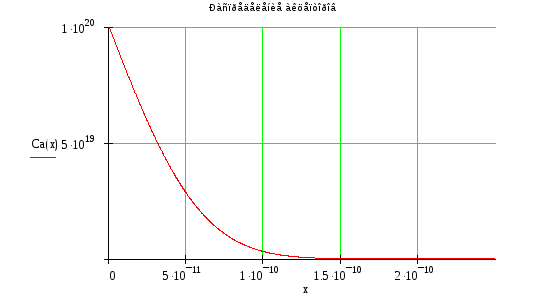
Общее распределение примесей:
![]()
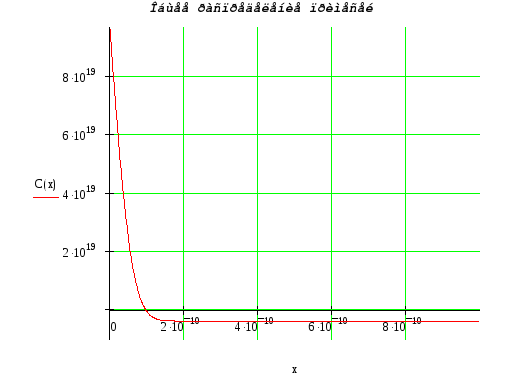
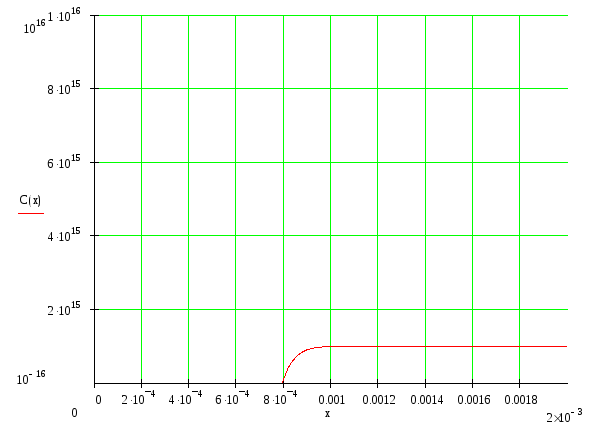
Получили глубины
залегания:
![]()
-
Расчет профиля распределения концентрации в p-n-p-структуре
![]()
![]()
![]()
Распределение примесей:

![]()
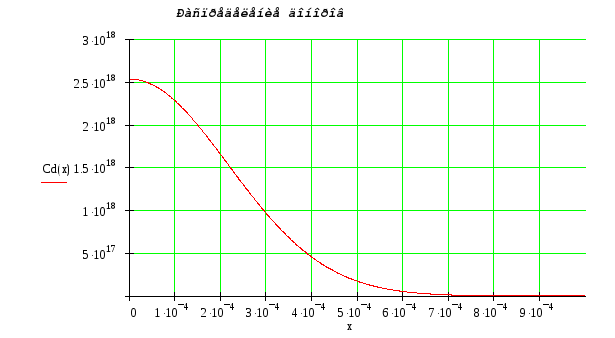
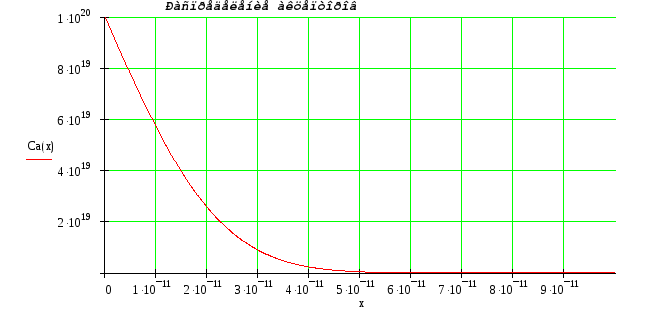
Общее распределение примесей:
![]()
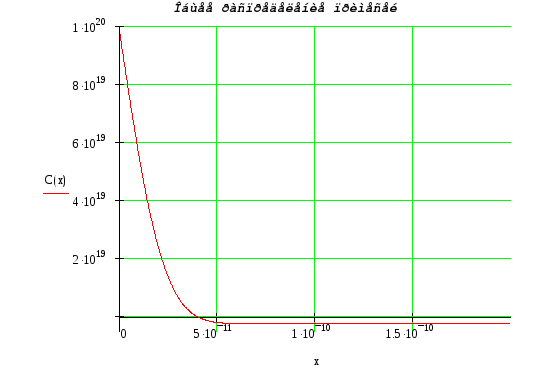
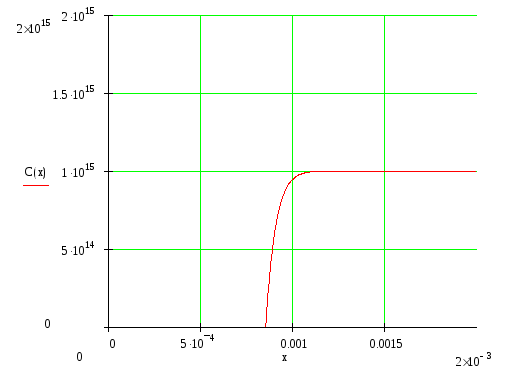
Получили глубины
залегания:
![]()
Список литературы
-
Барыбин А.А., Сидоров В.Г. Физико-технологические основы электроники. СПб.: Издательство «Лань», 2001. – 272 с.
-
Китель Ч. Введение в физику твердого тела. /Пер. с англ. М.: «Мир», 1980. – 420 с.
-
Крапухин В.В., Соколов И.А., Кузнецов Г.Д. Теория процессов полу-проводниковой технологии. Электронные и микроэлектронные материалы и компоненты твердотельной электроники. М.: МИСИС, 1995. 493 с
-
Курносов А.И., Юдин В.В. Технология производства полупроводниковых приборов и интегральных микросхем. M.: «Высш. шк.», 1986. – 368 с.
-
Свойства неорганических соединений. Справочник / Ефимов А.И. и др. Л.: «Химия», 1983 392 с.
-
Технология и аппаратура газовой эпитаксии кремния и германия / Скворцов И.М., Лапидус И.И., Орион Б.В. М.: Энергия, 1978. 136 с.
-
Угай Я.А. Введение в химию полупроводников. M.: «Высш. шк.», 1975. – 302 с.
