- •1. Газотранспортные химические реакции в системе GaAs – h2o –h2
- •2. Расчет констант химического равновесия
- •3. Расчет состава газовой фазы
- •4. Область стехиометричности газовой фазы
- •1.Расчет и построение зависимости коэффициента диффузии от температуры:
- •2.Определение профиля легирующей примеси для каждого этапа диффузии и глубины p-n перехода:
ХИМИЧЕСКОЕ ОСАЖДЕНИЕ ИЗ ГАЗОВОЙ ФАЗЫ
1. Газотранспортные химические реакции в системе GaAs – h2o –h2
Термодинамические данные системы GaAs – H2O – H2
|
Функции |
T, K |
Вещество (состояние) | |||||||
|
Н2 (г) |
Н2О (г) |
As2 (г) |
As4 (г) |
Ga2O (г) |
Ga2O3 (т) |
Ga (ж) |
GaAs (т) | ||
|
ФТ ,
|
700 |
33,15 |
27,41 |
59,60 |
80,34 |
73,03 |
25,63 |
19,90 |
16,27 |
|
800 |
33,72 |
48,09 |
60,29 |
81,88 |
74,07 |
27,38 |
20,79 |
16,76 | |
|
900 |
34,25 |
48,75 |
60,95 |
83,34 |
75,08 |
29,07 |
21,57, |
17,20 | |
|
1000 |
34,76 |
49,38 |
61,58 |
84,76 |
76,04 |
30,71 |
22,27 |
17,65 | |
|
1100 |
35,24 |
49,99 |
62,17 |
86,11 |
76,96 |
32,30 |
22,90 |
18,10 | |
|
1200 |
35,69 |
50,58 |
62,74 |
87,35 |
77,83 |
33,82 |
23,48 |
18,43 | |
|
1300 |
36,13 |
51,14 |
63,28 |
88,36 |
78,66 |
35,24 |
24,01 |
18,88 | |
|
|
298 |
0 |
57,8 |
48,0 |
34,5 |
19,7 |
240 |
1,34 |
17,7 |
Для арсенида галлия GaAs роль транспортного агента могут выполнять пары воды H2O. Основной газотранспортной реакцией при этом является следующая реакция с образованием летучего окисла Ga2О :
![]() (1.1)
(1.1)
Закон действующих масс для этой реакции имеет вид:
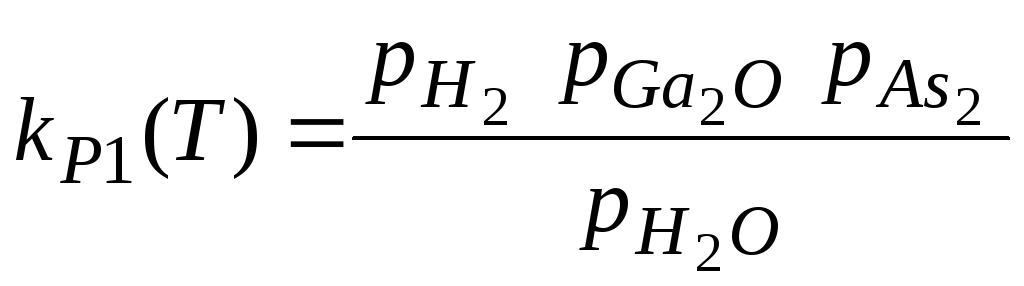 (1.2)
(1.2)
Обычно процесс проводится в открытой проточной системе, при атмосферном суммарном давлении.
Парциальное
давление паров воды
![]() определяется точкой росы – давлением
насыщенного пара. Относительная влажность
вводимого в систему водорода можно
выразить следующим параметром:
определяется точкой росы – давлением
насыщенного пара. Относительная влажность
вводимого в систему водорода можно
выразить следующим параметром:
 , (1.3)
, (1.3)
где
![]() и
и![]()
число молей водорода и паров воды,
подаваемых на вход реактора, и которые
определяются исходными парциальными
давлениями.
число молей водорода и паров воды,
подаваемых на вход реактора, и которые
определяются исходными парциальными
давлениями.
В изучаемой системе, наряду с основной газотранспортной реакцией (1.1), возможно протекание конкурирующих реакций, препятствующих транспорту арсенида галлия в газовой фазе с помощью паров воды. Это происходит вследствие "связывания" галлия в форме новой конденсированной фазы. Такими фазами являются нелетучий окисел Ga2O3 и жидкий галлий Ga. Следовательно, конкурирующие реакции имеют вид:
![]() ;
;
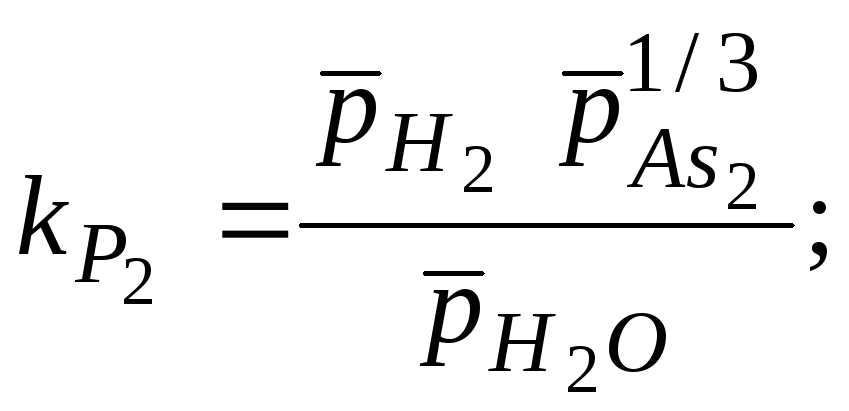 (1.4)
(1.4)
![]() ;
;
![]() . (1.5)
. (1.5)
Конкурирующие реакции подавляются, если их изобарный потенциал, вычисленный по уравнению изотермы Вант-Гоффа (1.19) имеет положительный знак (G > 0). В этом случае реакции (1.4) и (1.5) смещены влево, так что образование твердого окисла Ga2O3 не происходит. Начальным этапом термодинамического анализа является определение температурного хода констант равновесия.
2. Расчет констант химического равновесия
В
справочной литературе часто
термодинамические величины приводятся
в связи с их абсолютными значениями,
![]() , полученными на основе спектроскопических
данных. В частности, используется
функция:
, полученными на основе спектроскопических
данных. В частности, используется
функция:
![]() ,
,
Термодинамический
потенциал ФТ
позволяет записать стандартный изобарный
потенциал реакции
![]() в
следующем виде:
в
следующем виде:
![]() . (1.6)
. (1.6)
Константа
химического равновесия kp(T)
связана с величиной
![]() аналогичным
соотношением (1.8), и с учетом (2.6) получаем
аналогичным
соотношением (1.8), и с учетом (2.6) получаем
![]() . (1.7)
. (1.7)
Стандартная
теплота реакции
![]() вычисляется,
как и ранее, по формуле (1.12), а величинаФТ
– по общему правилу:
вычисляется,
как и ранее, по формуле (1.12), а величинаФТ
– по общему правилу:
![]() , (1.8)
, (1.8)
|
|
T, K |
1 реакция |
2 реакция |
3 реакция |
|
DФ |
700 |
105,83 |
23,30333 |
66,86 |
|
800 |
86,47 |
3,68 |
68,35 | |
|
900 |
87,13 |
4,04 |
69,69 | |
|
1000 |
87,7 |
4,376667 |
70,82 | |
|
1100 |
88,18 |
4,673333 |
71,77 | |
|
1200 |
88,82 |
5,01 |
72,84 | |
|
1300 |
89,17 |
5,243333 |
73,54 | |
|
DH |
298 |
121,5 |
5,6 |
86,08 |
|
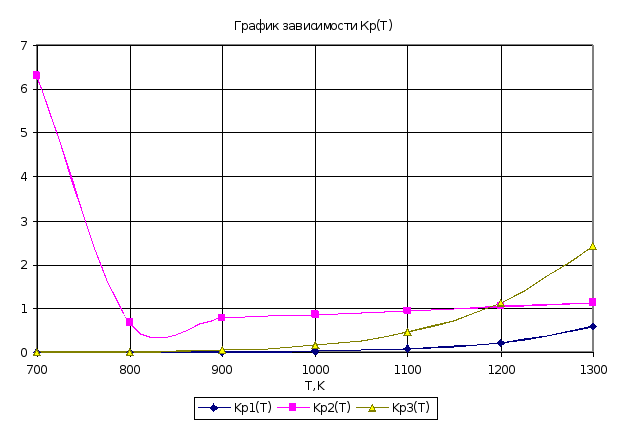
T, K |
Kp1(T) |
Kp2(T) |
Kp3(T) |
|
700 |
0,000288217 |
6,306346 |
0,001168 |
|
800 |
0,000381791 |
0,670643 |
0,008886 |
|
900 |
0,003149444 |
0,769048 |
0,044013 |
|
1000 |
0,017122041 |
0,863111 |
0,159399 |
|
1100 |
0,068532259 |
0,950992 |
0,458255 |
|
1200 |
0,22407192 |
1,042181 |
1,142447 |
|
1300 |
0,596646409 |
1,119175 |
2,41433 |