- •Опыты по клонированию амфибий
- •Опыты Бриггса и Кинга по пересадке ядер у леопардовой лягушки (Rana pipiens)
- •Опыты Джона Гердона по пересадке ядер у шпорцевой лягушки (Xenopus laevis)
- •Клонирование и тотипотентность клеток растений
- •Генетический полиморфизм
- •Дифференцировка лимфоцитов. Формирование генов легких и тяжелых цепей антител (иммуноглобулинов) у позвоночных
- •Инактивация х-хромосомы у млекопитающих
- •Селективная транскрипция генов
- •Хромосомные пуфы и хромосомы типа ламповых щеток
- •Транскрипция глобиновых генов
- •Механизмы дифференциальной транскрипции генов
- •Транскрипция генов легких цепей иммуноглобулинов
- •Регуляция экспрессии генов на уровне процессинга рнк
- •Образование альтернативных белков на одном гене: дифференциальный процессинг рнк в иммунной системе
- •Дифференциальный процессинг рнк: генерация новых белков в разных клетках в разное время
- •Регуляция экспрессии генов на уровне трансляции
- •Контроль на уровне трансляции при координированном синтезе белка: продукция гемоглобина
- •Селективная деградация мРнк
- •Посттрансляционная регуляция экспрессии генов
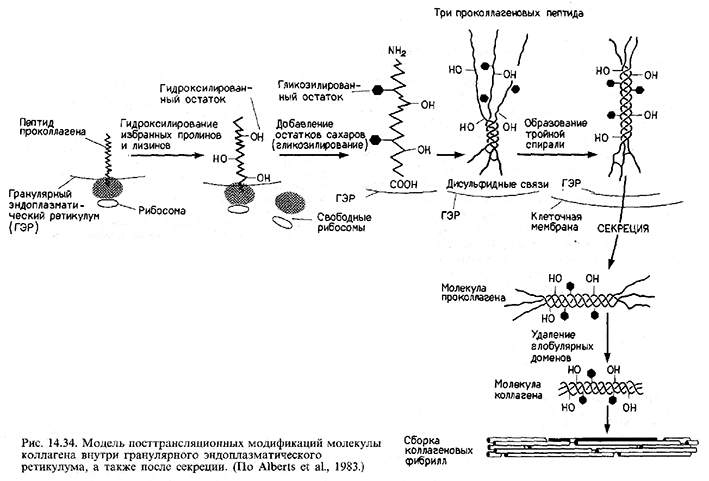
- •Коллаген: конспект посттрансляционной регуляции
Селективная деградация мРнк
Другой механизм трансляционной регуляции касается типов мРНК с различной продолжительностью жизни. Для стабильной мРНК, такой, как бета-глобиновая, время полужизни составляет около 17 ч, для молекул же мРНК разнообразных факторов роста время полужизни составляет меньше 30 мин. Способность к дифференциальной деградации различных мРНК имеет критическое значение для клеточных функций. Например, ген c-fos кодирует ядерный белок, необходимый для деления нормальных фибробластов. Подобно мРНК фактора роста КСФ-г,м, мРНК для c-fos имеет протяженную З'-нетранслируемую область, богатую АУ-последовательностями. Если эта область делетирована, то время полужизни соответствующей мРНК увеличивается. Следовательно, производится больше белка c-fos и клетка непрерывно стимулируется к делению. В результате возникает опухоль из клеток, в которых мРНК гена c-foc лишена АУ-богатой З'-области.
Посттрансляционная регуляция экспрессии генов
После того как белок синтезирован, он встраивается в структуры более высокого уровня организации. Он может стать частью цитоскелета или включиться в один из множества ферментативных путей синтеза и распада клеточных метаболитов. В любом случае индивидуальный белок является теперь частью сложной «экосистемы», которая интегрирует его во взаимоотношения с многочисленными другими белками. Поэтому нам не уйти от проблемы регуляции экспрессии генов и после того, как белок синтезирован, ввиду некоторых изменений, которые могут еще произойти.
Во-первых, некоторые новосинтезированные белки не активны без последующих модификаций. Эти модификации могут заключаться в отщеплении определенных ингибиторных доменов белка или в присоединении небольших компонентов для увеличения активности белка.
Во-вторых, некоторые белки могут избирательно инактивироваться. Иногда инактивация может осуществляться с помощью присоединения ингибиторного лиганда.
В-третьих, некоторые белки должны быть «адресованы» в свои специфические внутриклеточные компартменты. Клетка не просто мешок с ферментами; обычно белки локализуются в определенных областях, таких, как мембраны, лизосомы или митохондрии.
В-четвертых, некоторым белкам необходимо объединиться с другими белками, чтобы образовать функциональное целое. Гемоглобин, микротрубочки и рибосомы - все это примеры объединения многочисленных белков, чтобы сформировать функциональный комплекс. Следовательно, на экспрессию генетической информации можно влиять также и на посттрансляционном уровне.
Коллаген: конспект посттрансляционной регуляции
При рассмотрении синтеза коллагена, одного из главнейших структурных белков тела, мы можем показать важность и разнообразие механизмов посттрансляционного контроля.
Во-первых, последовательность мРНК коллагена транслируется в пептид проколлагена. Аминоконец проколлагена содержит сигнальную последовательность, которая позволяет ему войти в полость гранулярного эндоплазматического ретикулума. Этот сигнальный пептид отщепляется от остальной части молекулы коллагена. Внутри эндоплазматического ретикулума молекулы коллагена встречаются также с тремя ферментами, которые его гидроксилируют. Два из этих ферментов гидроксилируют остатки пролина в 3-гидроксипролин и 4-гидрокси-пролин; третий - превращает лизины в оксилизиловые остатки. Эти ферменты узнают остатки пролина и лизина только в определенных положениях (рис.).
Когда цепи коллагена становятся гидроксилированными, к оксилизинам могут быть добавлены остатки сахаров. Первый фермент-галактозилтрансфераза - добавляет к оксилизину галактозу; второй фермент - глюкозилтрансфераза - добавляет к оксилизилгалактозе глюкозу. Участок около карбоксильного конца модифицируется глюкозамином и маннозой.
Следующий этап включает образование внутрицепочечных дисульфидных связей и организацию трех коллагеновых полипептидов в тройную спираль. Дисульфидные связи образуются на карбоксильных концах между прилежащими молекулами коллагена, создавая тем самым условия для формирования тройной спирали. Если пролины были гидроксилированы правильно, то три цепи скручиваются одна вокруг другой, образуя протяженный участок тройной спирали, ограниченный с обеих сторон глобулярными областями.
В таком виде молекула коллагена выделяется во внеклеточное пространство. Процессинг продолжается даже там. Сначала протеолитические ферменты удаляют глобулярные домены на аминоконце и карбоксильном конце. В результате этого отрезания образуется фрагмент совершенной тройной спирали. На следующем этапе эти фрагменты самопроизвольно собираются в фибриллы. Однако эти фибриллы не обладают достаточной механической прочностью, чтобы функционировать в качестве структурных белков до тех пор, пока различные тройные спирали не будут ковалентно связаны друг с другом с помощью дополнительных поперечных сшивок. Это связывание осуществляется путем ферментативной модификации лизилов в оксилизиловых остатках и присоединения их друг к другу. Таким образом, существует значительное число необходимых этапов модификации белка после трансляции (как мы увидим в следующих двух главах, коллаген - не только исключительно важный структурный белок, но, как полагают, он ответствен также за некоторые эмбриональные взаимодействия).