- •Энтропия в необратимых процессах
- •Энтропия в необратимых процессах (2)
- •Пример возрастания энтропии
- •Цикл Отто
- •Цикл Дизеля
- •Статистическая интерпретация
- •Формула Больцмана для энтропии
- •Здесь ВЭ U, давление p и объем V – функции состояния, а количество
- •ТД потенциалы
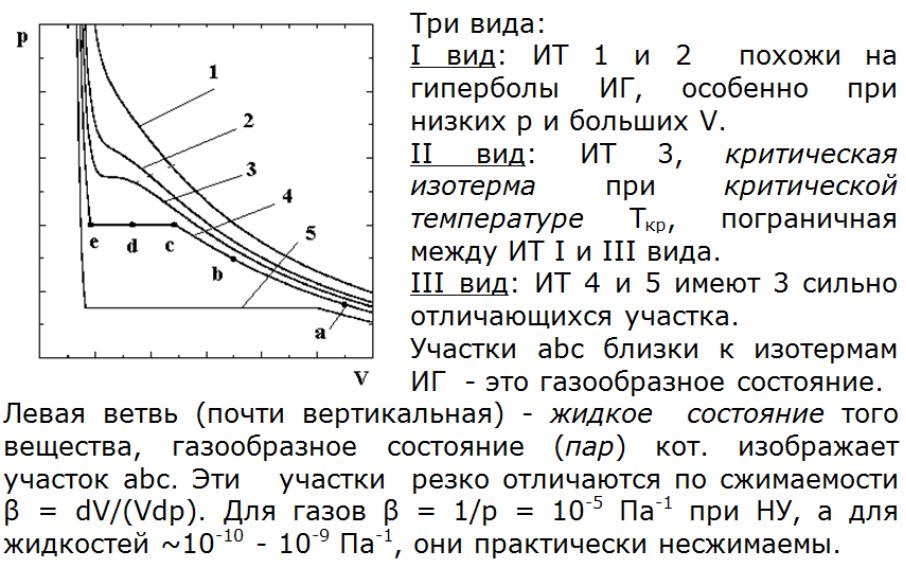
- •Изотермы реальных газов
- •Двухфазное состояние
- •Изотерма реального газа ниже крит. темп.
- •Кипение
- •Критическая изотерма

Энтропия в необратимых процессах

Энтропия в необратимых процессах (2)
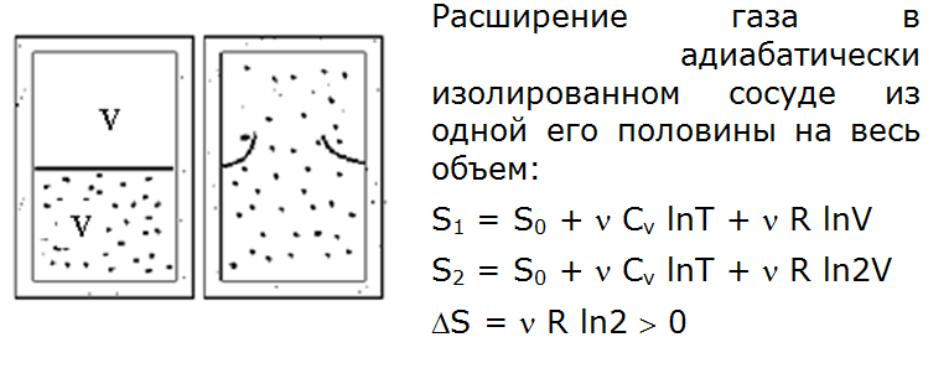
Пример возрастания энтропии
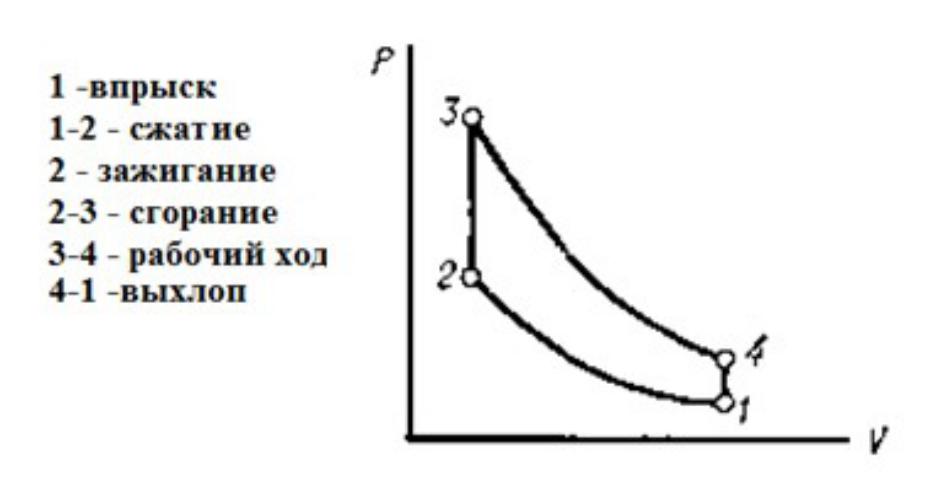
Цикл Отто
(Николаус Отто 1832-91) самостоят.
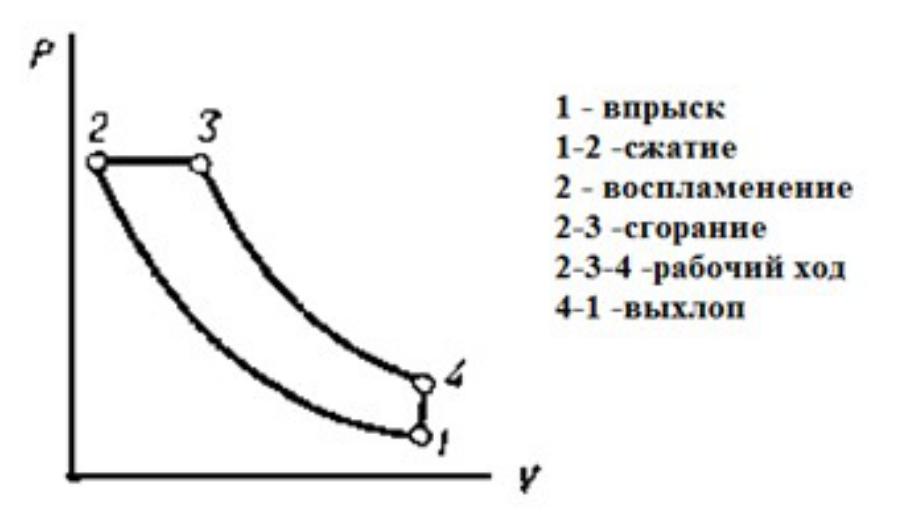
Цикл Дизеля
(Рудольф Дизель 1856-1913) самостоят.

Статистическая интерпретация

Формула Больцмана для энтропии
Здесь ВЭ U, давление p и объем V – функции состояния, а количество теплоты Q не является ею, т.к. зависит от процесса, в котором получено. Но дифференциал dQ можно выразить через функции состояния: dQ = T dS, характер процесса выражен через приращение dS.
dU = T dS - p dV - это способ выразить ВЭ через ТД параметры, энтропия к ним причислена (вообще, любую функцию состояния можно считать параметром).
Можно определить (ввести) новую функцию состояния – энтальпию (от греч. enthálpo — нагреваю):
H = U + p V => dH = T dS – p dV + p dV + V dp => dH = T dS + V dp Если р = const (ИБП), H = T S = Q – энтальпия равна количеству теплоты, подводимой к телу при постоянном давлении, поэтому другое ее название – теплосодержание.
Еще одно преобразование dU = T dS - p dV => определяется новая функция состояния свободная энергия Гельмгольца (СЭГе):
F = U – T S => dF = - p dV – S dT
Почему называется свободной энергией? Если T = const, то p dV = dА = - dF, т.е. работа совершается за счет уменьшения СЭ, СЭ это та часть ВЭ, которая может быть превращена в работу при T = const.
В отличие от нее оставшаяся часть ВЭ U – F = T S – называется связанной энергией.
Далее определяется еще одна функция состояния - свободная энергия Гиббса (СЭГи):
G = F + p V => dG = - S dT + V dp

ТД потенциалы