
Спектры атомов и молекул.
Спектр это совокупность пространственно разделенных гармонических составляющих сложного колебательного процесса - в том числе световой волны. Спектры световых волн наиболее просто получить с помощью стеклянной призмы (И. Ньютон 1666.г). Спектр белого света непрерывный. Последовательность цветов в спектре от красного цвета (с наибольшей длиной волны 760 нМ) до фиолетового цвета (с наименьшей длиной волны 400 нМ). Такой свет излучают нагретые тела в твердом и жидком состоянии. За счет тепловой энергии электроны вещества переходят в возбужденное состояние. После этого практически мгновенно (10 –8 с) происходит обратный переход с испусканием фотона. Если переход из возбужденного состояния не инициируется внешним фактором, то он называется спонтанным. Непрерывность спектров нагретых тел (в твердом и жидком состоянии) обусловлена близостью энергетических уровней в данных агрегатных состояниях. В противоположность этому спектры нагретых газов, пары различных элементов (в том числе и тяжелых) в атомарном состоянии – не непрерывные, а дискретные. Это и связано именно с дискретностью энергетических уровней в атомах.
При переходе электронов с высших уровней (n > 1) возникает излучение с набором частот
![]() ,
где
,
где
![]()
Эти частоты соответствуют ультрафиолетовой и даже рентгенов ой области спектра и носят название серии Лаймана.
При переходе на второй снизу уровень возникает излучение с частотами:
![]() ,
n=3,4,….
Это уже видимые линия спектра, они носят
название - серии Бальмера.
,
n=3,4,….
Это уже видимые линия спектра, они носят
название - серии Бальмера.
Таким
образом, зная частоты, на которых
появляются максимумы спектра по его
энергетических уровнях можно судить о
веществе, которое дает спектр. Так как
для различных веществ - соединений этот
набор энергетических уровней специфичен,
то по спектру
можно идентифицировать
вещество, что и составляет суть
спектрального анализа. При этом в образце
можно обнаружить малые доли вещества
– вплоть до 10
![]() г.
Прибор позволяющий проводить спектральный
анализ – называется спектрофотометр.
г.
Прибор позволяющий проводить спектральный
анализ – называется спектрофотометр.
Виды спектров.
1. Спектры испускания (эмиссионные)
2. Спектры поглощения (абсорбционные)
Всё, что говорилось в в предыдущем пункте относится к спектрам испускания. Они представляют собой цветные линии на черном фоне. Чтобы получить эти спектры опытным путем надо пропустить свет от нагретого пара некоторого исследуемого вещества через призму или дифракционную решетку.
Спектры поглощения получаются, если белый свет пропустить через холодный газ – исследуемое вещество в атомарном состоянии. При этом поглотятся только те частоты, которые соответствуют разнице энергетических уровней электронов в атоме. Спектр поглощения это набор черных линий на фоне непрерывного спектра. Для любого элемента положение цветных линий спектра испускания соответствует положению черных линий спектра поглощения.
Инфракрасная спектроскопия.
Поглощение
и излучение электромагнитных волн в
инфракрасной (ИК) области обусловлено
переходами электронов между колебательными
уровнями энергии для различных групп
атомов в сложных молекулах. ИК –
спектроскопия соответствует, поэтому
не атомарным, а молекулярным спектрам.
Такие спектры имеют более сложный вид
– это совокупность полос, внутри 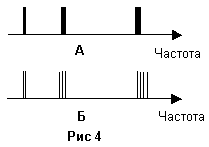 которых
можно различить более тонкие структуры.
Такие спектры называются не линейчатыми,
а полосатыми. На рисунке 4 – А изображен
полосатый спектр, при малом разрешении
спектрального прибора – такой спектр
выглядит как линейчатый. На рисунке 4 –
Б изображен полосатый спектр, при большом
разрешении спектрального прибора, здесь
видна более тонкая структура спектра.
Причина более сложной структуры полосатых
спектров – многообразие колебательных
движений атомов в сложных молекулах.
Кроме колебательных движений, в полосатых
спектрах отражается вращательное
движение самих молекул. При изображении
полосатого спектра обычно принято по
горизонтальной оси откладывать не
частоту или длину волны, а так называемое
волновые числа К. Для ИК спектров эти
волновые числа лежат в интервале от
4000 до 20 (1/см). Волновым числом называют
число длин волн, укладывающихся на
отрезке 1 сантиметр2[2].
Приведем таблицу, в которой сопоставлены
дины волн и волновые числа для ИК
излучения:
которых
можно различить более тонкие структуры.
Такие спектры называются не линейчатыми,
а полосатыми. На рисунке 4 – А изображен
полосатый спектр, при малом разрешении
спектрального прибора – такой спектр
выглядит как линейчатый. На рисунке 4 –
Б изображен полосатый спектр, при большом
разрешении спектрального прибора, здесь
видна более тонкая структура спектра.
Причина более сложной структуры полосатых
спектров – многообразие колебательных
движений атомов в сложных молекулах.
Кроме колебательных движений, в полосатых
спектрах отражается вращательное
движение самих молекул. При изображении
полосатого спектра обычно принято по
горизонтальной оси откладывать не
частоту или длину волны, а так называемое
волновые числа К. Для ИК спектров эти
волновые числа лежат в интервале от
4000 до 20 (1/см). Волновым числом называют
число длин волн, укладывающихся на
отрезке 1 сантиметр2[2].
Приведем таблицу, в которой сопоставлены
дины волн и волновые числа для ИК
излучения:
-
Длина волны
Волновое число
0,25*10-5 м
4000 (1/см)
0,5 мм
20 (1/см)
Приведем пример о поглощении ИК излучения разными группами атомов: О-Н группа поглощает излучение при волновых числах 3350 – 3250 (1/см), С-С группа – при волновых числах 1645-1615 (1/см).
Понятие об электронном парамагнитном резонансе (ЭПР) и ядерном магнитном резонансе (ЯМР).
Методики ЭПР и ЯМР относится к спектральному методу изучения вещества. Об этой методике уже было сказано в лекции по изучению структуры и свойств биологических мембран (смотри лекцию 1 семестра 2.).
Люминесцентные методы исследования.
Как было сказано выше для излучения света атомами, необходимо первоначально перевести их в возбужденное состояние, в частности, путем нагревания. Однако световое излучение можно получить и при низких температурах. В зависимости от того, как достигается перевод электронов атомов в возбужденное состояние, различают следующие виды люминесценции:
- фотолюминисценция - возбужденное состояние электронов достигается кратковременной вспышкой света, после чего можно зарегистрировать вторичное излучение,
- электролюминисценция – свечение, вызываемое газовым разрядом, например в неоновой лампе,
- радиолюминисценция - свечение, вследствие радиоактивного облучения атомов,
- хемилюминисценция – свечение, сопровождающее некоторые химические реакции,
- биолюминисценция – свечение некоторых бактерий.
 При
фотолюминисценции могут быть два
варианта свечения: флюоресценция и
фосфоресценция. Первый вид свечения
имеет место для одноатомных паров, когда
атомы имеют два энергетических уровня
и время жизни электронов в возбужденном
состоянии очень мало (10-8
с). При этом спин электронов атомов в
исходном и возбужденном состояниях –
одинаковый.
При
фотолюминисценции могут быть два
варианта свечения: флюоресценция и
фосфоресценция. Первый вид свечения
имеет место для одноатомных паров, когда
атомы имеют два энергетических уровня
и время жизни электронов в возбужденном
состоянии очень мало (10-8
с). При этом спин электронов атомов в
исходном и возбужденном состояниях –
одинаковый.
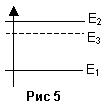
 Второй вид –
фосфоресценция имеет место в системах
с примесями. Энергетическая диаграмма
содержит третий – метастабильный
уровень Е3.
Время жизни электронов на этом уровне
может достигать 10-3
с (Рис 5). Большее время жизни электрона
на этом уровне обусловлено изменением
его спина. Такое состояние называют
триплетным состоянием, тогда как
состояние с тем же спином, как и на уровне
1 – называют синглетным состоянием.
Переход электрона с уровня Е1
на уровень Е2
обусловлен поглощением света
(фотовспышкой), переход с Е2
на Е3
– не сопровождается излучением, переход
с уровня Е3
на Е1
соответствует фосфоресценции.
Второй вид –
фосфоресценция имеет место в системах
с примесями. Энергетическая диаграмма
содержит третий – метастабильный
уровень Е3.
Время жизни электронов на этом уровне
может достигать 10-3
с (Рис 5). Большее время жизни электрона
на этом уровне обусловлено изменением
его спина. Такое состояние называют
триплетным состоянием, тогда как
состояние с тем же спином, как и на уровне
1 – называют синглетным состоянием.
Переход электрона с уровня Е1
на уровень Е2
обусловлен поглощением света
(фотовспышкой), переход с Е2
на Е3
– не сопровождается излучением, переход
с уровня Е3
на Е1
соответствует фосфоресценции.
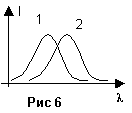
Для люминесценции выполняется закон Стокса: спектр люминисценции (Рис 6 – график 2)сдвинут в сторону более длинных волн, по сравнению со спектром излучения, вызвавшего люминесценцию (Рис 6 – график 1). Объясняется это тем, что (Е3 - Е1 ) < (Е2 - Е1). По спектрам люминесценции можно изучать межмолекулярное взаимодействие, так как на флюоресценцию влияют окружающие молекулу примеси – спектр люминесценции будет определяться характером примеси. Люминесцентный анализ основан именно на этом принципе. Применение такого анализа в медицине позволяет
- проводить раннюю диагностику некоторых патологических состояний,
- определить порчу продуктов,
- определять поражение тканей грибками,
- проводит сортировку фармакологических препаратов,
- определять проницаемость капилляров.
Как и при спектральном анализе, здесь возможно обнаружить в пробе ничтожное количество вещества вплоть до 10-9 грамма. Если в обычном микроскопе устанавливается светофильтр, пропускающий только свет, который излучается при люминесценции и не пропускается свет, вызывающий саму люминесценцию, такой микроскоп называют люминесцентным.
