
охт (6sem) / методички митхт / oldЛабораторный практикум по ОХТ (2011)
.pdf
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Московская государственная академия тонкой химической технологии имени М.В. Ломоносова
Основы и системные закономерности технологических процессов
Лабораторный практикум
Москва , 2011
2
УДК 66.0(075)
Основы и системные закономерности технологических процессов. Лабораторный практикум. / Авт. Брук Л.Г.,
Сафонов В.В., Цыганков В.Н., Шварц А.Л. Учебное пособие М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2011.- 79 с.
Лабораторный практикум предназначен для студентов 4-го курса очной формы обучения по направлению бакалавриата 080500.65 – Экономика и управление на предприятии.
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебного пособия.
3
Раздел 1
Основные понятия и технологические критерии эффективности химикотехнологических процессов
4
1.1. Классификация химико-технологических процессов.
Химико-технологический процесс (ХТП) – это совокупность физических и химических процессов, направленных на превращение
исходных реагентов (сырья) в |
необходимые |
для дальнейшей |
|
переработки |
или потребления |
(целевые) |
продукты. ХТП |
классифицируют по сочетанию признаков, характеризующих типы процессов, лежащих в их основе, и по способу их осуществления. Эта классификация важна, поскольку тип ХТП определяет способ его реализации, в частности, тип используемого реактора, необходимость рециркуляции реагентов и т.д.
В ХТП можно условно выделить часть, связанную с химическими превращениями – реакционную систему, и часть, включающую в основном физические процессы, направленные на выделение и очистку продуктов процесса. В практикуме по Основам химической технологии основное внимание уделено химической составляющей ХТП. В связи с этим под обозначением « ХТП» будем подразумевать, в основном, реакционную систему.
Основными признаками химического превращения являются:
а) химизм, включающий информацию о степени сложности протекающих реакций, их количестве и стехиометрии;
б) особенности термодинамики; в) кинетические закономерности протекания ХТП; г) фазовая характеристика ХТП.
С точки зрения химизма ХТП делят на простые и сложные.
Простой ХТП можно описать одним стехиометрическим уравнением превращения исходных реагентов, например, А и В в продукты Р и R (1.1.)
аА + вВ = rR + pP |
(1.1), |
где а, в, r и p – стехиометрические коэффициенты.
При этом не все продукты основной реакции могут представлять одинаковую практическую ценность, поэтому их делят на целевые и побочные, которые могут найти применение или являться отходами производства.
Сложный ХТП описывают более чем одним стехиометрическим уравнением, т.е. кроме основной реакции протекают параллельные, последовательные и параллельно-последовательные превращения реагентов и продуктов. Это также приводит к появлению побочных
5
продуктов. Таким образом, сложный ХТП всегда включает основную реакцию, дающую целевые продукты (иногда вместе с побочными) и побочные реакции, приводящие к образованию побочных продуктов.
Стермодинамической точки зрения ХТП делят на необратимые
иобратимые, экзотермические и эндотермические.
Необратимыми ХТП называют процессы, равновесие основной реакции которых практически полностью смещено в сторону образования продуктов во всем доступном для ХТП диапазоне изменения температуры и давления. Константа равновесия необратимого процесса остается больше чем 102 во всем доступном диапазоне условий. Необратимыми можно считать и процессы, равновесие которых практически полностью смещено в сторону исходных реагентов (константа равновесия очень мала). Такие процессы называют запрещенными по термодинамическим соображениям. Они, как правило, не представляют практического интереса.
Обратимый ХТП – это процесс, на положение равновесия которого можно в заметной степени повлиять изменением условий проведения. Если в результате удается подобрать условия проведения ХТП таким образом, чтобы константа равновесия имела величину ~102 или больше, а равновесный выход целевого продукта был близок к 100% или к 1 (в долях) (см. ниже), то процесс называют обратимым смещенным. Если константа равновесия и равновесный выход не достигают указанных значений в выбранных условиях проведения, то ХТП считают обратимым несмещенным.
При организации ХТП необходимо учитывать тепловой эффект протекающих реакций. Тепловой эффект реакции ( количество тепла, выделяющееся или поглощающееся в результате протекания реакции - Q) и изменение энтальпии (ΔН) одинаковы по абсолютной величине, но противоположны по знаку. Реакции, протекающие с выделением тепла, называют экзотермическими (Q>0, ΔН<0), реакции, приводящие к поглощению тепла – эндотермическими (Q<0, ΔН>0).
Тепловой эффект ХТП складывается из тепловых эффектов основной и побочных реакций. Если сумма тепловых эффектов положительна, т.е. преобладают реакции, протекающие с выделением тепла, то ХТП является экзотермическим. Если основной вклад в суммарный тепловой эффект вносят реакции, протекающие с поглощением тепла, то ХТП – эндотермический. Часто под тепловым эффектом ХТП имеют ввиду тепловой эффект целевой реакции. Очевидно, что для экзотермических ХТП необходимо обеспечить теплоотвод при соблюдении оптимального температурного режима в реакционной зоне (или организовать автотермический режим), а для эндотермических процессов – решить проблему теплоподвода.
6
Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала реакции уравнением (1.2.)
G° = ΔН° - ТΔS° = - RT lnK |
(1.2. ) |
Отсюда следует связь константы равновесия реакции и |
|
температуры (изобара Вант-Гоффа) (1.3). |
|
lnK = S°/R - ΔН°/RT |
(1.3) |
Это уравнение позволяет проводить термодинамический анализ реакционных систем при известных или рассчитанных по справочным данным величинах изменений энтальпии (ΔН°) и энтропии ( S°) реакции.
Равновесный выход или равновесная степень превращения – это доля исходного реагента, превратившегося в продукты реакции к моменту достижения равновесия. Равновесный выход - величина более информативная в практическом плане, чем величина константы равновесия, поскольку это максимально достижимый выход в данных условиях.
Связь равновесного выхода и константы равновесия определяется видом уравнения реакции. Например, для реакции синтеза метанола (1.4) выражения для константы равновесия через парциальные давления реагентов (1.5) и через общее давление и равновесный выход (1.6) выглядят следующим образом:
|
|
|
СО + 2 Н2 = СН3ОН |
(1.4) |
||||||
|
|
|
K P |
= |
|
PCH 3OH |
|
(1.5) |
||
|
|
|
|
P |
× P 2 |
|||||
|
|
|
|
|
|
CO |
H 2 |
|
||
K P |
= |
|
P × x × ( 3 - 2 x )3 |
|
|
= |
|
x × ( 3 - 2 x )2 |
(1.6) |
|
|
|
|
|
|
|
|
||||
|
4 |
× P 3 × ( 1 - x )3 × ( 3 - 2 x ) 4 × P 2 × ( 1 - x )3 |
|
|||||||
где Рi –парциальное давление i-ого вещества, P – общее давление в системе,
х – равновесный выход метанола или равновесная степень превращения монооксида углерода
Вывод уравнений типа (1.6) несложен, но выходит за рамки данного издания. Уравнения типа (1.6) позволяют не только исследовать взаимосвязь температуры и равновесного выхода (совместно с уравнением 1.3), но и определить чувствительность равновесного
7
выхода к изменению давления (при постоянной температуре и константе равновесия). Так, легко показать, что для вышеприведенного примера величина константы равновесия и равновесный выход будут уменьшаться с увеличением температуры (ΔН < 0), и равновесный выход будет увеличиваться при увеличении давления (реакция протекает в газовой фазе с уменьшением количества молей). Причем, при малых х (х<<1) равновесный выход будет увеличиваться пропорционально Р2.
В первом приближении можно считать, что константа равновесия не зависит от давления и является функцией только температуры. Это совершенно верно при относительно низких давлениях и высоких температурах. При высоких давлениях законы для идеальных газов перестают описывать наблюдаемые зависимости. Для сохранения возможности пользоваться простыми законами были введены понятия активности и коэффициента активности. Взаимосвязь активности и давления выражается уравнением (1.7).
ai = Pi × γ i |
(1.7) |
А константа равновесия реакции, протекающей под давлением, должна выражаться через активности компонентов. Например, для реакции синтеза метанола из синтез-газа выражение для константы равновесия с использованием равновесных активностей и коэффициентов активностей выглядит следующим образом (1.8).
Ka |
= |
aCH 3 OH |
|
= |
PCH 3OH |
× γCH 3 OH |
|
= K p |
× Kγ |
(1.8) |
||||
aco |
× aH2 |
|
PCO |
× γCO |
2 |
× γ |
2 |
|
||||||
|
|
2 |
|
H 2 |
|
|
||||||||
|
|
|
|
|
|
× PH 2 |
|
|
|
|||||
Поскольку при расчете по формулам (1.2) и (1.3) получают значение Ка, а для расчета равновесного выхода необходимо значение Кр, то необходимо для процессов, протекающих под давлением, рассчитывать Кγ. Для этого используют различные подходы, описанные в литературе по химической термодинамике.
Таким образом, на величину константы равновесия реакции влияет температура в зависимости от знака теплового эффекта. Давление может влиять на величину Кр только через изменение Кγ. На величину равновесного выхода влияет температура (через значение Кр), общее давление и соотношение концентраций (парциальных давлений веществ). Избыток одного реагента приводит к увеличению степени превращения другого(их) реагента(ов) и к уменьшению степени превращения реагента, находящегося в избытке.
8
Большая величина константы равновесия и отсутствие термодинамических ограничений (Хравн.=1) необходимое, но не достаточное условие возможности практической реализации ХТП.
Очень важное значение для выбора условий проведения ХТП имеют кинетические закономерности целевой и побочных реакций (т.е. закономерности протекания процесса во времени или зависимость скорости от концентрации веществ, температуры, наличия катализатора и его характеристик).
Ea,прям
Ea,обр
E
A + B
C + D
- H
Координата реакции
Рис. 1.1 Энергетическая диаграмма элементарной реакции
Столкновение двух молекул исходных реагентов, обладающих достаточной энергией для преодоления энергетического барьера, приводит к получению продуктов (промежуточных или конечных) реакции и называется элементарным актом химического взаимодействия (рис.1.1). Точку на вершине энергетического барьера называют переходным состоянием или активированным комплексом (это термины из соответствующих теорий элементарных реакций, см. курс « Физическая химия»). Совокупность одинаковых элементарных актов – элементарная реакция (1.13).
аА + вВ → сС + dD (1.9)
Элементарную реакцию от сложной (по механизму) отличает отсутствие промежуточных продуктов. Скорость элементарной реакции

9
может быть описана законом действия масс. Для реакции (1.9)
уравнение (1.10). |
|
|
r |
= kC a C b |
(1.10) |
13 |
A B |
|
Скорость элементарной реакции пропорциональна концентрациям реагентов в степенях, равных их стехиометрическим коэффициентам в уравнении реакции. Для газофазных реакций вместо концентраций используют парциальные давления веществ. Коэффициент пропорциональности – константа скорости элементарной реакции. Зависимость константы скорости от температуры описывают уравнением Аррениуса (1.11).
k = Ae |
− E |
RT |
(1.11) |
|
|||
|
|
|
где А – предэкспоненциальный член, Е – энергия активации, R – газовая постоянная, Т – абсолютная температура
Показатель степени концентрации (или парциального давления) в кинетическом уравнении называют порядком по данному реагенту. Для элементарной реакции порядок совпадает со стехиометрическим коэффициентом данного вещества (и должен быть положительным и целочисленным). Сумма показателей степени для концентраций реагентов – суммарный порядок. Для элементарной реакции суммарный порядок совпадает с молекулярностью (числом молекул реагентов, участвующих в элементарной реакции) и не превышает двух. Одновременное столкновение более двух молекул – маловероятно.
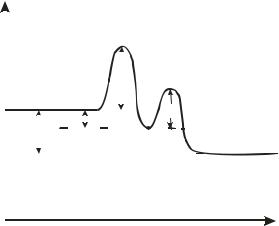
Сложные по механизму реакции включают несколько элементарных реакций. На энергетической диаграмме сложной по механизму реакции 1.16, 1.17 будет соответствовать кривая потенциальной энергии с несколькими минимумами и максимумами (рис. 1.2)
A + B X
X + C P
(1.12)
(1.13)
10
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A + В + С |
|
|
|
Ea,1 |
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Ea,2 |
|
|
|||||||||||||||||||||
|
|
|
H |
|
|
|
|
H1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Х + С |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Координата реакции
Рис. 1.2. Энергетическая диаграмма сложной по механизму реакции. Х – промежуточный продукт.
Скорость сложной по механизму реакции часто можно описать эмпирическим уравнением, по форме совпадающим с уравнением закона действия масс (например, 1.10). Но в случае сложной по механизму реакции порядки по реагентам могут быть нецелочисленными, переменными, отрицательными, большими по абсолютной величине.
С точки зрения организации ХТП кинетические порядки основной и побочных реакций по реагентам важны, так как они отражают степень чувствительности скоростей образования целевых и побочных продуктов (а, следовательно, и показателей процесса, см. ниже) к концентрациям веществ – участников ХТП. Чем выше порядок по данному веществу, тем сильнее влияет изменение его концентрации на скорость. Зависимость наблюдаемой константы скорости (kэфф) от температуры может описываться уравнением, по форме совпадающим с уравнением Аррениуса, но значения предэкспоненты и энергии активации могут быть любыми (в отличие от определенных значений этих параметров для элементарных реакций). Например, наблюдаемая энергия активации сложной реакции может быть отрицательна, т.е. скорость сложной реакции может уменьшаться с увеличением температуры из-за того, что в kэфф входят константы равновесия экзотермических стадий (реакций), значения которых уменьшаются с увеличением температуры. С технологической точки зрения знак и величина наблюдаемой энергии активации отражает чувствительность скоростей реакций ХТП к изменению температуры. Чем больше
