
- •25 Біофізика розділ 6. Елементи молекулярнОї біофізики та біофізики мембранних процесів в клітинах
- •Міжмолекулярні взаємодії у біополімерах
- •6.1.1. Класифікація взаємодій у біополімерах
- •Cтруктурна організація білків та нуклеїнових кислот
- •6.2.1. Первинна структура
- •6.2.2. Вторинна структура
- •6.2.3. Третинна структура
- •6.2.4. Четвертинна структура
- •Будова і властивості біологічних мембран
- •Пасивний та активний транспорт речовин крізь мембранні структури клітин
- •6.4.1. Пасивний транспорт незаряджених молекул
- •6.4.2. Пасивний транспорт іонів
- •6.4.3. Активний транспорт
- •Біологічні потенціали
- •6.5.1. Рівноважний мембранний потенціал Нернста
- •6.5.2. Дифузійний потенціал
- •6.5.3. Потенціал Доннана. Доннанівська рівновага
- •6.5.4. Стаціонарний потенціал Гольдмана-Ходжкіна-Катца
- •6.5.5. Потенціал дії. Механізм виникнення та розповсюдження нервового імпульсу
- •Лабораторний практикум1)
- •6.6.1. Лабораторна робота “Дослідження нелінійних властивостей провідності шкіри жаби”
- •Питання для підготовки до лабораторної роботи
- •Додаткова література
- •Додаткові теоретичні відомості
- •Порядок виконання роботи
- •6.6.2. Лабораторна робота “Дослідження дисперсії електричного імпедансу біологічних тканин”
- •Питання для підготовки до лабораторної роботи
- •Додаткова література
- •Додаткові теоретичні відомості
- •Порядок виконання роботи
- •Задачі та запитання для самоконтролю
- •Порядок виконання роботи
- •Контрольні питання і задачі
- •6.6.4. Практичне заняття “Вивчення біофізики мембран за допомогою комп’ютерних програм”
- •Контрольні питання до комп’ютерних програм з біофізики мембран (блок 5, файл bmq_.Exe)
6.5.1. Рівноважний мембранний потенціал Нернста
Розглянемо мембрану, проникну для
певних іонів (скажімо іонів К+).
Як було показано вище (див. (6.30)), рушійною
силою пасивного транспорту іонів
крізь мембрану є градієнт електрохімічного
потенціалу. Дифузія крізь мембрану
певних іонів буде продовжуватись доти,
доки величина
![]() обернеться в нуль, тобто електрохімічні
потенціали по обидва боки мембрани
стануть рівними між собою:
обернеться в нуль, тобто електрохімічні
потенціали по обидва боки мембрани
стануть рівними між собою:
![]() . (6.31)
. (6.31)
При цьому на мембрані виникає різниця електричних потенціалів, яка перешкоджатиме подальшому рухові іонів. Встановиться рівновага, струм іонів крізь мембрану припиниться (j = 0). З умови (6.31) знайдемо вираз для рівноважної різниці потенціалів:
![]() . (6.32)
. (6.32)
Оскільки хімічний потенціал розчинника
залишається незмінним (![]() ),
то з рівняння (6.32) отримаємо шукану
формулу:
),
то з рівняння (6.32) отримаємо шукану
формулу:
![]() . (6.33)
. (6.33)
Це і є рівноважний потенціал
Нернста. Зауважимо, що при
рівності концентрацій (![]() )
цей потенціал стає рівним нулеві, саме
тому рівноважний мембранний потенціал
ще називають концентраційним потенціалом
Нернста.
)
цей потенціал стає рівним нулеві, саме
тому рівноважний мембранний потенціал
ще називають концентраційним потенціалом
Нернста.
Оцінимо його величину для аксона
кальмара: [К+]i =
=
392 мМоль, [К+]e =
22.4 мМоль, Т = 293 К (t = 20°C),
тоді з врахуванням
чисельних значень
констант R =
= 8.3
Дж/мольК
і F = 96500 Кл/моль маємо
![]() мВ.
мВ.
Якщо зовнішній потенціал на біомембрані e прийняти рівним 0, скориставшись довільністю у виборі точки відліку потенціалу, то всередині клітини потенціал Нернста, пов’язаний з розподілом іонів К+, дорівнюватиме:
![]() мВ.
мВ.
Таким чином, до виникнення рівноважного потенціалу Нернста приводить відмінність у концентраціях іонів всередині і зовні клітини. Так, для живих клітин концентрація іонів К+ всередині перебільшує їх концентрацію зовні клітини в десятки разів.
Іноді користуються безрозмірним рівноважним потенціалом Нернста:
![]() , (6.34)
, (6.34)
звідки
![]() . (6.35)
. (6.35)
У 1902 році Дж. Бернштейн висунув гіпотезу, згідно з якою потенціал спокою зумовлений проникністю цитоплазматичної мембрани лише для іонів К+, внаслідок чого виникає потенціал, що описується рівнянням Нернста:
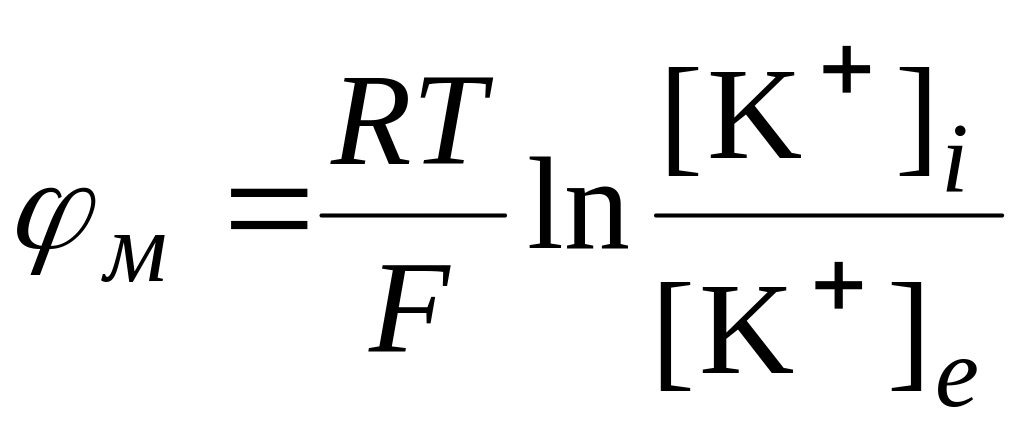 .
(6.36)
.
(6.36)
На мал. 6.32 подані графіки
![]() ,
побудовані за експериментальними
даними, а також розраховані за
рівнянням (6.36). Розходження між
розрахованими за рівнянням Нернста і
експериментальними даними при
малих значеннях
,
побудовані за експериментальними
даними, а також розраховані за
рівнянням (6.36). Розходження між
розрахованими за рівнянням Нернста і
експериментальними даними при
малих значеннях
![]() свідчать про недосконалість
калієвої теорії потенціалу спокою.
свідчать про недосконалість
калієвої теорії потенціалу спокою.
6.5.2. Дифузійний потенціал
У
Мал. 6.32.
Залежність потенціалу спокою
гігантського аксону
кальмара від концентрації
іонів K+ в
позаклітинному середовищі
(--- – рівняння Нернста,
– експериментальні
дані, ххх – рівняння Гольдмана).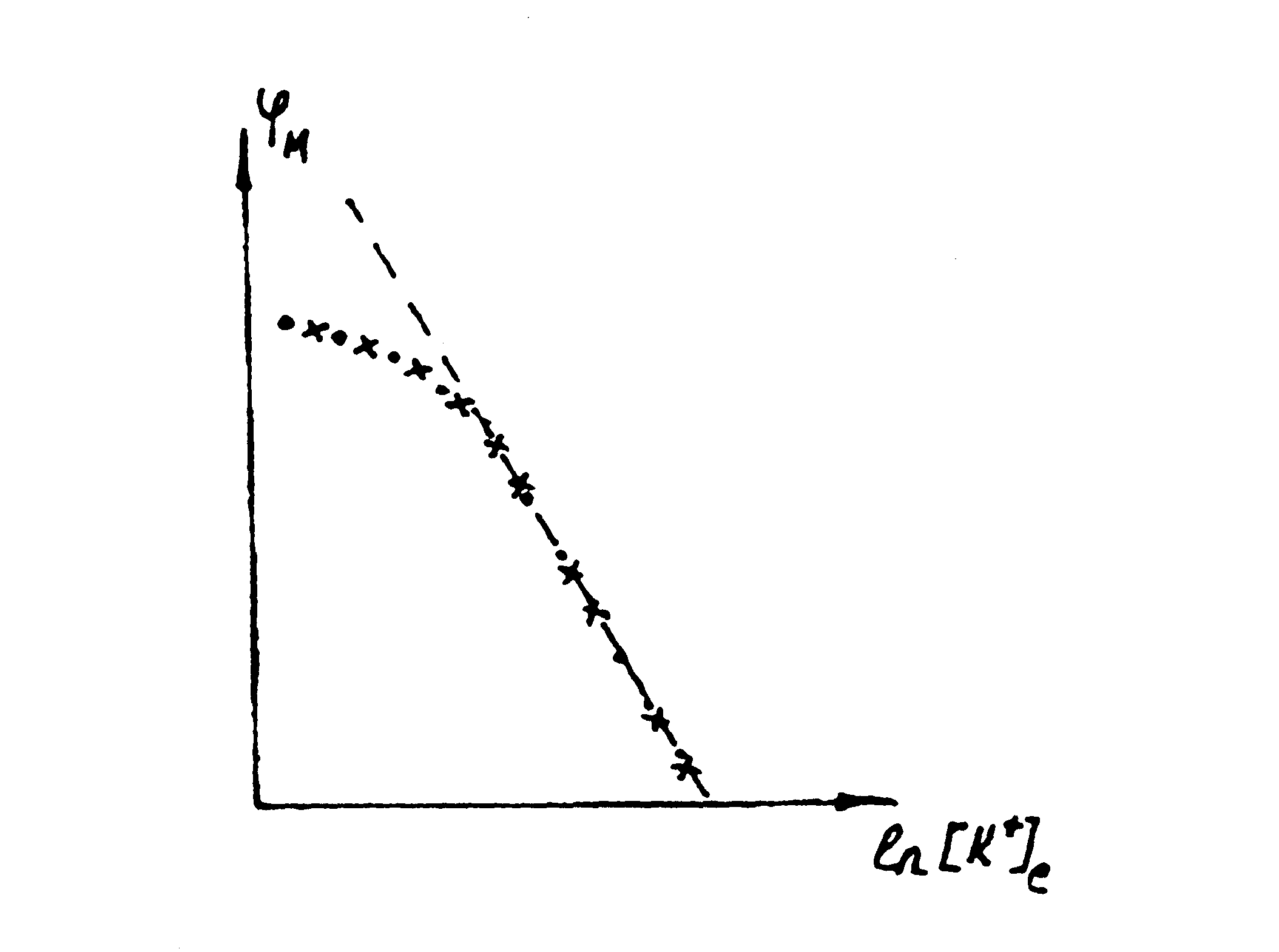
![]() ).
У цьому випадку негативні іони
будуть випереджати позитивні, внаслідок
чого виникне електричне поле, яке буде
прискорювати позитивні іони і
гальмувати негативні доти, доки швидкості
позитивних і негативних іонів стануть
рівними. При цьому на мембрані виникне
різниця потенціалів, що обумовлена
різною рухливістю іонів, –
дифузійний потенціал. Одержимо
вираз для цього потенціалу.
).
У цьому випадку негативні іони
будуть випереджати позитивні, внаслідок
чого виникне електричне поле, яке буде
прискорювати позитивні іони і
гальмувати негативні доти, доки швидкості
позитивних і негативних іонів стануть
рівними. При цьому на мембрані виникне
різниця потенціалів, що обумовлена
різною рухливістю іонів, –
дифузійний потенціал. Одержимо
вираз для цього потенціалу.
Згідно з визначенням, формулу для густини потоку речовини можна подати у вигляді:
![]() , (6.37)
, (6.37)
де с – концентрація іонів, υ – швидкість їх руху.
Порівнюючи вираз (6.37) з рівнянням Нернста-Планка (6.28), одержимо рівняння для швидкості руху іонів:
![]() . (6.38)
. (6.38)
Для позитивних іонів:
![]() . (6.39)
. (6.39)
Для негативних іонів:
![]() . (6.40)
. (6.40)
Нехай швидкості руху негативних
і позитивних іонів зрівнялися, тобто
![]() .
У результаті маємо:
.
У результаті маємо:
![]()
![]() , (6.41)
, (6.41)
або
![]() . (6.42)
. (6.42)
Проінтегруємо рівняння (6.42) по всій товщі мембрани:
 ,
,
звідки
![]() .
.
Враховуючи співвідношення Ейнштейна між коефіцієнтами дифузії та рухливості D+ = b+RT/Fz, D– = b–RT/Fz, остаточно маємо:
![]() . (6.43)
. (6.43)
Таким чином, дифузійний мембранний
потенціал зумовлений різними
значеннями рухливості (![]() )
та концентрації (
)
та концентрації (![]() )
для дифундуючих крізь мембрану іонів.
)
для дифундуючих крізь мембрану іонів.
Виконаємо чисельну оцінку дифузійного потенціалу, що спричинений різними рухливостями іонів Na+ і Сl–. Як відомо, концентрація іонів як Na+, так і Сl– зовні клітини перевищує їх концентрацію всередині приблизно на порядок. Рухливість цих іонів, знайдена в експерименті, дорівнює:
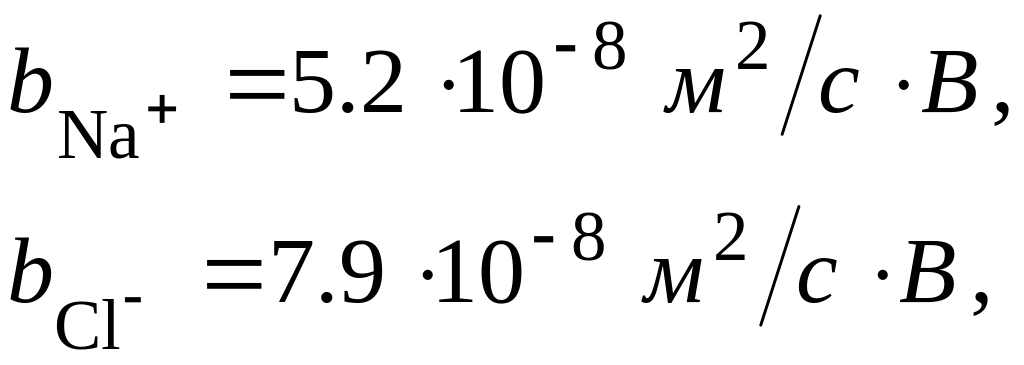
тобто
![]() .
.
При дифузії цих іонів всередину клітини на мембрані виникне потенціал, що при співвідношенні сі/сe = 10, дорівнюватиме:
![]() .
.
Таким чином, дифузійний потенціал у
5–6 разів менший за концентраційний
потенціал Нернста (![]()
![]() мВ).
мВ).
У відсутності одного з іонів формула (6.43) для дифузійного потенціалу перетворюється в формулу (6.33) для рівноважного потенціалу Нернста. Крім того, при рівності рухливостей (так само, як і при рівності концентрацій) дифузійний потенціал стає рівним нулеві.
