
- •Тепловое излучение и его характеристики.
- •3.Законы Стефана-Больцмана и Вина.
- •Крушение классической теории излучения.
- •9.Великий парадокс.
- •10.Свободная частица.
- •11. Частица, заключенная в одномерном ящике.
- •15. Опыт Дэвиссона-Джермера
- •16. Принцип неопределенностей
- •[Править]Определение
- •17.Уравнение Шредингера
- •18. Линейный гармонический осциллятор
- •19. Атом водорода. Результаты спектроскопических исследований.
- •20. Гипотеза Бора о квантовании момента импульса
- •21. Энергетические состояния атома водорода.
- •22. Волны де Бройля в случае атома водорода
- •23. Момент импульса и спин. Эллиптические орбиты Зоммерфельда
- •24. Орбитальный магнитный момент
- •25.Спин электрона
- •26..Полный момент импульса
- •27.Фермионы и бозоны.
- •28. Волновые функции атома водорода
- •29. Систематика элементов
- •30. Принцип Паули
- •31. Лазеры
21. Энергетические состояния атома водорода.
Энергетические переходы с любого энергетического уровня на нижний образуют серию длин волн(частот) излучения.Длина излучения волн в сериях:
Подставляя в это уравнение n=2, Бор вычислил длины волн серии Бальмера. Производя расчеты для n’=3, он объяснил происхождение ряда инфракционных линий, открытых Пашеным. Он доказал, что изменение значения должны дать дополнительные спектральные серии. И действительно: Лайманом была найдена серия где n’=1, а в с1932 г были открыты серии для n’=4(Бреккета), n’=5(Пфунда)
Серия Лаймана – ультрафиолетовое излучение; серия Бальмера–видимый свет; серия Пашена – инфракрасное излучение.
Энергия электронов на этих энергетических состояниях показаны на диаграмме уровней энргии. Т. к. атом связан с ядром, то электрон - отрицательная энергия связи этого состояния.
22. Волны де Бройля в случае атома водорода
Было
установлено, что электромагнитному
излучению присущи не только волновые,
но и корпускулярные свойства. В 1924г де
Бройль высказал предположение о волновом
характере материи. Как только было
установлено, что электрону с импульсом
Р соответствует длина волны
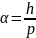 Длина электронных орбит равна: 2
Длина электронных орбит равна: 2 .
Она
содержит n
де Бройлевских волн электрона.
.
Она
содержит n
де Бройлевских волн электрона.
Почему же важно, чтоб на разрешённой орбите укладывалось целое число длин волн?
А) Волны могут интерферировать между собой. Если волне, чтобсовершить целое число колебаний требуется пройти путь S= 2Пr = длине окружности орбиты, то волна плавно перейдёт в саму себя и усилится.(рис а)
Б) Если длина волны не кратна 2Пr, то А-амплитуда быстро уменьшится до нуля.(рис 2)Т. о. гипотеза де Бройля объясняет предложенные Бором правила квантования момента импульса. Оно оказалось успешней Боровского. Несмотря на введение в теорию идеи де Бройля, модель атома Бора сохранила классический характер.
В ней предполагалось, что электроны движутся по орбите вокруг ядра, но никто не понимал, почему они не излучают энергию.
23. Момент импульса и спин. Эллиптические орбиты Зоммерфельда
Чтобы преодолеть трудность, возникшую в теории Бора при её применении в спектре щелочных металлов(Na, Li и др.), немец Зоммерфельд опубликовал работу, которая далее развивала теорию Бора. Бор в своей модели рассматривал только круговые орбиты. Но двигаясь по классической траектории – орбите, частица может описывать как круг, так и эллипс. Энергия частиц на каждой из таких орбит одинакова, а момент импульса различен.
Зоммерфельд
устранил зависимость момента импульса
от n.
n
определяет только энергию состояния,
а для характеристики орбитального
момента импульса вводится
 .
Орбитальный момент импульса квантуется,
где
может принимать только значения от 0 до
n-1.
.
Орбитальный момент импульса квантуется,
где
может принимать только значения от 0 до
n-1.
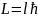
Т.
о. в модели Бора и Зоммерфельда имеется
нулевой момент импульса, связанный с
состоянием где n=1,
т.е.
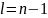
=0-S-состояние; =1 – P-состояние; =2 – D-состояние; =3 – F-состояние
Между
первонач теорией Бора, по которой в
основном состояние атомов водорода
=1,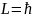 и теория Зоммерфельда, согласно которой
для этого состояния ,
и теория Зоммерфельда, согласно которой
для этого состояния ,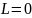 .
.
Но каким образом электрон может принять импульс =0?
По
класс теории электрон … но такая ситуация
не имеет физического смысла. Квантовая
теория искл об электронных орбитах и
поэтому предсказание для любого состояния
не является абсурдным. Было найдено,
что для основного состояния водорода
.
Величина проекции момента импульса
опред магнитно-квантовым числом
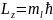
Обнаружить
различие в состоянии электрона в атоме,
определяемое
и
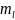 можно только в случае, если атом находится
во внешнем магнитном поле. В сильно
неоднородных магнитных полях была
обнаружена возможность двух различных
состояний электрона в атоме, не связанных
с квантовыми числами n,
и
.
В квантовой механике это различие
связано с собственным (а не орбитальным)
магнитным моментом электрона, названным
«спиновым». Спиновое квантовое число,
обозначенное ms,
может принимать квантовые значения
можно только в случае, если атом находится
во внешнем магнитном поле. В сильно
неоднородных магнитных полях была
обнаружена возможность двух различных
состояний электрона в атоме, не связанных
с квантовыми числами n,
и
.
В квантовой механике это различие
связано с собственным (а не орбитальным)
магнитным моментом электрона, названным
«спиновым». Спиновое квантовое число,
обозначенное ms,
может принимать квантовые значения
