
- •1 Основные кинематические величины
- •2 Движение по окружности
- •3 Криволинейное движение
- •4 Законы Ньютона
- •Первый закон Ньютона
- •Современная формулировка
- •Историческая формулировка
- •Второй закон Ньютона
- •Современная формулировка
- •Историческая формулировка
- •Третий закон Ньютона
- •Современная формулировка
- •Историческая формулировка
- •Комментарии к законам Ньютона Сила инерции
- •Законы Ньютона и Лагранжева механика
- •Решение уравнений движения
- •5 Принцип независимости действия сил
- •Момент импульса в классической механике
- •Определение
- •Вычисление момента
- •8 Центр масс
- •Определение
- •Центры масс однородных фигур
- •В механике
- •Центр масс в релятивистской механике
- •Центр тяжести
- •9 Степени свободы (механика)
- •Примеры
- •Движение и размерности
- •Системы тел
- •Определение степеней свободы механизмов
- •10 Момент силы
- •Общие сведения
- •Предыстория
- •Единицы
- •Специальные случаи Формула момента рычага
- •Определение
- •Вычисление момента
- •Сохранение углового момента
- •11 Динамика твердого тела
- •***Можно не читать!***Динамика твердого тела
- •12 Момент инерции
- •Теорема Гюйгенса-Штейнера
- •Осевые моменты инерции некоторых тел
- •Центральный момент инерции
- •13 Теорема Штейнера
- •Работа силы
- •15 Работа - потенциальная сила
- •Работа силы (сил) над одной точкой
- •Работа силы (сил) над системой или неточечным телом
- •Кинетическая энергия
- •История
- •Физический смысл
- •Физический смысл работы
- •Релятивизм
- •Соотношение кинетической и внутренней энергии
- •Потенциальная энергия
- •О физическом смысле понятия потенциальной энергии
- •Физическая абстракция
- •Абсолютно упругий удар
- •Абсолютно неупругий удар
- •Реальный удар
- •Гидростатическое давление
- •Дифференциальное уравнение Бернулли
- •Сила вязкого трения
- •Вторая вязкость
- •Вязкость жидкостей Динамический коэффициент вязкости
- •Кинематическая вязкость
- •Ньютоновские и неньютоновские жидкости
- •Относительная вязкость
- •Ламинарный и турбулентный режим течения жидкости
- •Вязкость. Ламинарные и турбулентные режимы течения
- •Траектория материальной точки
- •Описание траектории
- •Связь со скоростью и нормальным ускорением
- •Связь с уравнениями динамики
- •Траектория свободной материальной точки
- •Движение под действием внешних сил в инерциальной системе отсчёта
- •Движение под действием внешних сил в неинерциальной системе отсчёта
- •Сила инерции
- •Терминология
- •Реальные и фиктивные силы
- •Эйлеровы силы инерции
- •Ньютоновы силы инерции
- •Д’Аламберовы силы инерции
- •Сила инерции на поверхности Земли
- •Силы Второй закон Ньютона
- •Третий закон Ньютона
- •Движение в инерциальной со
- •Движение в неинерциальной со
- •Общий подход к нахождению сил инерции
- •Движение тела по произвольной траектории в неинерциальной со
- •Работа фиктивных сил инерции
- •Существование инерциальных систем отсчёта
- •Эквивалентность сил инерции и гравитации
- •Принцип относительности
- •История
- •Специальная теория относительности
- •Создание сто
- •Основные понятия и постулаты сто
- •Основные понятия
- •Синхронизация времени
- •Линейность преобразований
- •Согласование единиц измерения
- •Изотропность пространства
- •Принцип относительности
- •Постулат постоянства скорости света
- •***Более простой вариант*** Постулаты Специальной Теории Относительности (сто)
- •Преобразования Лоренца
- •Преобразования Лоренца в физике
- •Вид преобразований при коллинеарных (параллельных) пространственных осях
- •Вывод преобразований
- •Разные формы записи преобразований Вид преобразований при произвольной ориентации осей
- •Преобразования Лоренца в матричном виде
- •Свойства преобразований Лоренца
- •Следствия преобразований Лоренца Изменение длины
- •Относительность одновременности
- •Замедление времени для движущихся тел Связанные определения
- •История
- •Лоренцево сокращение
- •Строгое определение
- •Объяснение
- •Толкование
- •Значение для физики
- •Относительность промежутков времени
- •Интервал (теория относительности)
- •Определение
- •Инвариантность интервала в специальной теории относительности Используемые постулаты
- •Доказательство
- •Смысл знака квадрата интервала
- •Релятивистская механика
- •Общие принципы
- •Второй закон Ньютона в релятивистской механике
- •Функция Лагранжа свободной частицы в релятивистской механике
- •Релятивистская частица как неголономная система
- •Эквивалентность массы и энергии
- •Масса покоя как вид энергии
- •Понятие релятивистской массы
- •Гравитационное взаимодействие
- •Предельный случай безмассовой частицы
- •Количественные соотношения между массой и энергией
- •Примеры взаимопревращения энергии покоя и кинетической энергии
- •Термодинамическая система
- •Описание
- •Классификация
- •Термодинамические системы
- •Тепловой процесс
- •Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
- •4.2.4.Адиабатный процесс
- •4.2.5. Политропный процесс
- •Термодинамические величины
- •Функции состояния
- •Функции процесса
- •Идеальный газ
- •Классический идеальный газ
- •Применение теории идеального газа Физический смысл температуры газа
- •Распределение Больцмана
- •Адиабатический процесс
- •Уравнение состояния идеального газа
- •Основное уравнение мкт
- •Вывод основного уравнения мкт
- •Уравнение среднеквадратичной скорости молекулы
- •Асчёт скорости движения молекул. Введение. Температура, как мера средней кинетической энергии молекул
- •Среднеквадратичная скорость движения молекул.
- •Распределение Максвелла
- •Распределение Максвелла Распределение по вектору импульса
- •Границы применимости
- •Условия классического рассмотрения
- •Барометрическая формула
- •Закон Стефана — Больцмана
- •Теплопроводность
- •Закон теплопроводности Фурье
- •Коэффициент теплопроводности вакуума
- •Связь с электропроводностью
- •Коэффициент теплопроводности газов
- •Обобщения закона Фурье
- •Коэффициенты теплопроводности различных веществ
Применение теории идеального газа Физический смысл температуры газа
Так
как давление молекул на стенку газа
определяется по формуле
![]() ,
где
,
где
![]() -
средняя кинетическая энергия
поступательного движения молекул газа.
Подставив это в уравнение Менделеева
— Клапейрона получаем, что температура
пропорциональна
.
-
средняя кинетическая энергия
поступательного движения молекул газа.
Подставив это в уравнение Менделеева
— Клапейрона получаем, что температура
пропорциональна
.
Распределение Больцмана
Равновесное распределение частиц классического идеального газа по состояниям следует из уравнения Менделеева — Клапейрона, из которого можно вывести распределение газа в поле потенциальной энергии. Это распределени приводит к распределению Больцмана:
![]()
где
![]() —
среднее число частиц, находящихся в
-ом
состоянии с энергией εj, а
константа
—
среднее число частиц, находящихся в
-ом
состоянии с энергией εj, а
константа
![]() определяется
условием нормировки:
определяется
условием нормировки:
![]()
где
![]() —
полное число частиц.
—
полное число частиц.
Распределение Больцмана является предельным случаем (квантовые эффекты пренебрежимо малы) распределений Ферми — Дирака и Бозе — Эйнштейна, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа.
Адиабатический процесс
C помощью модели идеального газа можно предсказать изменение параметров состояния газа при адиабатическом процессе. Перепишем уравнение в виде:
![]()
Продифференцировав обе части, получаем:
![]()
Затем, если подставить в это уравнение значение работы и внутренней энергии газа, получим Уравнение Пуассона.
41
Уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
— давление,
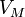 —
молярный
объём,
—
молярный
объём,— универсальная газовая постоянная
— абсолютная температура,К.
Так
как
![]() ,
где
,
где
![]() —
количество
вещества, а
—
количество
вещества, а
![]() ,
где
—
масса,
—
молярная
масса, уравнение состояния
можно записать:
,
где
—
масса,
—
молярная
масса, уравнение состояния
можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон Шарля
(второй закон Гей-Люссака, 1808 г.)
—
закон Шарля
(второй закон Гей-Люссака, 1808 г.)
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
![]()
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
![]()
— закон Бойля — Мариотта.
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
p = (γ − 1)ρε,
где
![]() —
показатель
адиабаты,
—
показатель
адиабаты,
![]() —
внутренняя энергия единицы массы
вещества.
—
внутренняя энергия единицы массы
вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С
другой стороны, в сильно сжатом и,
следовательно, более плотном газе
молекулы заметно притягиваются к другим
молекулам гораздо большую часть времени,
чем молекулы в разреженном газе. Это,
наоборот, уменьшает число ударов молекул
в стенку, так как при наличии притяжения
к другим молекулам молекулы газа движутся
по направлению к стенке с меньшей
скоростью, чем при отсутствии притяжения.
При не слишком больших давлениях более
существенным является второе обстоятельство
и произведение
![]() немного
уменьшается. При очень высоких давлениях
большую роль играет первое обстоятельство
и произведение
увеличивается.
немного
уменьшается. При очень высоких давлениях
большую роль играет первое обстоятельство
и произведение
увеличивается.
42 Молекулярно-кинетическая теория
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основными доказательствами этих положений считались:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
В современной (теоретической) физике термин молекулярно-кинетическая теория уже не используется, хотя он встречается в учебниках по курсу общей физики. В современной физике МКТ заменила кинетическая теория, в русскоязычной литературе — физическая кинетика, и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения.
