
Кругляк_Прогнозирование_свойств_молекулярных_веществ._Критические свойства фреонов-2018_171_стр_обложки
.pdf
IRC, а.е.м.1/2 • бор
Рис. 21. Ход внутренней координаты реакции при элиминировании атома фтора в процессе распада (6.8) через переходное состояние TS2.
Рис. 22. Относительная диаграмма изменения энергии в особых точках обоих каналов распада (6.7) и (6.8) в режиме расчета CCSD(T)/6-311++G(3df,3pd) на геометрии частиц, оптимизированных в режиме DFT/B3LYP/6-311++G(d,p), ккал/моль.
110
Для вычисления поправки на туннелирование использовалось приближенное выражение Вигнера [135]
2
(T ) 1 1 h # , (6.10)
24 kT
где # – мнимая частота в седловой точке. Величина (T ) оказалась близкой к единице.
Константа скорости для распада радикала CH3CF2O• по связи С–С получилась равной 1.3•104 с–1 при 298 К и давлении в 1 атм. Экспериментальное значение для этой конкретной реакции (6.7) все еще не известно. Для реакции (6.8) элиминирования атома фтора константа скорости при тех же условиях равна 4.4•10–8 с–1.
6.2.1.3. HFC-125
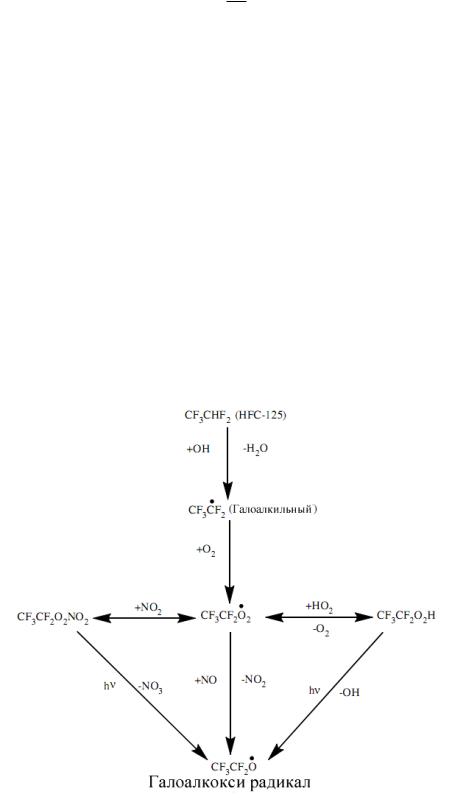
Фреон CF3CHF2 / HFC-125 характеризуется значением ODP = 0 и рекомендуется вместо Halon-1301, который использовался как средство для пожаротушения. HFC-125 применяется также как хладагент в холодильной технике. Механизм его деградации в тропосфере показан схематически на рис. 23.
Рис. 23. Механизм деградации HFC-125 в тропосфере.
111
При атаке гидроксильными радикалами в атмосфере образуются галоалкильные радикалы, которые при взаимодействии с кислородом образуют перокси радикалы. Последние взаимодействуя с NOx (x = 1, 2) или с другими перокси радикалами и в конечном итоге образуют галоалкокси радикалы, которые играют важную роль в механизме деградации органических соединений в тропосфере [109].
Ранее термолиз CF3CF2O•, CF3CFHO• и CF3CH2O• рассчитывался вплоть до констант скоростей распада радикалов по связи С–С методом
DFT/B3LYP/cc-pVTZ(+1)/ G3(MP2) [136]. Более детальное исследование двух каналов распада радикала CF3CF2O• по связи С–С
CF3CF2O• → CF3• + CF2O |
(6.11) |
и с элиминированием атома фтора |
|
CF3CF2O• → CF3С(О)F + F |
(6.12) |
проведено в [137] теми же расчетными методами, что и в предыдущем рассмотрении (§ 6.2.2).
Два доминирующих пути распада (6.11) и (6.12) включают переходные состояния TS1 и TS2 и показаны они на рис. 24.
Расчет хода внутренней координаты реакции IRC (рис. 25) плавно связывает переходные состояния с исходными реагентами и продуктами реакций (6.11) и (6.12). В переходном состоянии TS1 длина связи C1–C2 увеличивается от 1.61 до 1.94 Å с одновременным уменьшением длины связи С2–О7 от 1.32 до 1.22 Å с образованием двойной связи С=О. В переходном состоянии TS2 связь C2–F8 увеличивается от 1.36 до 1.97 Å с одновременным сокращением связи С2–О7 до двойной длины 1.21 Å.
Диаграмма изменения энергии по ходу реакций (6.11) и (6.12) показана на рис. 26. Очевидно, что доминирующим процессом распада радикала CF3CF2O• в атмосфере является диссоциация по связи C–C.
Константа скорости для распада радикала CF3CF2O• по связи С–С получилась равной 6.4•106 с–1 при 298 К и давлении в 1 атм. Для реакции (6.12)
элиминирования атома фтора константа скорости при тех же условиях равна
7.0•10–10 с–1.
112
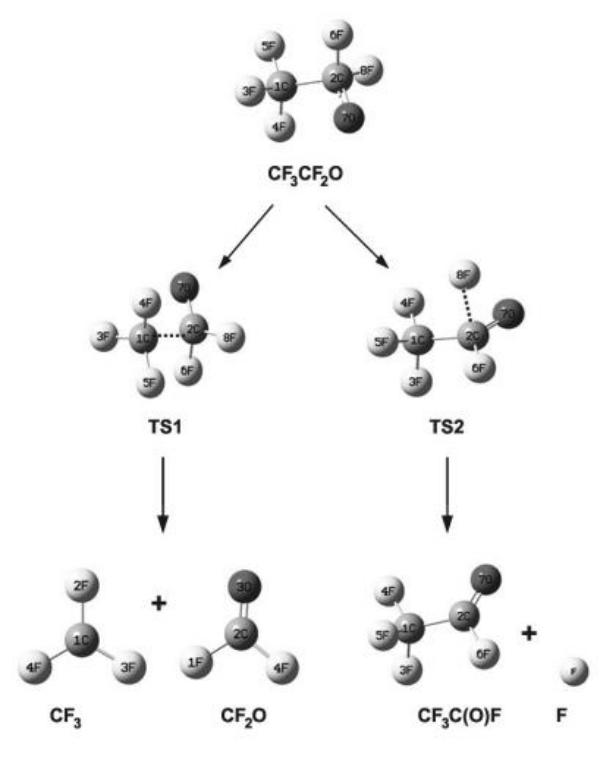
Рис. 24. Два канала распада галоалкокси радикала CH3CF2O• (6.11) и (6.12). Показаны оптимальные геометрии частиц.
В переходных состояниях TS1 C1•••C2 = 1.94 и TS2 C2•••F8 = 1.97 Å.
113

IRC, а.е.м.1/2 • бор
Рис. 25. Ход внутренней координаты реакции в процессе распада (6.11) через переходное состояние TS1 (слева) и при элиминировании атома фтора в процессе распада (6.12) через переходное состояние TS2.
Рис. 26. Относительная диаграмма изменения энергии в особых точках обоих каналов распада (6.11) и (6.12) в режиме расчета G2(MP2) на геометрии частиц, оптимизированных в режиме DFT/B3LYP/6-311++G(d,p), ккал/моль.
114
6.2.1.4. HCFC-123
Упомянем также, что аналогичными методами были рассчитаны также фреоны HCFC-123 и HCFC-141b.
Фреон 1,1,1-трифторо-2,2-дихлороэтан / HCFC-123 используется как чистящее средство в электронике, в качестве пенообразующего при тушении пожаров и как хладагент в установках кондиционирования вместо CFC-11 и
CFC-12 (табл. 29).
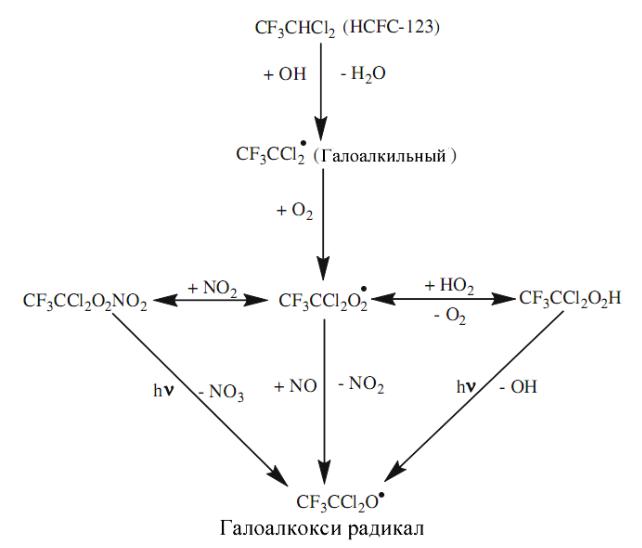
Схемы деградации HCFC-123 в тропосфере до галоалкокси радикала CF3CCl2O• аналогичны распадам других этаноподобных фреонов, рассмотренных выше (рис. 27).
Рис. 27. Механизм деградации HCFC-123 в тропосфере.
115
Термолиз подобных галоалкокси радикалов уже рассчитывался ранее [136, 138 – 140]. Более детальное исследование двух каналов распада радикала CF3CCl2O• по связи С–С
CF3CCl2O• → CF3• + CCl2O |
(6.13) |
и с элиминированием атома хлора |
|
CF3CCl2O• → CF3С(О)Cl + Cl |
(6.14) |
проведено в [141] теми же расчетными методами, что и в предыдущем рассмотрении (§ 6.2.1.3).
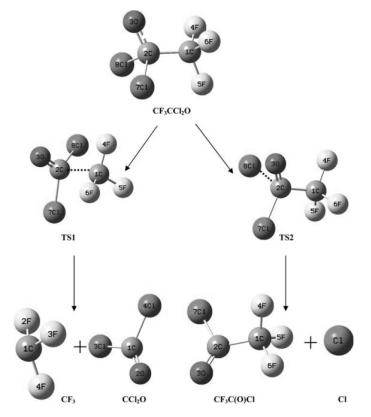
Оптимизированные геометрии исходного радикала CF3CCl2O•, продуктов распада по каналам (6.13) и (6.14) и соответствующих переходных состояний TS1 и TS2 показаны на рис. 28, вслед за которым дается относительная диаграмма изменения энергии в особых точках обоих каналов распада, из которой следует, что доминирующим процессом распада CF3CCl2O• является канал с выделением свободного атома хлора, который и инициирует распад молекул озона.
Рис. 28. Оптимизированные геометрии исходного радикала CF3CCl2O•, продуктов распада по каналам (6.13) и (6.14) и соответствующих переходных состояний TS1 и TS2, полученные методом DFT/B3LYP/6-311/G(d,p).
116

Рис. 29. Относительная диаграмма изменения энергии в особых точках обоих каналов распада (6.13) и (6.14) в режиме расчета G2М(СС,MP2) на геометрии частиц, оптимизированных в режиме DFT/B3LYP/6-311/G(d,p), ккал/моль.
6.2.1.5. HCFC-141b
Фреон 1,1-дихлоро-1-фтороэтан / HCFC-141b используется как подходящая замена CFC-11 и CFC-113 – наиболее широко используемых CFC в промышленности в качестве чистящих и пенообразующих реагентов, в частности, при пенной полиуретановой защите (табл. 29).
В стратосфере основной причиной исчезновения HCFC-141b является фотолиз CH3CFCl2 с дальнейшим взаимодействием продуктов распада с кислородом. Согласно фотолитическим и масс-спектрометрическим данным [142], фотодиссоциация происходит в основном по связи C–Cl согласно реакции
CH3CFCl2 + h → CH3CFCl• + Cl. |
(6.15) |
Образовавшийся галоалкильный радикал вступает в реакцию с атмосферным молекулярным кислородом с образованием пероксирадикала
CH |
CFCl• + О → CH |
CFClО •, |
(6.16) |
|
3 |
2 |
3 |
2 |
|
|
117 |
|
|
|

димеризация которого возвращает молекулу кислорода с образованием галоалоксирадикала
2 CH3CFClО2• → 2 CH3CFClО• + О2. |
(6.17) |
Квантовохимически рассчитаны следующие наиболее вероятные реакции распада галоалоксирадикала CH3CFClО• с разрывом связи С–С и с выделением атомарных хлора и водорода [143]:
|
|
C(O)FCl |
|
CH3 , |
(6.18) |
|
|
||||
CH3CFClО• → |
|
CH C(O)F |
|
Cl, |
(6.19) |
|
|
3 |
|
|
|
|
CH2C(O)FCl |
|
H. |
(6.20) |
|
|
|
|
|
|
|
Оказалось, что реакция (6.20) |
эндотермическая ( H 0 38.29 ккал /моль ) и |
||||
|
|
|
|
298 |
|
поэтому она менее вероятна по сравнению с экзотермическими реакциями (6.18) и (6.19), для которых энтальпии равны соответственно 4.29 и19.85 ккал /моль . На это указывают также изменения свободной энергии: для
реакции (6.20) G0 |
31.55 ккал /моль , а для (6.18) и |
(6.19) G0 |
15.54 и |
|
|
298 |
|
298 |
|
G0 |
28.79 ккал /моль , соответственно. Поэтому |
вероятными |
каналами |
|
298 |
|
|
|
|
распада остаются реакции (6.18) и (6.19).
Оптимизированные геометрии исходного радикала CH3CFClО•, продуктов распада по каналам (6.18) и (6.19) и соответствующих переходных состояний TS1 и TS2 показаны на рис. 30, вслед за которым дается относительная диаграмма изменения энергии в особых точках обоих каналов распада, из которой следует, что доминирующим процессом распада CH3CFClО• является канал с выделением свободного атома хлора, который и инициирует разложение молекул озона.
Доминирование реакции распада (6.19) с выделением атомарного хлора по сравнению с реакцией распада по связи С–С (6.18) следует из того факта, что высота барьера в первом случае составляет всего 3.6 ккал/моль, тогда как в канале (6.18) барьер в 10.0 ккал/моль в три раза больше. Константы скоростей реакций выделения свободного хлора и распада по связи С–С составляют соответственно 2.9 108 и 4.3 105 с–1 при 298 К и давлении в 1 атм.
6.2.1.6. HFE
В заключение отметим, что многочисленные исследования HFC и HCFC в качестве замены CFC показывают их все же недостаточную эффективность на
118

практике. На замену им приходят HFE (HydroFluoroEthers) [144 – 146].
Отсутствие атомов хлора в HFE служит гарантией того, что такие фторсодержащие эфиры характеризуются пренебрежимо малыми значениями ODP и не окажут влияния на стратосферный озон. Высокоточные расчеты тропосферной деградации различных HFE можно найти в [147 – 150].
Рис. 30. Оптимизированные геометрии исходного радикала CH3CFClО•, продуктов распада по каналам (6.18) и (6.19) и соответствующих переходных состояний TS1 и TS2, полученные методом UMP2(full)/6-311/G(d,p).
119
