
- •Введение
- •Лабораторная работа 1 Дегидрирование н-бутана в импульсном режиме
- •Показатели процесса определяют по формулам:
- •Лабораторная работа 2 Дегидрирование этилбензола в стирол
- •Лабораторная работа 3 Получение изопрена из изобутилена и формальдегида
- •Определение формальдегида в водном слое
- •Определение степени ненасыщенности органического слоя
- •Лабораторная работа 4 Получение фенола и ацетона из изопропилбензола
- •Окисление изопропилбензола в гидропероксид
- •Разложение гидропероксида изопропилбензола в фенол и ацетон
- •Определение содержания гидропероксида изопропилбензола
- •Лабораторная работа 5 Эпоксидирование -олефинов с8 – с10 гидропероксидом этилбензола
- •Определение содержания гидропероксида этилбензола
- •Определение содержания эпоксидных групп
- •Лабораторная работа 6 Синтез алкилированных фенолов на катионообменной смоле
- •Лабораторная работа 7 Синтез алкилтреталкилового эфира
- •Лабораторная работа 8 Очистка углеводородного сырья от сернистых соединений каталитическим окислением кислородом воздуха
- •Библиографический список
- •Технология нефтехимического синтеза Методические указания к лабораторному практикуму
- •420015, Казань, к. Маркса, 68
Лабораторная работа 4 Получение фенола и ацетона из изопропилбензола
Процессы окисления углеводородов относятся к одним из важнейших методов получения кислородсодержащих и других соединений, получаемых в процессах окисления. Таким образом получают мономеры, растворители, промежуточные продукты нефтехимического и органического синтеза и др. К реакциям окисления способны все классы углеводородов и их производные.
Процессы окисления проводят в газовой или жидкой фазе с использованием инициаторов и катализаторов. В качестве окислителей применяют воздух, технический кислород, азотную кислоту, органические гидропероксиды, надкислоты, гидропероксид водорода и др. Инициаторами окисления служат ультрафиолетовый свет, органические гидропероксиды и т.д., в качестве катализаторов - металлы Ag, Cu, оксиды металлов и их смеси Cu2O, V2O5, Bi2O3MoO3, соли металлов переменной валентности Co, Mn, Cu, Pd.
Условия окисления подбирают таким образом, чтобы при максимально высокой конверсии исходного сырья обеспечить высокую селективность процесса по целевым продуктам.
В зависимости от условий процесса и строения исходного соединения могут образовываться различные кислородсодержащие продукты - гидропероксиды, спирты, кетоны, кислоты и т.д. вплоть до диоксида углерода и воды.
Фенол и ацетон являются многотоннажными продуктами органического синтеза, находящими широкое использование. Так, фенол применяется при производстве фенолформальдегидных смол, пластических масс, поверхностно-активных веществ, синтетических волокон, лекарственных препаратов и т.д.
Основным промышленным методом получения фенола является процесс окисления изопропилбензола в гидропероксид с последующим разложением гидропероксида в фенол и ацетон.
Процесс состоит из двух основных стадий:
-
окисление изопропилбензола в гидропероксид:
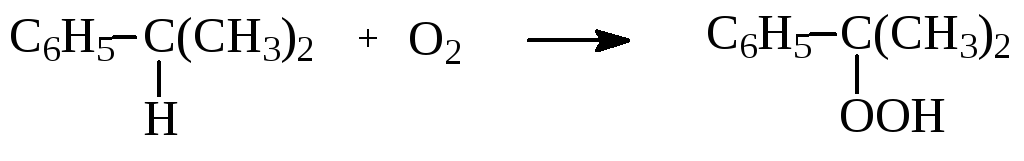
-
разложение гидропероксида изопропилбензола в фенол и ацетон:
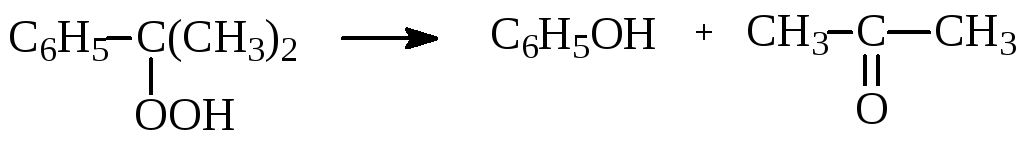
Окисление изопропилбензола в гидропероксид
В промышленности изопропилбензол окисляют в гидропероксид (ГПИПБ) кислородом воздуха в тарельчатых колоннах непрерывного действия. Для устранения индукционного периода к изопропилбензолу, поступающему на окисление, добавляют до 1 % ГПИПБ и ведут окисление при 105-120 °С и 0,4 МПа. Повышение температуры ведет к ускорению процесса образования ГПИПБ, но одновременно усиливает реакцию его разложения, и при температуре выше 120 °С реакция разложения может принять взрывной характер. Время реакции подбирают таким образом, чтобы конверсия изопропилбензола не превышала 30-35 %. При этом селективность по ГПИПБ достигает 90 %.
В процессе окисления образуются побочные продукты, главным образом, ацетофенон и диметилфенилкарбинол, образующиеся в результате дальнейших превращений ГПИПБ и гидропероксидного радикала:
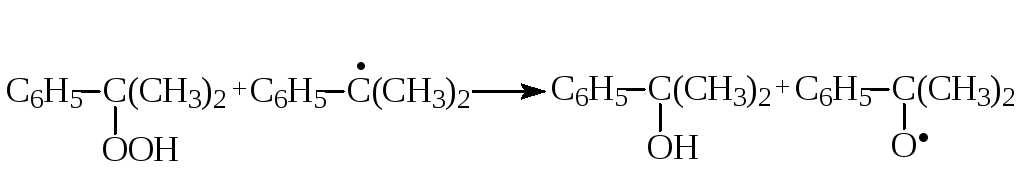

Разложение гидропероксида изопропилбензола в фенол и ацетон
ГПИПБ, как и другие органические гидропероксиды, легко распадается под действием небольших количеств (0,05-0,1 % мас.) сильных кислот с образованием фенола и ацетона с выделением большого количества тепла.
Разложение идет по сложному механизму ионного типа:

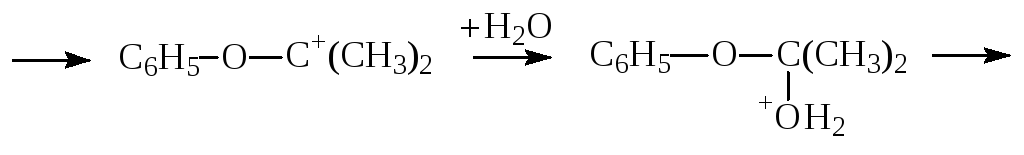
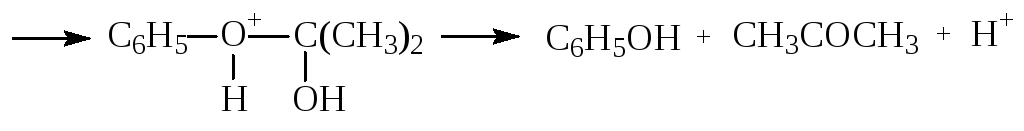
Побочные продукты, которые образуются при получении ГПИПБ, под действием кислот также претерпевают ряд превращений. Наиболее значимыми из них являются реакции диметилфенилкарбинола:
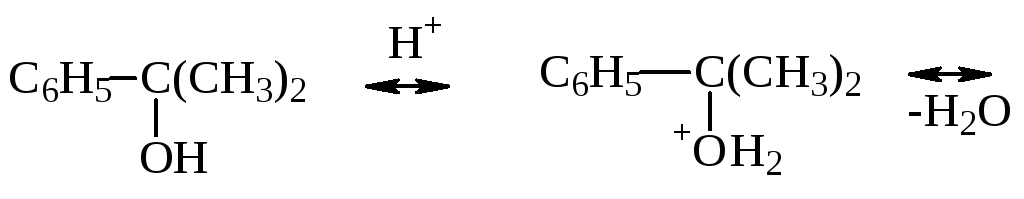

С повышением температуры и концентрации кислоты усиливаются не только побочные реакции, но и возникает опасность в неконтролируемом разложении ГПИПБ. Поэтому разлагают только разбавленные растворы ГПИПБ при 50-60 °С и концентрации серной кислоты 0,05-0,1 % мас.
Цель работы: изучение процесса получения фенола и ацетона разложением гидропероксида изопропилбензола.
Реактивы:
1) гидропероксид изопропилбензола, 15%-ный раствор в изопропилбензоле;
2) изопропилбензол (d420 =0,8618);
3) серная кислота концентрированная (d420 =1,831);
4) ледяная уксусная кислота;
5) 50 %-ный водный раствор йодистого калия;
6) 0,1 н раствор тиосульфата натрия;
7) 5%-ный водный раствор крахмала;
8) 0,5 н раствор гидроксиламина солянокислого;
9) 0,1 н раствор гидроксида натрия;
10) индикатор бромфеноловый синий.
Посуда и оборудование: четырехгорлый реактор на 100 мл; капельная воронка на 50 мл; стеклянная мешалка двухлопастная; обратный холодильник; термометр; термостат нагнетающий или водяная баня, снабженная контактным термометром с электрореле; механическая мешалка с электромотором и ЛАТРом; микропипетки на 1 мл - 3 штуки; мерный цилиндр на 25 мл; мерный цилиндр на 10 мл; конические колбы на 250 мл - 3 штуки; конические колбы на 100 мл - 3 штуки; бюретки для титрования - 2 штуки.
Выполнение работы
Разложение ГПИПБ проводят на установке, изображенной на рис. 4. Перед началом опыта проверяют правильность сборки, герметичность всех соединений, работу термостата и механической мешалки. В реактор загружают 25 мл изопропилбензола, 0,15 мл концентрированной серной кислоты. Включают подачу воды в обратный холодильник, механическую мешалку и термостат (обогрев бани и электрореле). Процесс проводят при температуре 50 °С, которую поддерживают с точностью до 0,5 °С. Внимание!!! Строго следить за поддержанием точной температуры во избежание ускорения разложения ГПИПБ, способного привести к взрыву.
Внимание!!! Строго соблюдать порядок ввода реагентов в реакционную колбу.
По достижении заданной температуры и при энергичном перемешивании к раствору серной кислоты в изопропилбензоле из капельной воронки осторожно прибавляют 50 мл 15 %-ного раствора ГПИПБ. По окончании прибавления ГПИПБ каждые 30 минут отбирают по две пробы реакционной массы (по 1 мл) и анализируют на содержание в ней гидропероксида. Концентрацию ГПИПБ в пробах определяют иодометрически.
Если по истечении 1,5 часов разложение ГПИИПБ не завершится, то к реакционной массе добавляют еще 0,25 мл концентрированной серной кислоты и продолжают опыт до полного разложения ГПИПБ.
Результаты анализов и вычислений записывают в табл. 4.
По окончании опыта содержимое реактора охлаждают до комнатной температуры, определяют объем, массу и анализируют на содержание ацетона. Все операции проводят таким образом, чтобы свести к минимуму потери ацетона за счет улетучивания.
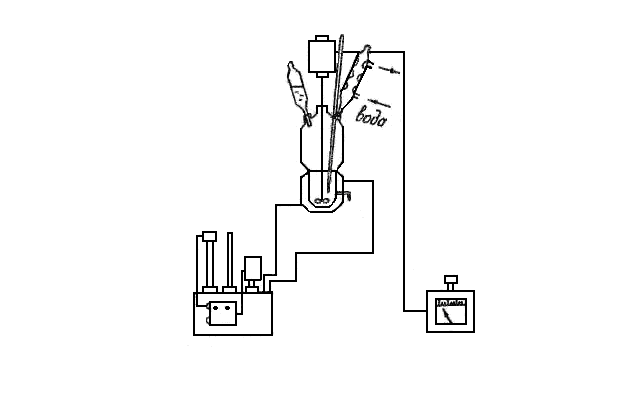
Рис.4. Установка для разложения гидропероксида изопропилбензола
|
№ пробы |
Время отбора пробы, мин |
Масса пробы, г |
Объем 0,1н раствора тиосульфата натрия, пошедший на титрование пробы, мл |
Объем 0,1н раствора тиосульфата натрия, пошедший на титрование холостого опыта, мл |
Концентрация ГПИПБ, % мас. |
|
|
|
|
|
|
|
Составляют материальный баланс опыта (табл.5).
Таблица 5. Материальный баланс опыта
|
Наименование компонентов |
Приход, г |
Получено, г |
|
ГПИПБ |
|
|
|
Фенол |
- |
|
|
Ацетон |
- |
|
Селективность процесса, % мол.
по фенолу-
по ацетону-
М![]() ассу
ацетона, образовавшегося в результате
разложения ГПИПБ, рассчитывают по
формуле:
ассу
ацетона, образовавшегося в результате
разложения ГПИПБ, рассчитывают по
формуле:
i
где: Ga -масса ацетона, г ; Gpm - масса реакционной массы, выгруженной из реактора, г; Ха- массовая доля ацетона в продуктах реакции; Gi - масса i пробы, г; n- число проб.
Массу полученного фенола определяют как разницу между количеством ГПИПБ, взятого в реакцию, и количеством полученного ацетона.
Обсуждают данные, полученные в работе, и формулируют свои выводы по работе.
Анализ реакционной массы на содержание ацетона
В две конические колбы на 250 мл с притертыми пробками наливают 25 мл 0,5 н раствора гидроксиламина солянокислого, приливают по 5 капель индикатора бромфенолового синего и нейтрализуют 0,1 н раствором гидроксида натрия до появления синей окраски раствора. Затем добавляют пипеткой по 1 мл реакционной массы, закрывают пробки, встряхивают в течение 20 минут и оттитровывают выделившуюся соляную кислоту 0,1 н раствором гидроксида натрия до появления синей окраски.
Параллельно определяют количество 0,1 н раствора гидроксида натрия, необходимое для нейтрализации серной кислоты, содержащейся в 1 мл реакционной массы (холостой опыт). Для этого в коническую колбу на 250 мл с притертой пробкой наливают 25 мл дистиллированной воды, приливают 5 капель индикатора бромфенолового синего и 1 мл реакционной массы и при встряхивании нейтрализуют 0,1 н раствором гидроксида натрия до появления синей окраски.
Глубина окраски раствора при всех титрованиях должна быть одинакова.
Содержание ацетона (X, % маc.) в реакционной массе вычисляют по формуле:
X=[a-(b+c)]K·0,00695/V,
где: а - объем 0,1 н раствора NaOH, пошедший на титрование пробы с ацетоном, мл; b - объем 0,1 н раствора NаОН, пошедший на титрование солянокислого гидроксиламина, мл; с - объем 0,1 н раствора NаОН, пошедший на титрование 1 мл реакционной массы, мл; К - поправка на 0,1 н раствор NаОН; 0,00695 - число граммов ацетона, соответствующее 1 мл 0,1 н раствора NаОН; V - объем реакционной массы, взятый на анализ, мл.
