
- •Часть II
- •Введение
- •Порядок и правила взвешивания
- •Проверка вместимости мерной посуды - колб, пипеток. Проверка калибровки бюретки.
- •Основные этапы работы
- •Лабораторная работа № 2 Кислотно-основное титрование. Метод нейтрализации
- •I. Стандартизация раствора соляной кислоты
- •II. Определение массы щелочи в анализируемом растворе
- •III. Раздельное определение едких щелочей и карбонатов в анализируемой смеси
- •IV. Стандартизация раствора гидроксида натрия (калия)
- •V. Определение массы фосфорной кислоты в растворе
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 3 Редокс титрование. Перманганатометрия
- •Приготовление стандартного раствора щавелевой кислоты (или оксалата натрия)
- •II. Стандартизация раствора перманганата калия
- •Определение массы железа (II) в растворе соли мора
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 4 йодометрия и йодиметрия
- •I. Стандартизация раствора тиосульфата натрия
- •II. Определение содержания аскорбиновой кислоты
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 5 броматометрия
- •Приготовление стандартного раствора бромата калия
- •II. Определение содержания стрептоцида
- •Нитритометрия
- •I. Стандартизация раствора нитрита натрия
- •II. Определение содержания стрептоцида
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 6 комплексонометрия
- •I. Стандартизация раствора трилона б
- •II. Определение содержания кальция в фармпрепаратах
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 7 осадительное титрование. Тиоцианатометрия
- •I. Стандартизация раствора тиоцианата аммония или калия
- •II. Определение содержания серебра
- •Вопросы для контроля усвоения темы
- •Приложение коэффициенты распределения стьюдента
- •Значения q для исключения сомнительных результатов
- •Содержание
Лабораторная работа № 4 йодометрия и йодиметрия
Цель изучения данной темы:
Освоить определение содержания веществ йодометрическим методом.
В йодометрическом и йодиметрическом методах все определения связаны с выделением (окислением) или поглощением (восстановлением) йода:
2J 2ē J2
J2 + 2ē 2J.
О количестве определяемого вещества судят по количеству прореагировавшего йода.
Этими методами определяют многие химические соединения и лекарственные препараты, например: перманганат калия, арсенат натрия, хлорид ртути (I), сульфат меди, формалин, анальгин, антипирин, аскорбиновую кислоту, аминокислоты, фурацилин, кофеин, димедрол, некоторые алкалоиды и антибиотики, фенол и др.
Основным рабочим раствором в йодометрии являются растворы тиосульфата натрия, а в йодиметрии – раствор йода.
В данном методе применяют как прямое титрование (раствором йода), так обратное (для определения восстановителей, медленно реагирующих с йодом) и заместительное (для определения окислителей – титруют раствором тиосульфата натрия).
Йод мало растворим в воде, поэтому его растворяют в растворе йодида калия. Титрование восстановителей раствором йода можно вести как в кислой, так и в нейтральной или слабощелочной среде в зависимости от характера восстановителя. В сильнощелочной среде титрование йодом невозможно, так как при рН выше 9 протекает реакция:
2NaOH + J2 NaJO + NaJ + H2O.
При определении окислителей к ним добавляют раствор йодида калия, а выделившийся йод связывают тиосульфатом натрия.
J2 + 2ē 2J
2S2O32 2ē S4O62
![]()
Тиосульфат натрия не отвечает требованиям, предъявляемым к первичным стандартам, поэтому сначала готовят его раствор с молярной концентрацией эквивалента приблизительно 0,0200 моль/л на прокипяченной дистиллированной воде и оставляют на 8-14 дней в темной бутыли без доступа света и воздуха. После этого устанавливают молярную концентрацию эквивалента раствора тиосульфата натрия.
Первичным стандартом для определения молярной концентрации эквивалента раствора тиосульфата натрия является дихромат калия, из которого и приготавливают стандартный раствор с C(1/6 K2Cr2O7) = 0,0200 моль/л.
Для приготовления раствора дихромата калия с C(1/6 K2Cr2O7) = 0,0200 моль/л взвешивают на аналитических весах навеску, рассчитанную для объема 200 или 250 мл, переносят ее в мерную колбу, растворяют в небольшом количестве воды и полученный раствор доводят до метки дистиллированной водой.
I. Стандартизация раствора тиосульфата натрия
Материальное обеспечение:
-
Аналитические демпферные весы с разновесами.
-
Мерные колбы, Vном. = 200 или 250 мл.
-
Мерные пипетки, Vном. = 10 мл.
-
Мерные пипетки, 25 мл.
-
Мерные бюретки, 0-25 мл.
-
Промывалки с дистиллированной водой.
-
Конические колбы для титрования.
-
Химические воронки 40-50 мм.
-
Стаканчики под слив.
-
Предметные стекла.
-
Фильтровальная бумага.
-
K2Cr2O7, кристалл.
-
Раствор Na2S2O3 неизвестной концентрации.
-
Раствор йодида калия с С (KJ) = 0,2 моль/л.
-
Раствор серной кислоты с C (1/2 H2SO4) = 2 моль/л.
-
Раствор крахмала 0,1% масс.
Этот способ основан на реакциях:
|
1 |
|
|
3 |
|
__________________________________________________________
![]()
Выделившийся йод титруют раствором тиосульфата натрия, применяя в качестве индикатора раствор крахмала. В колбу для титрования помещают пипеткой 10 мл раствора дихромата калия, добавляют 5 мл раствора йодида калия с С (KJ) = 0,2 моль/л, 5 мл серной кислоты с C (1/2 H2SO4) = 2 моль/л и колбу закрывают предметным стеклом. Через 2-3 минуты выделившийся йод титруют раствором тиосульфата натрия до светло-желтой окраски, затем добавляют 5 капель раствора крахмала и продолжают титровать до исчезновения синей окраски. Расчет молярной концентрации эквивалента раствора тиосульфата натрия производят по формуле:
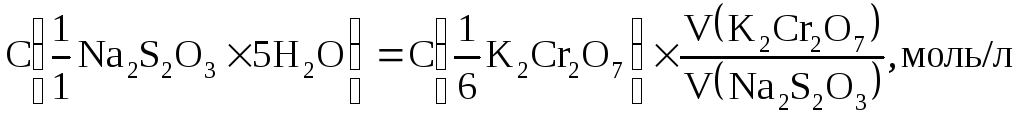
где: C(1/6 K2Cr2O7) – молярная концентрация эквивалента раствора дихромата калия, моль/л;
V(K2Cr2O7) – объем раствора дихромата калия, взятый на титрование, мл;
V(Na2S2O3) – объем раствора тиосульфата натрия, пошедший на титрование раствора дихромата калия, мл.
