
9.4 Фазовое равновесие
Равновесие, при котором происходят процессы перехода вещества из одной фазы в другую без изменения химического состава, называется фазовым равновесием:
плавление
Т вердое
вещество жидкость
вердое
вещество жидкость
кристаллизация
испарение
Ж идкость
пар
идкость
пар
конденсация
Условием фазового равновесия является равенство энергии Гиббса нулю G=0.
Для фазового равновесия соблюдается принцип Ле Шателье.
Выбор параметров, влияющих на равновесие данной гетерогенной системы и условием равновесия определяется ПРАВИЛОМ ФАЗ. Это наиболее общий закон гетерогенного химического и фазового равновесия. Правило фаз Гиббса – Коновалова:
Число степеней свободы в гетерогенной системе равно числу компонентов, плюс число внешних условий и минус число фаз:
С = К + 2 — Ф , (9.8)
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз.
Компонентом называется химически однородная составная часть вещества, которая может быть выделена из системы.
В случае фазового равновесия число независимых компонентов равно общему числу компонентов.
Например: смесь О2 и N2 – двухкомпонентная.
При протекании химических реакций число независимых компонентов равно общему числу компонентов за вычетом числа химических реакций, связывающих эти компоненты.
СО2+С=2СО к=3 – 1 = 2
Числом степеней свободы С называется число внешних условий, которые можно изменить в определенных пределах без изменения числа и вида фаз.
На фазовое равновесие влияют t, p, то n=2, тогда: С=к+2-Ф.
Фазовая диаграмма (диаграмма состояния) - диаграмма, по которой можно определить условия устойчивости фаз и фазового равновесия.

Для однокомпонентных систем:
С = 3 - Ф .
Однофазовые системы имеют две степени свободы и называются бивариантными.
Двухфазовые системы имеют одну степень свободы и называются моновариантной.
Трехфазовая система не имеет степеней свободы (С=0) и называются инвариантной.
Фазовая диаграмма воды (рисунок 10.2):
ОС – равновесие процесса кипения;
точка «С» - критическая точка; выше точки «С» - сверхкритическое состояние: низкая вязкость, высокая диффузионная активность.
ОВ – кривая плавления;
ОА – процесс сублимации;
ОД – метастабильное состояние (переохлаждение);
точка О – тройная точка, существует равновесие между тремя фазами.
9.5 Адсорбционное равновесие
Вещество в конденсированном состоянии обладает поверхностной энергией, обусловленной нескомпенсированностью полей частиц на поверхности раздела фаз.
Термин «поверхностная энергия» применяется к границе раздела газ – твердое тело, жидкость – твердое тело.
Под поверхностной энергией понимается энергия Гиббса образования поверхности. Она равна произведению удельной поверхностной энергии на площадь поверхности раздела фаз:
G= ∙ S , (9.9)
Для неассоциированных жидкостей удельная поверхностная энергия зависит от температуры:
=0-(Т-Т0) , (9.10)
где 0 – поверхностное натяжение при Т0 = 273 К;
= 0,1 мДж/м2 ∙ к.
Адсорбция – изменение концентрации вещества на границе раздела фаз; адсорбция представляет собой процесс поглощения газов, паров или жидкостей поверхностью пористых твердых тел. Процесс адсорбции является избирательным и обратимым.
Адсорбент – вещество, способное адсорбировать другое вещество.
Адсорбтив – вещество, которое может адсорбироваться.
Адсорбат – адсорбированное вещество.
Количественной мерой адсорбции является избыток адсорбированного вещества Г, равный разности концентраций вещества в поверхностном слое и в объеме раствора, (моль/м2; моль/см2).
Адсорбцию подразделяют на:
а) физическую – вандерваальсовы силы взаимодействия, невысокий тепловой эффект;
б) хемосорбцию – возникают химические связи, значительный тепловой эффект.
Адсорбция протекает самопроизвольно - энергия Гиббса адсорбции имеет отрицательное значение: Gадс<0.
Тепловой эффект имеет отрицательное значение Надс<0.
Адсорбция – процесс избирательного поглощения компонента из газа или пара с помощью жидких поглощений. В тоже время в процессе адсорбции происходит упорядочения адсорбированных частиц: Sадс<0.
C увеличением температуры энергия Гиббса системы возрастает, при некоторой Тр наступает равновесие:
адсорбция
А
 Аадс .
Аадс .
десорбция
9.5.1 Адсорбция на границе раздела газ – твердое тело.
Изотерма адсорбции - зависимость избытка адсорбированного вещества от равновесной концентрации Ср или равновесного давления при постоянной температуре.
У (9.11)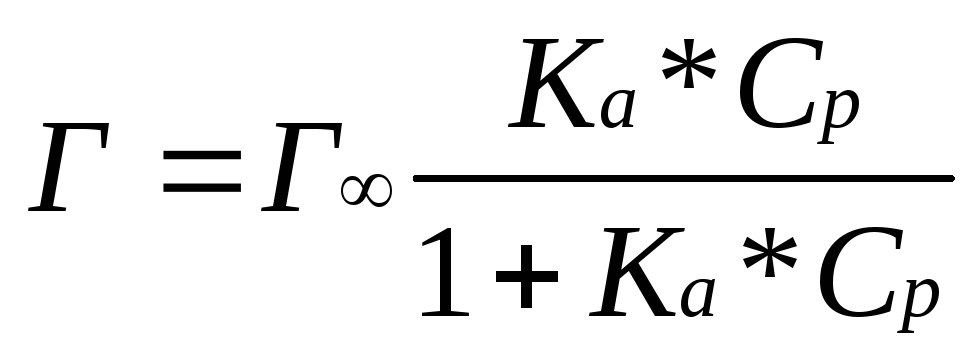
где Г - адсорбция при максимальном значении;
Ср – равновесная концентрация адсорбата;
Ка – константа равновесия процесса адсорбции.

Другое уравнение изотермы адсорбции – эмпирическое уравнение Фрейдлиха:
Г=Кф ∙ рn , (9.12)
где Кф, n – постоянные;
р - равновесное давление адсорбата.
Адсорбция зависит от природы адсорбента и адсорбата. Наиболее распространенные адсорбенты: активированные угли. Хорошо адсорбируют малополярные газы и пары гидрофильный адсорбент - силикагель. Другие адсорбенты: цеолиты, алюмосиликатные пористые вещества.
10.5.2 Адсорбция на границе раздела твердое тело – жидкость.
Удельная адсорбция ( а, моль/кг) молекул из раствора:
(9.13)
г де
С0 и С – концентрации адсорбата
а растворе до и после адсорбации;
де
С0 и С – концентрации адсорбата
а растворе до и после адсорбации;
V – объем раствора;
m – масса адсорбента.
Правило выравнивания полярностей (М.А. Ребиндер) – на полярных адсорбентах лучше всего адсорбируются полярные адсорбаты из неполярных растворителей, а на неполярных – неполярные адсорбаты из полимерных растворителей.
Уравнение Лэнгмюра и Фрейдлиха:
а = Кф∙ С n, (9.15)
где Кф и n – постоянные.
На явлении адсорбции основаны способы очистки газов и жидкостей от различных примесей, при подготовке питьевой воды, при осушке газов, при получении чистых веществ. В медицине адсорбционные методы используются для извлечения вредных веществ из крови.
