
- •1.Способы задания движения точки. Системы отсчета
- •2. Перемещение. Скорость равномерного прямолинейного движения.
- •3. Уравнение равномерного прямолинейного движения точки, его графическое представление
- •5. Ускорение.
- •6. Движение с постоянным ускорением. Единица ускорения.
- •7. Скорость при движении с постоянным ускорением
- •8. Уравнения движения с постоянным ускорением.
- •9. Свободное падение тел. Движение с постоянным ускорением свободного падения.
- •10. Движение тел. Поступательное движение твердого тела
- •11. Вращательное движение твердого тела.
- •12. Материальная точка. Первый закон Ньютона.
- •13. Сила
- •14. Связь между ускорением и силой. Второй закон Ньютона.
- •15. Третий закон Ньютона. Единицы массы и силы.
- •16. Понятие о системе единиц.
- •17. Инерциальные системы отсчета.
- •18. Принцип относительности в механике.
- •19. Гравитационные силы. 20. Закон всемирного тяготения.
- •21. Сила тяжести, вес и невесомость.
- •22. Деформация и силы упругости. 23. Закон Гука.
- •24. Силы трения.
- •25. Импульс материальной точки. 26. Закон сохранения импульса.
- •27. Работа ,мощность, энергия в механике (формулы, единицы измерения)
- •28. Кинетическая энергия. 29. Потенциальная энергия.
- •30. Закон сохранения энергии в механике.
28. Кинетическая энергия. 29. Потенциальная энергия.
Механической энергией тел называют энергию, связанную с их скоростями и относительным положением. Чем больше скорость тела, тем большей энергией оно обладает. Энергию, связанную со скоростью тела, называют его кинетической энергией, EК. Сжатая пружина, хоть и неподвижна, но обладает энергией, т.к., распрямившись, может совершить работу. То же можно сказать и о приподнятом над землёй мяче, т.к., если его отпустить, то он, разогнавшись и ударившись обо что-нибудь, совершит работу, а значит даже сначала, когда он ещё не двигался, он уже обладал энергией. Такую энергию, связанную только с относительным расположением тел или их частей (деформацией), называют потенциальной энергией, EП. Таким образом, механическая энергия тела или системы тел равна сумме их потенциальных и кинетических энергий.
Вычислим работу, которую совершает сила F, разгоняя неподвижное тело массы m до скорости v (см. рис. 16г). Действие силы приведёт к тому, что тело будет двигаться с ускорением a=F/m. Тело достигнет скорости v через промежуток времени t=v/a, пройдя при этом путь s=at2/2. Поэтому работа A, совершённая силой F, составит:
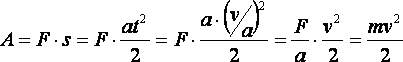
Аналогично, если на тело, движущееся со скоростью v, начинает действовать сила, тормозящая его, то это тело успеет до полной остановки совершить работу, равную mv2/2. Таким образом, кинетическая энергия тела, EК равна:EК = mv2/2. (16.2)
Найдём потенциальную энергию тела массы m, приподнятого на высоту h над поверхностью земли (см. рис. 16д). Если дать этому телу свободно падать, то оно начнёт двигаться с ускорением свободного падения g и, как легко показать, у поверхности земли будет иметь скорость v=(2gh)1/2. Поэтому у поверхности земли тело будет обладать кинетической энергией, равной mv2/2, и остановившись, сможет совершить такую же по величине работу. Значит, находившись на высоте h над землёй, тело обладало потенциальной энергией, EП, равной:
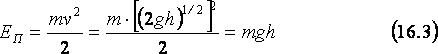
30. Закон сохранения энергии в механике.
Если тела, составляющие замкнутую механическую систему, взаимодействуют между собой только посредством сил тяготения и упругости, то работа этих сил равна изменению потенциальной энергии тел, взятому с противоположным знаком: A = –(Eр2 – Eр1).
По
теореме о кинетической энергии эта
работа равна изменению кинетической
энергии тел![]()
Следовательно![]()
Или Ek1 + Ep1 = Ek2 + Ep2.
Сумма кинетической и потенциальной энергии тел, составляющих замкнутую систему и взаимодействующих между собой посредством сил тяготения и сил упругости, остается неизменной.
Это утверждение выражает закон сохранения энергии в механических процессах. Он является следствием законов Ньютона. Сумму E = Ek + Ep называют полной механической энергией. Закон сохранения механической энергии выполняется только тогда, когда тела в замкнутой системе взаимодействуют между собой консервативными силами, то есть силами, для которых можно ввести понятие потенциальной энергии.
Механическая энергия замкнутой системы тел не изменяется, если между этими телами действуют только консервативные силы. Консервативными называют те силы, работа которых по любой замкнутой траектории равна нулю. Сила тяжести являются одной из консервативных сил.
В реальных условиях практически всегда на движущиеся тела наряду с силами тяготения, силами упругости и другими консервативными силами действуют силы трения или силы сопротивления среды.
Сила трения не является консервативной. Работа силы трения зависит от длины пути.
Если между телами, составляющими замкнутую систему, действуют силы трения, то механическая энергия не сохраняется. Часть механической энергии превращается во внутреннюю энергию тел (нагревание).
При любых физических взаимодействиях энергия не возникает и не исчезает. Она лишь превращается из одной формы в другую.
Одним из следствий закона сохранения и превращения энергии является утверждение о невозможности создания «вечного двигателя» (perpetuum mobile) – машины, которая могла бы неопределенно долго совершать работу, не расходуя при этом энергии.
История хранит немалое число проектов «вечного двигателя». В некоторых из них ошибки «изобретателя» очевидны, в других эти ошибки замаскированы сложной конструкцией прибора, и бывает очень непросто понять, почему эта машина не будет работать. Бесплодные попытки создания «вечного двигателя» продолжаются и в наше время. Все эти попытки обречены на неудачу, так как закон сохранения и превращения энергии «запрещает» получение работы без затраты энергии.
31. Основные положения молекулярно-кинетической теории и их обоснование.
Все тела состоят из молекул, атомов и элементарных частиц, которые разделены промежутками, беспорядочно движутся и взаимодействуют друг с другом.
Кинематика и динамика помогают нам описать движение тела и определить силу, являющуюся причиной этого движения. Однако на многие вопросы механика ответ дать не может. Например, из чего состоят тела? Почему при нагревании многие вещества становятся жидкими, а потом испаряются? И, вообще, что такое температура и теплота?
На подобные вопросы пытался ответить древнегреческий философ Демокрит 25 веков тому назад. Не ставя никаких опытов, он пришёл к заключению, что тела только кажутся нам сплошными, а на самом деле они состоят из мельчайших частиц, разделённых пустотой. Считая, что раздробить эти частицы нельзя, Демокрит назвал их атомами, что в переводе с греческого означает неделимые. Он же предположил, что атомы могут быть разными и находятся в постоянном движении, но мы не видим этого, т.к. они очень малы.
Большой вклад в развитие молекулярно-кинетической теории сделал М.В. Ломоносов. Ломоносов впервые предположил, что теплота отражает движение атомов тела. Кроме того, он ввёл понятие простых и сложных веществ, молекулы которых состоят из одинаковых и разных атомов, соответственно.
В основе молекулярной физики или молекулярно-кинетической теории лежат определенные представления о строении вещества
Таким образом, согласно атомистической теории строения вещества, мельчайшей частицей вещества, сохраняющей все его химические свойства, является молекула. Размеры даже крупных молекул, состоящих из тысяч атомов, так малы, что их нельзя увидеть в световой микроскоп. Многочисленные опыты и теоретические расчёты показывают, что размер атомов составляет около 10-10 м. Размер молекулы зависит от того, из скольких атомов она состоит, и как они расположены друг относительно друга.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую.
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома.
32. Масса молекул, относительная молекулярная масса молекул. 33. Молярная масса молекул. 34. Количество вещества. 35. Постоянная Авогадро.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг (12 г) углерода 12C. Молекула углерода состоит из одного атома.
Один моль вещества содержит количество молекул или атомов, равное постоянной Авогадро.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6,02·1023 моль–1.
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество
вещества ν определяется как отношение
числа N частиц (молекул) вещества к
постоянной Авогадро NА:
![]()
Молярной
массой, M называют отношение массы m
данного образца вещества к количеству
n вещества, содержащегося в нём:
![]()
которая численно равна массе вещества, взятого в количестве одного моля. Молярная масса в системе СИ выражается в кг/моль.
Таким образом, относительной молекулярной или атомной массой вещества называют отношение массы его молекулы и атома к 1/12 массе атома углерода.
36. Броуновское движение.
Многие явления природы свидетельствуют о хаотичном движении микрочастиц, молекул и атомов вещества. Чем выше температура вещества, тем более интенсивно это движение. Поэтому теплота тела является отражением беспорядочного движения составляющих его молекул и атомов.
Доказательством того, что все атомы и молекулы вещества находятся в постоянном и беспорядочном движении, может служить диффузия – взаимопроникновение частиц одного вещества в другое.
Так, запах быстро распространяется по комнате даже при отсутствии движения воздуха. Капля чернил быстро делает весь стакан с водой однородно чёрным.
Диффузию можно обнаружить и в твёрдых телах, если прижать их плотно друг к другу и оставить на длительное время. Явление диффузии демонстрирует, что микрочастицы вещества способны самопроизвольно двигаться во все стороны. Такое движение микрочастиц вещества, а также его молекул и атомов, называют их тепловым движением.
БРО́УНОВСКОЕ ДВИЖЕ́НИЕ- беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходящее под действием ударов молекул окружающей среды; открыто Р. Броуном в 1827 г.
Наблюдения показывают, что броуновское движение никогда не прекращается. В капле воды (если не давать ей высохнуть) движение крупинок можно наблюдать в течение многих дней, месяцев, лет. Оно не прекращается ни летом, ни зимой, ни днем, ни ночью.
Причина броуновского движения заключается в непрерывном, никогда не прекращающемся движении молекул той жидкости, в которой находятся крупинки твердого тела. Конечно, эти крупинки во много раз крупнее самих молекул, и когда мы видим под микроскопом движение крупинок, то не следует думать, что мы видим движение самих молекул. Молекулы нельзя видеть в обычный микроскоп, но об их существовании и движении мы можем судить по тем ударам, которые они производят, толкая крупинки твердого тела и заставляя их двигаться.
Открытие Броуновского движения имело большое значение для изучения строения вещества. Оно показало, что тела действительно состоят из отдельных частиц — молекул и что молекулы находятся в непрерывном беспорядочном движении.
Объяснение броуновского движения было дано только в последней четверти XIX века, когда многим ученым стало очевидно, что движение броуновской частицы вызвано беспорядочными ударами молекул среды (жидкости или газа), совершающих тепловое движение . В среднем, молекулы среды воздействуют на броуновскую частицу со всех сторон с равной силой, однако, эти удары никогда в точности не уравновешивают друг друга, и в результате, скорость броуновской частицы беспорядочно меняется по величине и направлению. Поэтому броуновская частица движется по зигзагообразному пути. При этом, чем меньше размеры и масса броуновской частицы, тем более заметным становится её движение.
Таким образом, анализ броуновского движения заложил основы современной молекулярно-кинетической теории строения вещества.
37. Силы взаимодействия молекул. 38. Строение газообразных веществ. 39. Строение жидких веществ. 40. Строение твердых тел.
Расстояние между молекулами и действующие между ними силы определяют свойства газообразных, жидких и твёрдых тел.
Мы привыкли к тому, что жидкость можно перелить из одного сосуда в другой, а газ быстро заполняет весь предоставленный ему объём. Вода может течь только вдоль русла реки, а воздух над ней не знает границ.
Между всеми молекулами действует межмолекулярные силы притяжения, величина которых очень быстро падает с удалением молекул друг от друга, и поэтому на расстоянии, равном нескольким диаметрам молекул, они вообще не взаимодействуют.
Таким образом, между молекулами жидкости, расположенными почти вплотную друг к другу, действуют силы притяжения, препятствующие этим молекулам разлететься в разные стороны. Наоборот, ничтожные силы притяжения между молекулами газа не в состоянии удержать их вместе, и поэтому газы могут расширяться, заполняя весь предоставленный им объём. В существовании межмолекулярных сил притяжения можно убедиться, поставив простой опыт – прижать друг к другу два свинцовых бруска. Если поверхности соприкосновения будут достаточно гладкими, то бруски слипнутся, и их будет тяжело разъединить.
Однако межмолекулярные силы притяжения одни не могут объяснить все различия между свойствами газообразных, жидких и твёрдых веществ. Почему, например, уменьшить объём жидкости или твёрдого тела очень тяжело, а сжать воздушный шарик относительно легко? Объясняется это тем, что между молекулами существуют не только силы притяжения, но и межмолекулярные силы отталкивания, действующие тогда, когда электронные оболочки атомов соседних молекул начинают перекрываться. Именно эти силы отталкивания препятствуют тому, чтобы одна молекула не проникала в объём, уже занятый другой молекулой.
Когда на жидкое или твёрдое тело не действуют внешние силы, расстояние между их молекулами такое , при котором результирующая сил притяжения и отталкивания равна нулю. Если пытаться уменьшить объём тела, то расстояние между молекулами уменьшается, и со стороны сжатого тела начинает действовать результирующая возросших сил отталкивания. Наоборот, при растяжении тела возникающие силы упругости связаны с относительным ростом сил притяжения, т.к. при отдалении молекул друг от друга силы отталкивания падают гораздо быстрее, чем силы притяжения.
Молекулы газов находятся на расстояниях в десятки раз больших, чем их размеры, в результате чего эти молекулы не взаимодействуют между собой, и поэтому газы гораздо легче сжимаются, чем жидкости и твёрдые тела. Газы не имеют какой-либо определённой структуры и представляют собой совокупность движущихся и сталкивающихся молекул.
Жидкость – это совокупность молекул, почти вплотную прилегающих друг к другу . Тепловое движение позволяет молекуле жидкости время от времени менять своих соседей, перескакивая с одного места на другое. Этим и объясняется текучесть жидкостей.
Атомы и молекулы твёрдых тел лишены возможности менять своих соседей, а их тепловое движение – это лишь небольшие колебания относительно положения соседних атомов или молекул. Взаимодействие между атомами может приводить к тому, что твёрдое вещество становится кристаллом, а атомы в нём занимают положения в узлах кристаллической решётки. Так как молекулы твёрдых тел не движутся относительно соседей, то эти тела сохраняют свою форму.
41. Идеальный газ в молекулярно-кинетической теории.
Идеальный газ – это модель разреженного газа, в которой пренебрегается взаимодействием между молекулами. Силы взаимодействия между молекулами довольно сложны. На очень малых расстояниях, когда молекулы вплотную подлетают друг к другу, между ними действуют большие по величине силы отталкивания. На больших или промежуточных расстояниях между молекулами действуют сравнительно слабые силы притяжения. Если расстояния между молекулами в среднем велики, что наблюдается в достаточно разреженном газе, то взаимодействие проявляется в виде относительно редких соударений молекул друг с другом, когда они подлетают вплотную. В идеальном газе взаимодействием молекул вообще пренебрегают.
42. Давление газа в молекулярно-кинетической теории.
Идеальный газ – это модель разреженного газа, в которой пренебрегается взаимодействием между молекулами.
Давление идеального газа пропорционально произведению концентрации молекул на их среднюю кинетическую энергию.
Давлением
p на данном участке поверхности, называют
отношение силы F, действующей перпендикулярно
этой поверхности к площади S данного её
участка
![]()
Единицей измерения давления в СИ служит Паскаль (Па). 1 Па = 1 Н/м2.
Газ окружает нас со всех сторон. В любом месте на земле, даже под водой, мы носим на себе часть атмосферы, нижние слои которой сжимаются под действием силы тяжести верхних. Поэтому, измеряя атмосферное давление можно судить о том, что происходит высоко над нами и предсказывать погоду.
43. Среднее значение квадрата скорости молекул идеального газа.

44. Вывод основного уравнения молекулярно-кинетической теории газа. 45. Вывод формулы, связывающей давление и среднюю кинетическую энергию молекул газа.
Давлением
p на данном участке поверхности, называют
отношение силы F, действующей перпендикулярно
этой поверхности к площади S данного её
участка
![]()
Единицей измерения давления в СИ служит Паскаль (Па). 1 Па = 1 Н/м2.
Найдём силу F, с которой действует молекула массой m0 на поверхность, от которой она отскакивает . При отражении от поверхности, длящемся промежуток времени Dt, составляющая скорости молекулы, перпендикулярная этой поверхности, vy изменяется на обратную (-vy). Поэтому при отражении от поверхности молекула приобретает импульс, 2m0vy , а значит, по третьему закону Ньютона 2m0vy =FDt, откуда:
![]()
Формула (22.2) даёт возможность вычислить силу, с которой давит одна молекула газа на стенку сосуда в течение интервала Dt. Чтобы определить среднюю силу давления газа, например, за одну секунду, надо найти, сколько молекул отразится за секунду от участка поверхности площадью S, а также необходимо знать среднюю величину скорости vy молекул, движущихся в направлении к данной поверхности.
Пусть в единице объёма газа находится n молекул. Упростим себе задачу, считая, что все молекулы газа движутся с одинаковой скоростью, v. При этом 1/3 всех молекул движется вдоль оси Ox, и столько же – вдоль оси Oy и Oz (см. рис. 22в). Пусть половина молекул, движущихся вдоль оси Oy, движется в сторону стенки С, а остальные – в противоположную сторону. Тогда, очевидно, количество молекул в единице объёма, несущихся в сторону стенки С, составит n/6.
Найдём
теперь количество молекул, ударившихся
об участок поверхности площадью S
(заштрихован на рис. 22в) за одну секунду.
Очевидно, что за 1 с до стенки успеют
долететь те молекулы, которые движутся
в её сторону и находятся на расстоянии,
не большем v. Поэтому ударятся об этот
участок поверхности 1/6 всех молекул,
находящихся в прямоугольном параллелепипеде,
выделенном на рис. 22в, длина которого
равна v, а площадь торцевых граней - S.
Так как объём этого параллелепипеда
составляет Sv, то общее число N молекул,
ударившихся об участок поверхности
стенки за 1 с будет равно:
![]()
Используя
(22.2) и (22.3) можно вычислить импульс,
который за 1 с сообщил молекулам газа
участок поверхности стенки площадью
S. Этот импульс численно будет равен
силе давления газа, F:
![]()
откуда, используя (22.1), получаем следующее выражение, связывающее давление газа и среднюю кинетическую энергию поступательного движения его молекул:
![]()
где ЕСР – средняя кинетическая энергия молекул идеального газа. Формулу (22.4) называют основным уравнением молекулярно-кинетической теории газов.
46. Тепловое равновесие. 47. Температура. Изменение температуры. 48. Приборы для измерения температуры.
Тепловое равновесие между телами возможно только тогда, когда их температура одинакова.
Прикоснувшись рукой к любому предмету, мы легко можем определить, тёплый он или холодный. Если температура предмета ниже температуры руки, предмет кажется холодным, а если наоборот, то - тёплым. Если зажать в кулаке холодную монету, то теплота руки начнёт нагревать монету, и через некоторое время её температура станет равной температуре руки, или, как говорят, наступит тепловое равновесие. Поэтому температура характеризует состояние теплового равновесия системы из двух или нескольких тел, имеющих одну и ту же температуру.
Температура наряду с объёмом и давлением газа являются макроскопическими параметрами. Для измерения температуры используют термометры. В некоторых из них регистрируют изменение объёма жидкости при нагревании, в других – изменение электрического сопротивления и т.п. Самой распространённой является температурная шкала Цельсия, названная так в честь шведского физика А. Цельсия. Чтобы получить температурную шкалу Цельсия для жидкостного термометра, его сначала погружают в тающий лёд и отмечают положение конца столбика, а потом - в кипящую воду. Отрезок между этими двумя положениями столбика делят на 100 равных частей, считая, что температура таяния льда соответствует нулю градусов шкалы Цельсия (оС), а температура кипящей воды – 100 оС.
49. Средняя кинетическая энергия молекул газа при тепловом равновесии.
Основное уравнение молекулярно-кинетической теории (22.4) связывает между собой давление газа, концентрацию молекул и их среднюю кинетическую энергию. Однако средняя кинетическая энергия молекул, как правило, неизвестна, хотя результаты многих опытов говорят о том, что скорость молекул увеличивается с ростом температуры (см., например, броуновское движение в §20). Зависимость средней кинетической энергии молекул газа от его температуры можно получить из закона открытого французским физиком Ж. Шарлем в 1787 году.
Согласно
закону Шарля, если объём данной массы
газа не меняется, его давление pt линейно
зависит от температуры t:

где
t – температура газа, измеренная в оС,
а p0
– давление газа при температуре 0 оС
(см. рис. 23б). Таким образом, из закона
Шарля следует, что давление газа,
занимающего неизменный объём,
пропорционально сумме (t+273 оС).
С другой стороны, из (22.4) вытекает, что,
если концентрация молекул постоянна,
т.е. объём, занимаемый газом, не изменяется,
то давление газа должно быть пропорционально
средней кинетической энергии молекул.
Значит, средняя кинетическая энергия,
ЕСР
молекул газа, просто, пропорциональна
величине (t+273 оС):
![]()
где b – постоянный коэффициент, значение которого мы позже определим. Из (23.2) следует, что средняя кинетическая энергия молекул станет равной нулю при -273 оС. Исходя из этого, английский учёный У. Кельвин в 1848 г. предложил использовать абсолютную температурную шкалу, нулевая температура в которой соответствовала бы -273 оС, а каждый градус температуры был бы равен градусу шкалы Цельсия. Таким образом, абсолютная температура, T связана с температурой t, измеренной по шкале Цельсия, следующим образом:
![]()
За единицу абсолютной температуры в СИ принят Кельвин (К).
Учитывая
(23.3), уравнение (23.2) преобразуется в:
![]()
подставляя
которое в (22.4), получаем следующее:
![]()
Чтобы
избавиться от дроби в (23.5), заменим 2b/3
на k, и получим вместо (23.4) и (23.5) два очень
важных уравнения:

где k – постоянная Больцмана, названная в честь Л. Больцмана. Эксперименты показали, что k=1,38.10-23 Дж/К. Таким образом, давление газа и средняя кинетическая энергия его молекул пропорциональны его абсолютной температуре.
50. Газы в состоянии теплового равновесия (описать опыт).
??????
51. Абсолютная температура. 52. Абсолютная шкала температур. 53. Температура- мера средней кинетической энергии молекул.
Зависимость средней кинетической энергии молекул газа от его температуры можно получить из закона открытого французским физиком Ж. Шарлем в 1787 году.
Согласно
закону Шарля, если объём данной массы
газа не меняется, его давление pt линейно
зависит от температуры t:
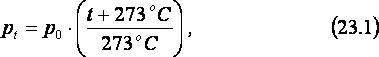
где
t – температура газа, измеренная в оС,
а p0
– давление газа при температуре 0 оС
(см. рис. 23б). Таким образом, из закона
Шарля следует, что давление газа,
занимающего неизменный объём,
пропорционально сумме (t+273 оС).
С другой стороны, из (22.4) вытекает, что,
если концентрация молекул постоянна,
т.е. объём, занимаемый газом, не изменяется,
то давление газа должно быть пропорционально
средней кинетической энергии молекул.
Значит, средняя кинетическая энергия,
ЕСР
молекул газа, просто, пропорциональна
величине (t+273 оС):
![]()
где b – постоянный коэффициент, значение которого мы позже определим. Из (23.2) следует, что средняя кинетическая энергия молекул станет равной нулю при -273 оС. Исходя из этого, английский учёный У. Кельвин в 1848 г. предложил использовать абсолютную температурную шкалу, нулевая температура в которой соответствовала бы -273 оС, а каждый градус температуры был бы равен градусу шкалы Цельсия. Таким образом, абсолютная температура, T связана с температурой t, измеренной по шкале Цельсия, следующим образом:
![]()
За единицу абсолютной температуры в СИ принят Кельвин (К).
Учитывая
(23.3), уравнение (23.2) преобразуется в:
![]()
подставляя
которое в (22.4), получаем следующее:
![]()
Чтобы
избавиться от дроби в (23.5), заменим 2b/3
на k, и получим вместо (23.4) и (23.5) два очень
важных уравнения:

где k – постоянная Больцмана, названная в честь Л. Больцмана. Эксперименты показали, что k=1,38.10-23 Дж/К. Таким образом, давление газа и средняя кинетическая энергия его молекул пропорциональны его абсолютной температуре.
54. Зависимость давления газа от концентрации его молекул и температуры.
В большинстве случаев при переходе газа из одного состояния в другое меняются все его параметры – температура, объём и давление. Так происходит, когда газ сжимается под поршнем в цилиндре двигателя внутреннего сгорания, в результате чего температура газа и его давление растут, а объём уменьшается. Однако в некоторых случаях изменения одного из параметров газа относительно малы или вообще отсутствуют. Такие процессы, где один из трёх параметров – температура, давление или объём остаются неизменными, называют изопроцессами, а законы, которые их описывают – газовыми законами.
Изотермическим процессом называют изменение состояния газа, при котором его температура остаётся постоянной. Примером такого процесса может служить накачивание воздухом автомобильных шин. Однако изотермическим такой процесс можно считать, если сравнивать состояние воздуха перед тем, как он оказался в насосе, с его состоянием в шине после того, как температура шины и окружающего воздуха стали равными. Любые медленные процессы, происходящие с малым объёмом газа, окружённым большой массой газа, жидкости или твёрдого тела, имеющей постоянную температуру, можно считать изотермическими.
При
изотермическом процессе произведение
давления данной массы газа на его объём
есть величина постоянная. Этот закон,
называемый законом Бойля-Мариотта, был
открыт английским учёным Р. Бойлем и
французским физиком Э. Мариоттом и
записывается в следующем виде:
![]()
Изобарным процессом называют изменение состояния газа, происходящее при постоянном давлении.
При изобарном процессе отношение объёма данной массы газа к его температуре постоянно. Этот вывод, который называют законом Гей-Люссака в честь французского учёного Ж. Гей-Люссака, можно записать в виде:
![]()
Одним из примеров изобарного процесса является расширение маленьких пузырьков воздуха и углекислого газа, содержащихся в тесте, когда его ставят в духовку. Давление воздуха внутри духовки и снаружи одинаково, а температура внутри приблизительно на 50% больше, чем снаружи. Согласно закону Гей-Люссака объём газовых пузырьков в тесте вырастает тоже на 50% , что и делает пирог воздушным.
Процесс,
при котором изменяется состояние газа,
а его объём остаётся неизменным, называют
изохорным. Из уравнения Менделеева -
Клапейрона следует, что у газа, занимающего
постоянный объём, отношение его давления
к температуре тоже должно быть постоянным:
![]()
55. Измерение скоростей молекул газа. 56. Опыт Штерна.
Прежде всего уточним, что надо понимать под скоростью молекул. Напомним, что вследствие частых столкновений скорость каждой отдельной молекулы все время меняется: молекула движется то быстро, то медленно, и в течение некоторого времени (например, одной секунды) скорость молекулы принимает множество самых различных значений. С другой стороны, в какой-либо момент в громадном числе молекул, составляющих рассматриваемый объем газа, имеются молекулы с самыми различными скоростями. Очевидно, для характеристики состояния газа надо говорить о некоторой средней скорости. Можно считать, что это есть среднее значение скорости одной из молекул за достаточно длительный промежуток времени или что это есть среднее значение скоростей всех молекул газа в данном объеме в какой-нибудь момент времени.
Существуют разнообразные способы определения скоростей движения молекул. Одним из наиболее простых является способ, осуществленный в 1920 г. в опыте Штерна.

Рис. 390. Когда пространство под стаканом А наполнено водородом; то из конца воронки, закрытой пористым сосудом В, выходят пузырьки
Для понимания его рассмотрим следующую аналогию. Когда стреляют по движущейся мишени, то, чтобы попасть в нее, приходится целиться в точку, находящуюся впереди мишени. Если же взять прицел на мишень, то пули будут попадать сзади мишени . Это отклонение места попадания от цели будет тем больше, чем быстрее движется мишень и чем меньше скорость пуль.
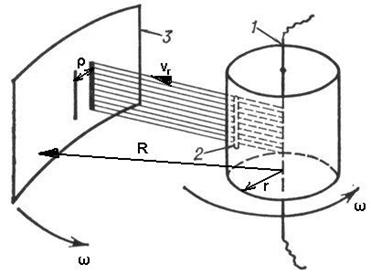
Экспериментальному
подтверждению и визуализации распределения
молекул газа по скоростям и был посвящен
опыт Отто Штерна (1888–1969). Это еще один
красивый опыт, позволявший в прямом
смысле слова «начертить» график этого
распределения на экспериментальной
установке. Установка Штерна состояла
из двух вращающихся полых цилиндров с
совпадающими осями (см. рис. справа;
большой цилиндр нарисован не полностью).
Во внутреннем цилиндре, прямо по его
оси была протянута серебряная нить 1,
по которой пропускался ток, что приводило
к ее нагреванию, частичному плавлению
и последующему испарению атомов серебра
с ее поверхности. В результате внутренний
цилиндр, в котором изначально был вакуум,
постепенно заполнялся газообразным
серебром малой концентрации. Во внутреннем
цилиндре, как показано на рисунке, была
проделана тонкая щель 2, поэтому большая
часть атомов серебра, долетая до цилиндра,
оседала на нем. Малая же часть атомов
проходила сквозь щель и попадала во
внешний цилиндр, в котором поддерживался
вакуум. Здесь эти атомы уже не сталкивались
с другими атомами и поэтому двигались
в радиальном направлении с постоянной
скоростью, достигая внешнего цилиндра
через время, обратное пропорциональное
этой скорости:
![]()
где
![]() — радиусы внутреннего и внешнего
цилиндров, а
— радиусы внутреннего и внешнего
цилиндров, а
![]() — радиальная компонента скорости
частицы. В результате с течением времени
на внешнем цилиндре 3 возникал слой
серебряного напыления. В случае покоящихся
цилиндров этот слой имел вид полоски,
расположенной точно напротив щели во
внутреннем цилиндре. Но если цилиндры
вращались с одинаковой угловой скоростью
, то за время достижения молекулой
внешнего цилиндра последний уже сдвигался
на расстояние
— радиальная компонента скорости
частицы. В результате с течением времени
на внешнем цилиндре 3 возникал слой
серебряного напыления. В случае покоящихся
цилиндров этот слой имел вид полоски,
расположенной точно напротив щели во
внутреннем цилиндре. Но если цилиндры
вращались с одинаковой угловой скоростью
, то за время достижения молекулой
внешнего цилиндра последний уже сдвигался
на расстояние
![]()
по сравнению с точкой, стоящей прямо напротив щели (т.е. той точкой, на которую оседали частицы в случае неподвижных цилиндров).
57. Вывод уравнения состояния идеального газа (уравнение Менделеева-Клайперона)
Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева): PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
Вывод уравнения нашла, но очень сложный. Надо еще поискать.
58. Изотермический процесс.
Изотермическим процессом называют изменение состояния газа, при котором его температура остаётся постоянной. Примером такого процесса может служить накачивание воздухом автомобильных шин. Однако изотермическим такой процесс можно считать, если сравнивать состояние воздуха перед тем, как он оказался в насосе, с его состоянием в шине после того, как температура шины и окружающего воздуха стали равными. Любые медленные процессы, происходящие с малым объёмом газа, окружённым большой массой газа, жидкости или твёрдого тела, имеющей постоянную температуру, можно считать изотермическими.
При
изотермическом процессе произведение
давления данной массы газа на его объём
есть величина постоянная. Этот закон,
называемый законом Бойля-Мариотта, был
открыт английским учёным Р. Бойлем и
французским физиком Э. Мариоттом и
записывается в следующем виде:
![]()
Примеры найти!
59. Изобарный процесс.
Изобарным процессом называют изменение состояния газа, происходящее при постоянном давлении.
При изобарном процессе отношение объёма данной массы газа к его температуре постоянно. Этот вывод, который называют законом Гей-Люссака в честь французского учёного Ж. Гей-Люссака, можно записать в виде:
![]()
Одним из примеров изобарного процесса является расширение маленьких пузырьков воздуха и углекислого газа, содержащихся в тесте, когда его ставят в духовку. Давление воздуха внутри духовки и снаружи одинаково, а температура внутри приблизительно на 50% больше, чем снаружи. Согласно закону Гей-Люссака объём газовых пузырьков в тесте вырастает тоже на 50% , что и делает пирог воздушным.
60. Изохорный процесс.
Процесс,
при котором изменяется состояние газа,
а его объём остаётся неизменным, называют
изохорным. Из уравнения Менделеева -
Клапейрона следует, что у газа, занимающего
постоянный объём, отношение его давления
к температуре тоже должно быть постоянным:
![]()
Примеры найти!
61. Испарение и конденсация.
Пар – это газ, образованный из молекул, обладавших достаточной кинетической энергией, чтобы покинуть жидкость.
Мы привыкли к тому, что вода и её пар могут переходить друг в друга. Лужи на асфальте после дождя высыхают, а водяной пар в воздухе по утрам часто превращается в мельчайшие капельки тумана. Все жидкости обладают способностью превращаться в пар – переходить в газообразное состояние. Процесс перехода жидкости в пар называют испарением. Образование жидкости из её паров называют конденсацией.
Молекулярно-кинетическая теория объясняет процесс испарения следующим образом. Известно (см. §21), что между молекулами жидкости действуют сила притяжения, не дающая им удаляться друг от друга, и средней кинетической энергии молекул жидкости оказывается недостаточно, чтобы преодолеть силы сцепления между ними. Однако в каждый данный момент времени разные молекулы жидкости обладают разной кинетической энергией, и энергия некоторых молекул может в несколько раз превышать её среднее значение. Эти высокоэнергетичные молекулы обладают значительно большей скоростью движения и поэтому могут преодолеть силы притяжения соседних молекул и вылететь из жидкости, образуя таким образом пар над её поверхностью (см. рис.26а).
Покинувшие жидкость молекулы, составляющие пар, беспорядочно движутся, сталкиваясь между собой так, как это делают молекулы газа при тепловом движении. При этом хаотическое движение некоторых молекул пара может их уводить так далеко от поверхности жидкости, что они уже никогда туда не возвращаются. Способствует этому, конечно, и ветер. Наоборот, беспорядочное движение других молекул может приводить их обратно в жидкость, что и объясняет процесс конденсации пара.
Вылететь из жидкости могут только молекулы, обладающие кинетической энергией намного выше средней, а это значит, при испарении средняя энергия оставшихся молекул жидкости уменьшается. А так как средняя кинетическая энергия молекул жидкости, как и газа (см. 23.6), пропорциональна температуре, то при испарении температура жидкости понижается. Поэтому нам и становится холодно, как только мы выходим из воды, покрытые тонкой плёнкой жидкости, которая сразу начинает испаряться и охлаждаться.
62. Насыщенный пар. Давление насыщенного пара.
Что произойдёт, если сосуд с некоторым объёмом жидкости закрыть крышкой (рис.26б)? Каждую секунду поверхность жидкости по-прежнему будут покидать самые быстрые молекулы, её масса будет уменьшаться, а концентрация молекул пара – увеличиваться. Одновременно с этим в жидкость из пара будут возвращаться часть его молекул, и чем больше будет концентрация пара, тем интенсивней будет этот процесс конденсации. Наконец, концентрация пара над жидкостью станет так высока, что число молекул, возвращающихся в жидкость в единицу времени, станет равным числу молекул, покидающих её. Такое состояние называют динамическим равновесием, а соответствующий пар – насыщенным паром. Концентрация молекул пара над жидкостью не может быть больше их концентрации в насыщенном паре. Если концентрация молекул пара меньше, чем у насыщенного, то такой пар называют ненасыщенным.
Движущиеся молекулы пара создают давление, величина которого, как и для газа, пропорциональна произведению концентрации этих молекул на температуру. Поэтому при заданной температуре, чем выше концентрация пара, тем большее давление он оказывает. Давление насыщенного пара зависит от вида жидкости и температуры. Чем тяжелее оторвать молекулы жидкости друг от друга, тем меньше будет давление её насыщенного пара. Так, давление насыщенного пара воды при температуре 20оС составляет около 2 кПа, а давление насыщенных пара ртути при 20оС - лишь 0,2 Па.
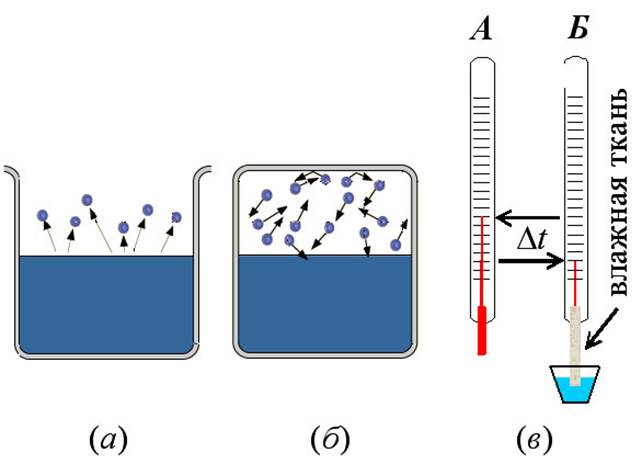
Жизнь человека, животных и растений зависит от концентрации водяных паров (влажности) атмосферы, которая изменяется в широких пределах в зависимости от места и времени года. Как правило, водяной пар вокруг нас является ненасыщенным. Относительной влажностью воздуха называют отношение давления водяных паров к давлению насыщенных паров при той же температуре, выраженное в процентах. Одним из приборов для измерения влажность воздуха является психрометр, состоящий из двух одинаковых термометров, один из которых обёрнут влажной тканью.
63. Зависимость давления насыщенного пара от температуры.
Пар – это газ, образованный испарившимися молекулами жидкости, и поэтому для него справедливо уравнение (23.7), связывающее давление пара, p, концентрацию молекул в нём, n и абсолютную температуру, T:
p = nkT. (27.1)
Из (27.1) следует, что давление насыщенного пара должно увеличиваться линейно с ростом температуры, как это имеет место у идеальных газов при изохорных процессах (см. §25). Однако, как показали измерения, давление насыщенного пара растёт с температурой гораздо быстрее, чем давление идеального газа (см. рис.27а). Происходит это из-за того, что с ростом температуры, а значит, и средней кинетической энергии, всё больше и больше молекул жидкости покидают её, увеличивая концентрацию, n пара над ней. А т.к. согласно (27.1) давление пропорционально n, то это увеличение концентрации пара и объясняет более быстрый рост давления насыщенного пара с температурой, по сравнению с идеальным газом. Рост давления насыщенных паров с температурой объясняет известный всем факт – при нагревании жидкости испаряются быстрее. Отметим, что, как только рост температуры приведёт к полному испарению жидкости, пар станет ненасыщенным.
При нагревании жидкости в каждом из пузырьков процесс испарения ускоряется, а давление насыщенного пара растёт. Пузырьки расширяются и под действием выталкивающей силы Архимеда отрываются от дна, всплывают и лопаются на поверхности. При этом пар, наполнявший пузырьки, уносится в атмосферу.
Чем меньше атмосферное давление, тем при более низкой температуре кипит данная жидкость (см. рис.27в). Так, на вершине горы Эльбрус, где давление воздуха в два раза меньше нормального, обычная вода кипит не при 100 оС, а при 82 оС. Наоборот, если необходимо повысить температуру кипения жидкости, то её нагревают при повышенном давлении. На этом, например, основана работа скороварок, где еда, содержащая воду, может вариться при температуре более 100 оС, не закипая.
64. Кипение.
Кипение – это интенсивный процесс испарения, происходящий по всему объёму жидкости и на её поверхности. Жидкость начинает кипеть, когда давление её насыщенного пара приближается к давлению внутри жидкости.
Кипением называют образование большого числа пузырьков пара, всплывающих и лопающихся на поверхности жидкости при её нагревании. На самом деле, эти пузырьки присутствуют в жидкости всегда, но их размеры растут, и они становятся заметны только при кипении. Одна из причин того, что в жидкости всегда есть микропузырьки, следующая. Жидкость, когда её наливают в сосуд, вытесняет оттуда воздух, но полностью этого сделать не может, и маленькие его пузырьки остаются в микротрещинах и неровностях внутренней поверхности сосуда. Кроме того, в жидкостях обычно содержатся микропузырьки пара и воздуха, прилипшие к мельчайшим частицам пыли.
При нагревании жидкости в каждом из пузырьков процесс испарения ускоряется, а давление насыщенного пара растёт. Пузырьки расширяются и под действием выталкивающей силы Архимеда отрываются от дна, всплывают и лопаются на поверхности. При этом пар, наполнявший пузырьки, уносится в атмосферу. Поэтому кипение и называют испарением, происходящим во всём объёме жидкости. Кипение начинается при той температуре, когда пузырьки газа имеют возможность расширяться, а это происходит, если давление насыщенного пара превышает атмосферное давление. Таким образом, температура кипения – это температура, при которой давление насыщенного пара данной жидкости равно атмосферному давлению. Пока жидкость кипит её температура остаётся постоянной.
Процесс кипения невозможен без участия архимедовой выталкивающей силы. Поэтому на космических станциях в условиях невесомости кипения нет, а нагрев воды приводит только к увеличению размеров пузырьков пара и их объединению в один большой паровой пузырь внутри сосуда с водой.
65. Критическая температура.
Также существует такое понятие как критическая температура, если газ находится при температуре выше критической (индивидуальна для каждого газа, например для углекислого газа примерно 304 К), то его уже невозможно превратить в жидкость, какое бы давление к нему не прилагалось. Данное явление возникает вследствие того, что при критической температуре силы поверхностного натяжения жидкости равны нулю.
Таблица 23. Критическая температура и критическое давление некоторых веществ

На что указывает существование критической температуры? Что будет при еще более высоких температурах?
Опыт показывает, что при температурах, более высоких чем критическая, вещество может находиться только в газообразном состоянии.
На существование критической температуры впервые указал в 1860 г. Дмитрий Иванович Менделеев.
После открытия критической температуры стало понятно, почему долго не удавалось превратить в жидкость такие газы, как кислород или водород. Их критическая температура очень низка (табл. 23). Чтобы превратить эти газы в жидкость, их нужно охладить ниже критической температуры. Без этого все попытки их сжижения обречены на неудачу.
66. Парциальное давление. Относительная влажность. 67. Приборы для измерения относительной влажности воздуха.
Жизнь человека, животных и растений зависит от концентрации водяных паров (влажности) атмосферы, которая изменяется в широких пределах в зависимости от места и времени года. Как правило, водяной пар вокруг нас является ненасыщенным. Относительной влажностью воздуха называют отношение давления водяных паров к давлению насыщенных паров при той же температуре, выраженное в процентах. Одним из приборов для измерения влажность воздуха является психрометр, состоящий из двух одинаковых термометров, один из которых обёрнут влажной тканью .Когда влажность воздуха меньше 100%, вода из ткани будет испаряться, а термометр Б - охлаждаться, показывая меньшую температуру, чем А. И чем меньше будет влажность воздуха, тем больше будет разница, Dt между показаниями термометров А и Б. С помощью специальной психрометрической таблицы по этой разнице температур можно определить влажность воздуха.
Парциальное давление - это давление определенного газа, входящего в состав газовой смеси, которое данный газ оказывал бы на стенки заключающей его ёмкости, если бы он один занимал весь объём смеси при температуре смеси.
Парциальное давление не измеряется непосредственно, но оценивается, исходя из общего давления и состава смеси.
Растворенные в воде или тканях тела газы также оказывают давление, потому что молекулы растворенного газа находятся в случайном движении и обладают кинетической энергией. Если растворенный в жидкости газ ударяется о поверхность, например клеточной мембраны, он оказывает парциальное давление так же, как и газ в газовой смеси.
П. д. непосредственно измерить нельзя, его вычисляют исходя из общего давления и состава смеси.
Факторы, определяющие величину парциального давления растворенного в жидкости газа. Парциальное давление газа в растворе определяется не только концентрацией, но и коэффициентом его растворимости, т.е. некоторые типы молекул, например двуокись углерода, физическим или химическим способом прикрепляются к молекулам воды, а другие — отталкиваются. Эти отношения называют законом Генри и выражают следующей формулой: Парциальное давление = Концентрация растворенного газа / Коэффициент растворимости.
68. Поверхностное натяжение.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Поверхностные молекулы силами межмолекулярного притяжения втягиваются внутрь жидкости. Но все молекулы, в том числе и молекулы пограничного слоя, должны находиться в состоянии равновесия. Это равновесие достигается за счет некоторого уменьшения расстояния между молекулами поверхностного слоя и их ближайшими соседями внутри жидкости. Как видно из рис. 3.1.2, при уменьшении расстояния между молекулами возникают силы отталкивания. Если среднее расстояние между молекулами внутри жидкости равно r0, то молекулы поверхностного слоя упакованы несколько более плотно, а поэтому они обладают дополнительным запасом потенциальной энергии по сравнению с внутренними молекулами (см. рис. 3.1.2). Следует иметь ввиду, что вследствие крайне низкой сжимаемости наличие более плотно упакованного поверхностного слоя не приводит к сколь-нибудь заметному изменению объема жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (т. е. увеличить площадь поверхности жидкости), внешние силы должны совершить положительную работу ΔAвнеш, пропорциональную изменению ΔS площади поверхности: ΔAвнеш = σΔS.
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения.
Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку, с той только разницей, что упругие силы в пленке зависят от площади ее поверхности (т. е. от того, как пленка деформирована), а силы поверхностного натяжения не зависят от площади поверхности жидкости.
Некоторые жидкости, как, например, мыльная вода, обладают способностью образовывать тонкие пленки. Всем хорошо известные мыльные пузыри имеют правильную сферическую форму – в этом тоже проявляется действие сил поверхностного натяжения. Если в мыльный раствор опустить проволочную рамку, одна из сторон которой подвижна, то вся она затянется пленкой жидкости.
69. Смачивание.
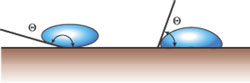
Всем известно, что, если поместить каплю жидкости на плоскую поверхность, она либо растечётся по ней, либо примет округлую форму. Причём размер и выпуклость (величина так называемого краевого угла) лежащей капли определяется тем, насколько хорошо она смачивает данную поверхность. Явление смачивания можно объяснить следующим образом. Если молекулы жидкости притягиваются друг к другу сильнее, чем к молекулам твёрдого тела, жидкость стремится собраться в капельку.
Острый краевой угол возникает на смачиваемой (лиофильной) поверхности, тупой — на несмачиваемой (лиофобной).
 Острый
краевой угол возникает на смачиваемой
(лиофильной) поверхности, тупой
— на несмачиваемой (лиофобной).
Острый
краевой угол возникает на смачиваемой
(лиофильной) поверхности, тупой
— на несмачиваемой (лиофобной).
Так ведёт себя ртуть на стекле, вода на парафине или на „жирной“ поверхности. Если же, наоборот, молекулы жидкости притягиваются друг к другу слабее, чем к молекулам твёрдого тела, жидкость „прижимается“ к поверхности, расплывается по ней. Это происходит с каплей ртути на цинковой пластине или с каплей воды на чистом стекле. В первом случае говорят, что жидкость не смачивает поверхность (краевой угол больше 90°), а во втором — смачивает её (краевой угол меньше 90°).
Именно водоотталкивающая смазка помогает многим животным спасаться от излишнего намокания. Например, исследования морских животных и птиц — котиков, тюленей, пингвинов, гагар — показали, что их пуховые волосы и перья обладают гидрофобными свойствами, тогда как остевые волосы зверей и верхняя часть контурных перьев птиц хорошо смачиваются водой. В результате между телом животного и водой создаётся воздушная прослойка, играющая значительную роль в терморегуляции и теплоизоляции.
Но смазка это ещё не всё. Немалую роль в явлении смачивания играет и структура поверхности. Шероховатый, бугристый или пористый рельеф может улучшить смачивание. Вспомним, к примеру, губки и махровые полотенца, прекрасно впитывающие воду. Но если поверхность изначально „боится“ воды, то развитый рельеф лишь усугубит ситуацию: капельки воды будут собираться на выступах и скатываться.
70. Капиллярные явления.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются.
На рис. 3.5.6 изображена капиллярная трубка некоторого радиуса r, опущенная нижним концом в смачивающую жидкость плотности ρ. Верхний конец капилляра открыт. Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю результирующей Fн сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: Fт = Fн, где Fт = mg = ρhπr2g, Fн = σ2πr cos θ.
Отсюда
следует:
![]()
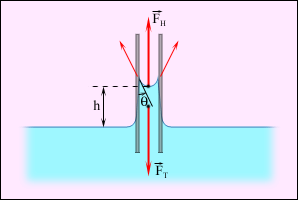
Рисунок 3.5.6.
Подъем смачивающей жидкости в капилляре.
При
полном смачивании θ = 0, cos θ = 1. В этом
случае
![]()
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Вода практически полностью смачивает чистую поверхность стекла. Наоборот, ртуть полностью не смачивает стеклянную поверхность. Поэтому уровень ртути в стеклянном капилляре опускается ниже уровня в сосуде.
71. Кристаллические тела и их свойства.
В отличие от жидкостей твердое тело сохраняет не только свой объем, но и форму и обладает значительной прочностью.
Разнообразные твердые тела, с которыми приходится встречаться, можно разделить на две группы, существенно различающиеся по своим свойствам: кристаллические и аморфные.
Основные свойства кристаллических тел
-
Кристаллические тела имеют определенную температуру плавления tпл, не изменяющуюся в процессе плавления при постоянном давлении (рис. 1, кривая 1).
-
Для кристаллических тел характерно наличие пространственной кристаллической решетки, которая представляет собой упорядоченное расположение молекул, атомов или ионов, повторяющееся по всему объему тела (дальний порядок). Для любой кристаллической решетки характерно существование такого элемента ее структуры, многократным повторением которого в пространстве можно получить весь кристалл. Это монокристалл. Поликристалл состоит из множества очень мелких, сросшихся между собой монокристаллов, которые ориентированы в пространстве хаотически.
-
Физические свойства (механические, электрические, магнитные, тепловые и др.) монокристаллов различны по разным направлениям внутри кристалла. Это явление называют анизотропией кристаллов. Оно объясняется различием в плотности расположения частиц в кристаллической решетке по разным направлениям. На рисунке 2 условно изображено расположение атомов в одной из плоскостей монокристалла. Через узлы этой плоской решетки проведены различно ориентированные параллельные прямые (1, 2, 3, 4). Видно, что на единицу длины прямых приходится не одинаковое количество атомов. А механические свойства кристалла зависят от плотности размещения образующих его частиц.
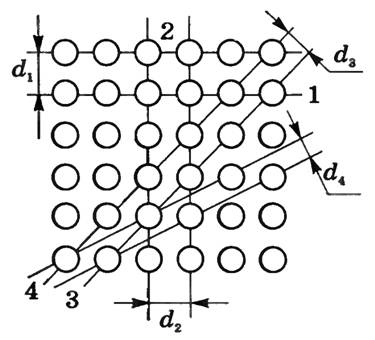
Поликристаллы изотропны.
-
Кристаллическая структура связана с минимумом потенциальной энергии, т.е. при образовании кристаллов частицы самопроизвольно располагаются так, чтобы их взаимная потенциальная энергия была минимальной.
72. Аморфные тела и их свойства.
Аморфные тела — это стекло, смола, канифоль, многие пластмассы, сургуч, пластическая сера, янтарь, различные полимеры — органические аморфные тела (целлюлоза, каучук, кожа, плексиглас, полиэтилен) и др.
-
У аморфных тел нет кристаллической решетки, у них обнаружен только ближний порядок в расположении молекул. На рисунке 1 изображена плоская схема расположения молекул кварца (а) и кварцевого стекла — аморфного тела (б).
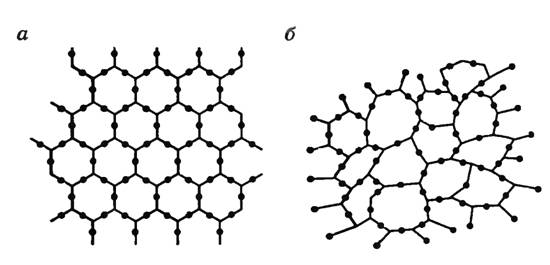
-
Аморфное тело обладает слабо выраженной текучестью. Так, если воронку наполнить кусочками воска, то через некоторое время (различное для разных температур) кусочки воска будут "расплываться". Воск примет форму воронки и начнет "вытекать" из нее. Текучесть связана с перескоками молекул из одного положения равновесия в другое.
-
У аморфных тел нет определенной температуры плавления. Вещество в аморфном состоянии при нагревании постепенно размягчается и переходит в жидкость . Вместо температуры плавления приходится говорить о температурном интервале размягчения.
-
Аморфные тела изотропны, т.е. их физические свойства по всем направлениям одинаковы.
-
Внутренняя энергия вещества в аморфном состоянии больше, чем в кристаллическом. Поэтому аморфные тела могут самопроизвольно переходить в кристаллическое состояние (пример: помутнение со временем стекол).
73. Виды деформации твердых тел.
Под внешним воздействием тела могут деформироваться.
Деформация — изменение формы и размеров тела. Причина деформации заключается в том, что различные части тела совершают неодинаковые перемещения при действии на тело внешних сил.
Деформации, которые полностью исчезают после прекращения действия силы, — упругие, которые не исчезают, — пластические.
-
При упругих деформациях происходит изменение расстояния между частицами тела. В недеформированном теле частицы находятся в определенных положениях равновесия (расстояния между выделенными частицами r0 — см. рис. 1, б), в которых силы отталкивания и притяжения, действующие со стороны других частиц, равны. При изменении расстояния между частицами одна из этих сил начинает превышать другую. В результате возникает равнодействующая этих сил, стремящаяся вернуть частицу в прежнее положение равновесия. Равнодействующая сил, действующих на все частицы деформированного тела, и есть наблюдаемая на практике сила упругости. Таким образом, следствием упругой деформации является возникновение упругих сил.
-
При пластической деформации, как показали наблюдения, смещения частиц в кристалле имеют совсем другой характер, чем при упругой. При пластической деформации кристалла происходит соскальзывание слоев кристалла относительно друг друга (рис. 1, а, б). Это можно увидеть с помощью микроскопа: гладкая поверхность кристаллического стержня после пластической деформации становится шероховатой. Соскальзывание происходит вдоль слоев, в которых больше всего атомов .
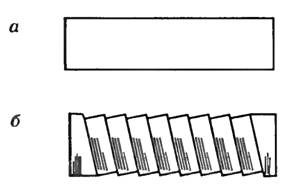
-
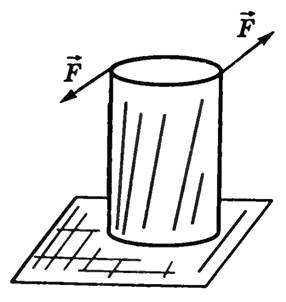
Деформация растяжения (сжатия). Линейная деформация возникает при приложении силы вдоль оси стержня, закрепленного с одного конца (рис. 3, а, б). При линейных деформациях слои тела остаются параллельными друг другу, но изменяются расстояния между ними. Линейную деформацию характеризуют абсолютным и относительным удлинением.
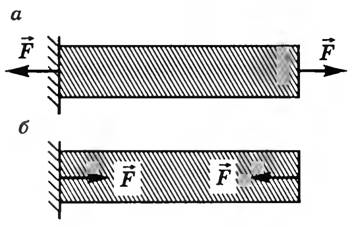
-
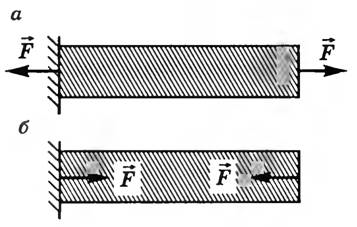
Деформация сдвига возникает под действием сил, приложенных к двум противоположным граням тела так, как показано на рисунке 4. Эти силы вызывают смещение слоев тела, параллельных направлению сил. Расстояние между слоями не изменяется. Любой прямоугольный параллелепипед, мысленно выделенный в теле, превращается в наклонный. Мерой деформации сдвига является угол сдвига γ — угол наклона вертикальных граней. Деформацию сдвига испытывают, например, заклепки и болты, соединяющие металлические конструкции. Сдвиг при больших углах приводит к разрушению тела — срезу. Срез происходит при работе ножниц, пилы и др.
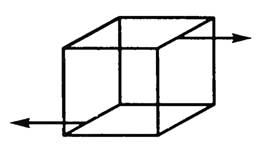
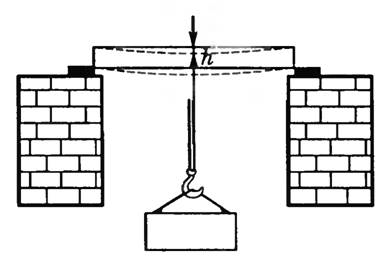
-
Деформации изгиба подвергается балка, закрепленная с одного конца или закрепленная с двух концов, к середине которой подвешен груз (рис. 6). Деформация изгиба характеризуется стрелой прогиба h — смещением середины балки (или его конца). При изгибе выпуклые части тел испытывают растяжение, а вогнутые — сжатие, средние части тела практически не деформируются — нейтральный слой. Наличие среднего слоя практически не влияет на сопротивляемость тела изгибу, поэтому такие детали выгодно делать полыми (экономия материала и значительное снижение их массы). В современной технике широко используются полые балки, трубки. У человека кости тоже трубчатые.
-
Деформацию кручения можно наблюдать, если на стержень, один конец которого закреплен, действует пара сил (рис. 7), лежащих в плоскости, перпендикулярной оси стержня. При кручении отдельные слои тела остаются параллельными, но поворачиваются друг относительно друга на некоторый угол. Деформация кручения представляет собой неравномерный сдвиг. Деформации кручения возникают при завинчивании гаек, при работе валов машин.
74. Диаграмма растяжения.
Деформация растяжения (сжатия). Линейная деформация возникает при приложении силы вдоль оси стержня, закрепленного с одного конца (рис. 3, а, б). При линейных деформациях слои тела остаются параллельными друг другу, но изменяются расстояния между ними. Линейную деформацию характеризуют абсолютным и относительным удлинением.
Абсолютное удлинение Δl = l - l0, где l — длина деформированного тела, l0 — длина тела в недеформированном состоянии.
Относительное
удлинение
![]() — отношение абсолютного удлинения к
длине недеформированного тела.
— отношение абсолютного удлинения к
длине недеформированного тела.
На практике растяжение испытывают тросы подъемных кранов, канатных дорог, буксирные тросы, струны музыкальных инструментов. Сжатию подвергаются колонны, стены и фундаменты зданий и т.д.
Расчеты прочности и жесткости конструкций и их деталей невозможно осуществить, если неизвестны механические свойства реальных материалов и их числовые характеристики, которые могут быть определены только экспериментальным путем.
Важность экспериментальных исследований объясняется еще и тем, что все решения сопротивления материалов являются приближенными. Поэтому их достоверность и пределы применимости могут быть установлены лишь экспериментально. Механические свойства материалов при различных видах деформаций (растяжении, сжатии, кручении и т. д.) изучаются путем испытания на специальных машинах брусьев простейшей формы, называемых образцами. Испытания проводятся обычно при комнатной температуре. В последнее время большое внимание уделяется исследованию свойств материалов при повышенных температурах. Наибольшей простотой и надежностью результатов отличаются испытания на растяжение. Испытательные машины снабжены динамометрами для замеров нагрузки на образец, а деформации образцов измеряются специальными приборами - тензометрами, устанавливаемыми непосредственно на образцах.
В процессе испытания изучается зависимость между нагрузками и вызванными ими удлинениями. Эту зависимость принято представлять в виде диаграмм растяжения. Как правило, испытательные машины оборудованы специальными приспособлениями для автоматической записи таких диаграмм.
При построении диаграмм растяжения по оси абсцисс откладываются удлинения Δl рабочей части образца, а по оси ординат - соответствующие им значения растягивающей силы P
На Рис.4.4 представлена диаграмма растяжения образца из малоуглеродистой стали. Эту диаграмму можно разделить на три характерных участка.
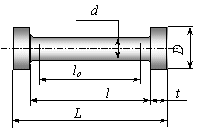
Рис. 4.3. Образец для испытаний на растяжение
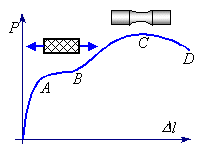
Рис. 4.4. Первичная диграмма растяжения пластичного материала с площадкой текучести

Рис. 4.5. Первичные диаграммы растяжения
На участке ОА, соответствующем стадии упругости образца, деформации материала подчиняются закону Гука.
На участке АВ рост нагрузки замедляется, а затем почти прекращается при одновременном росте удлинений. Явление значительного роста удлинений без заметного увеличения нагрузки называется текучестью, а горизонтальный (или почти горизонтальный) участок диаграммы растяжения называется площадкой текучести.
На стадии общей текучести полированная поверхность образца покрывается сеткой тонких линий (см. Рис. 4.4), называемых линиями сдвига, или линиями Чернова, по фамилии русского металлурга, впервые заметившего их. Эти линии являются следами плоскостей скольжения (сдвига) частиц материала друг относительно друга. Они наклонены к оси бруса под углом, близким к 45°, и практически совпадают с плоскостями действия максимальных касательных напряжений.
Многие материалы, например легированные стали, дюралюминий, обнаруживают пластические свойства, но площадки текучести не имеют. Характер диаграмм растяжения для дюралюминия и легированной стали представлен на Рис. 4.5.
75. Пластичность и хрупкость.
Пласти́чность — способность материала без разрушения получать большие остаточные деформации. Свойство пластичности имеет решающее значение для таких технологических операций, как штамповка, вытяжка, волочение, гибка и др. Мерой пластичности является удлинение δ при разрыве. Чем больше δ, тем более пластичным считается материал. К числу весьма пластичных материалов относятся отожженная медь, алюминий, латунь, золото, малоуглеродистая сталь и др. Менее пластичными являются дюраль и бронза.
У пластичных материалов прочностные характеристики на растяжение и сжатие сопоставляют по пределу текучести. Принято считать, что σт.р≈σ т.с.
ХРУПКОСТЬ -свойство материала разрушаться при небольшой (преим. упругой) деформации под действием напряжений, ср. уровень к-рых ниже предела текучести.
Деление материалов на пластичные и хрупкие является условным не только потому, что между теми и другими не существует резкого перехода в значениях δ. В зависимости от условий испытания многие хрупкие материалы способны вести себя как пластичные, а пластичные — как хрупкие.
Очень большое влияние на проявление свойств пластичности и хрупкости оказывают скорость нагружения и температура. При быстром нагружении более резко проявляется свойство хрупкости, а при медленном — свойство пластичности. Например, хрупкое стекло способно при длительном воздействии нагрузки при нормальной температуре получать остаточные деформации. Пластичные же материалы, такие как малоуглеродистая сталь, под воздействием резкой ударной нагрузки проявляют хрупкие свойства.
