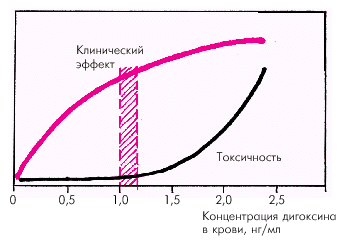
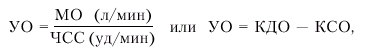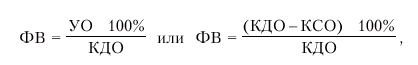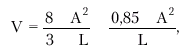- •Глава 2. Сердечная недостаточность
- •Глава 3. Нарушения сердечного ритма и проводимости
- •Глава 4. Атеросклероз
- •Глава 5. Хроническая ишемическая болезнь сердца
- •Глава 6. Ишемическая болезнь сердца: нестабильная стенокардия, инфаркт миокарда, внезапная смерть
- •Глава 7. Эссенциальная артериальная гипертензия (гипертоническая болезнь)
- •Глава 8. Приобретенные пороки сердца
- •Глава 9. Инфекционный эндокардит
- •Глава 10. Кардиомиопатии
- •Глава 11. Миокардиты
- •Глава 12. Перикардиты
- •Глава 14. Тромбоэмболия легочной артерии и острое легочное сердце
- •Глава 3. Нарушения сердечного ритма и проводимости
- •3.2. Электрофизиологические механизмы аритмий
- •1. Нарушения образования импульса:
- •2. Нарушения проведения импульса:
- •3. Комбинированные нарушения образования и проведения импульса:
- •3.2.1. Нарушения образования импульса
- •3.2.2. Нарушения проведения импульса
- •3.3. Методы диагностики нарушений сердечного ритма
- •3.3.1. Клиническое исследование
- •3.3.2. Электрокардиография
- •3.3.3. Длительное мониторирование экг по Холтеру
- •3.3.4. Внутрисердечное электрофизиологическое исследование (эфи)
- •3.3.5. Чреспищеводная электрическая стимуляция сердца (чпэс)
- •3.4. Диагностика аритмий
- •I. Нарушение образования импульса.
- •II. Нарушения проводимости.
- •III. Комбинированные нарушения ритма.
- •3.4.1. Наджелудочковые нарушения ритма
- •3.4.2. Желудочковые аритмии
- •3.4.3. Нарушения проводимости
- •3.5. Лечение нарушений сердечного ритма и проводимости
- •3.5.1. Медикаментозное лечение аритмий
- •3.5.2. Электрокардиостимуляция
- •3.5.3. Электрическая кардиоверсия
- •3.5.4. Хирургическое лечение тахиаритмий
- •Глава 4. Атеросклероз
- •Клиническая классификация ибс (вкнц амн ссср, 1984)
- •Рабочая классификация ибс
- •Глава 6. Ишемическая болезнь сердца: нестабильная стенокардия, инфаркт миокарда, внезапная смерть
- •2. Аритмии, усугубляющие сердечную недостаточность и гипоперфузию жизненно важных органов:
- •3. Аритмии — предвестники жизнеопасных нарушений сердечного ритма:
- •4. Аритмии — “спутники” острого им:
- •Классификация аг по степени повышения ад (jnc — VI, сша, 1997)
- •3. Оценить наличие факторов риска аг:
- •4. Оценить эффективность предыдущего антигипертензивного лечения.
- •Глава 10. Кардиомиопатии
- •Глава 11. Миокардиты
- •I. Острые перикардиты (менее 6 недель от начала заболевания):
- •II. Подострые перикардиты (от 6 недель до 6 месяцев от начала заболевания):
- •III. Хронические перикардиты (более 6 месяцев от начала заболевания):
- •I. Нарушение образования импульса
- •II. Нарушения проводимости:
- •III. Комбинированные нарушения ритма:
Глава 12. Перикардиты
|
12.1. |
Этиология |
||||||||
|
12.2. |
Клинико-морфологическая классификация и патогенез перикардитов |
||||||||
|
|
Запомните |
||||||||
|
12.3. |
Клиническая картина и диагностика
|
||||||||
|
|
Запомните |
||||||||
|
12.4. |
Лечение перикардитов |
||||||||
|
|
Запомните |
||||||||
|
12.5. |
Прогноз |
Глава 14. Тромбоэмболия легочной артерии и острое легочное сердце
|
14.1. |
Этиология |
||||||||||
|
|
Запомните |
||||||||||
|
14.2. |
Патогенез
|
||||||||||
|
|
Запомните |
||||||||||
|
14.3. |
Клиническая картина
|
||||||||||
|
|
Запомните |
||||||||||
|
14.4. |
Лабораторная и инструментальная диагностика
|
||||||||||
|
|
Запомните |
||||||||||
|
14.5. |
Лечение
|
||||||||||
|
14.6. |
Профилактика ТЭЛА и тромбоза глубоких вен нижних конечностей |
|
1.1. Сердце |
|
|
|
1.1.1. Строение сердца
|
||||||||||||
|
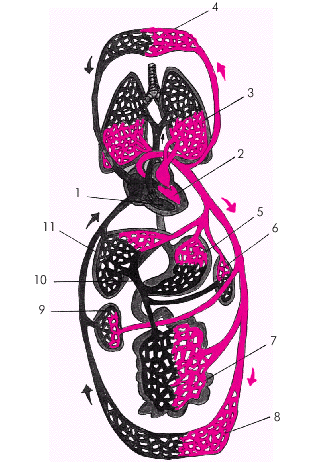
Система кровообращения (рис. 1.1) представлена большим (8) и малым (3) кругами кровообращения. Основная функция малого круга — обеспечение перфузии легких, адекватной легочной вентиляции и поступление оксигенированной артериальной крови в левые отделы сердца и большой круг кровообращения. Последний обеспечивает приток артериальной крови ко всем внутренним органам и отток от них венозной крови, поступающей затем в правые отделы сердца.
На рисунке 1.2 представлено схематическое изображение передней и задней поверхности сердца.
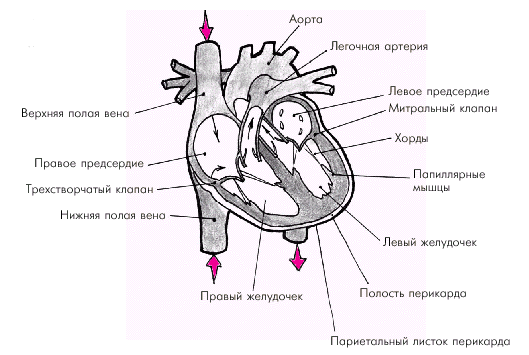
Следует помнить также о взаимном пространственном расположении магистральных артерий и вен, входящих в состав сосудистого пучка: аорты, ствола легочной артерии (ЛА) и верхней полой вены (рис. 1.2, а). На рис. 1.3 представлено схематическое изображение камер сердца (предсердий и желудочков), а также аорты, легочной артерии, верхней и нижней полых вен, впадающих в ПП, и легочных вен, доставляющих кровь в ЛП. Предсердия и желудочки отделены друг от друга атриовентрикулярными клапанами (митральным и трикуспидальным), створки которых плотно смыкаются во время систолы желудочков, препятствуя регургитации крови из желудочков в предсердия. Плотность смыкания створок атриовентрикулярных клапанов зависит не только от их анатомической целостности, но и от функции всего клапанного аппарата, в том числе сухожильных нитей (хорд) и папиллярных мышц. В выходной части правого и левого желудочков расположены клапаны легочной артерии и аорты, каждый из которых состоит из трех полулунных заслонок, своей вогнутой поверхностью обращенных в просвет соответствующего магистрального сосуда. Между заслонкой и стенкой сосуда имеется небольшой карман (синус). При расслаблении желудочков, когда давление в полости желудочков падает, возвратный ток крови из легочной артерии и аорты заполняет синусы и раскрывает заслонки, края которых плотно смыкаются и не пропускают кровь из сосуда в желудочек.
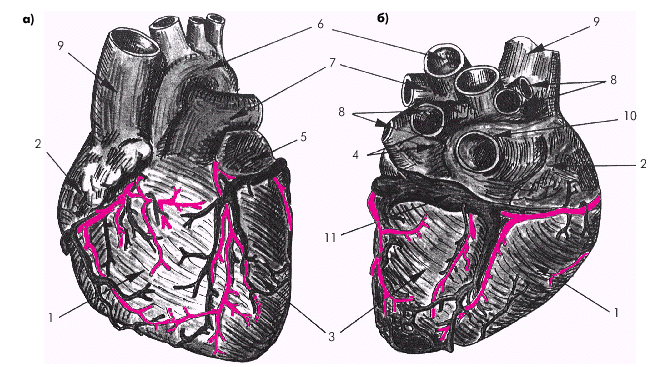
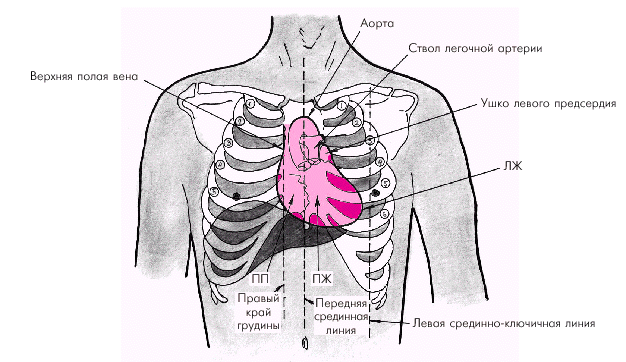
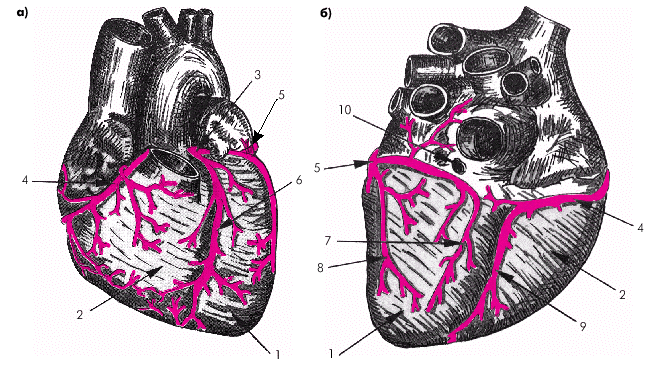
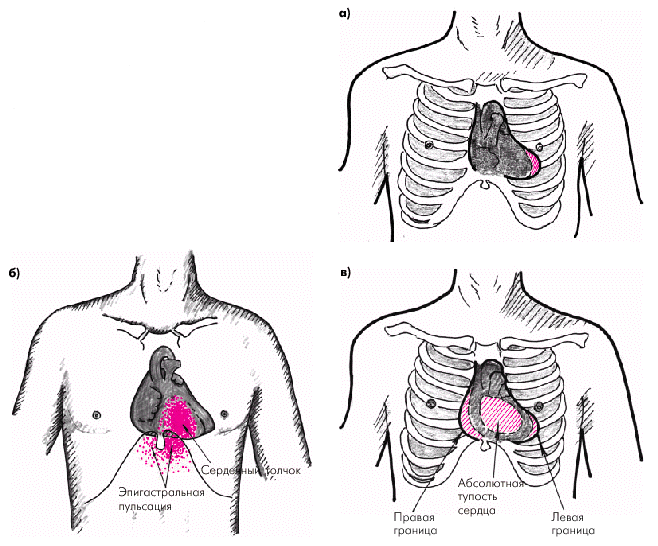
Стенка сердца состоит из трех слоев: эндокарда, миокарда и эпикарда. Эндокард в виде тонкой (около 0,6 мм) соединительнотканной оболочки выстилает изнутри все полости сердца, клапаны, хорды и папиллярные мышцы. Миокард состоит из отдельных мышечных волокон, каждое из которых включает большое количество мышечных клеток (кардиомиоцитов), последовательно соединенных друг с другом посредством вставочных дисков (нексусов). С помощью нексусов отдельные кардиомиоциты связаны в единую мышечную сеть — функциональный синцитий, который обеспечивает ритмичное и почти синхронное сокращение всех рабочих мышечных волокон. Толщина миокарда предсердий не превышает в норме 2–3 мм, левого желудочка — 7–8 мм, а правого желудочка — 3–4 мм. Эпикард покрывает наружную поверхность сердца, начальные отделы восходящей части аорты, легочного ствола и конечные отделы полых и легочных вен. Эпикард состоит из соединительной ткани, сращенной с мышечным слоем. У основания сердца он переходит в париетальный листок перикарда — околосердечной сумки, которая окружает сердце, начальные отделы аорты, легочного ствола и устья полых и легочных вен и отграничивает сердце от соседних органов (рис. 1.3). В норме полость перикарда содержит около 20–30 мл прозрачной серозной жидкости, которая снижает трение стенок сердца во время его сокращения и расслабления. На рис. 1.4 изображена проекция сердца на переднюю грудную стенку. Следует помнить, что у здорового человека левая граница сердца (верхушка), образованная ЛЖ, расположена на 1,0–1,5 см кнутри от левой срединно-ключичной линии; правая граница, представленная ПП, — на уровне правого края грудины или на 1,0 см вправо от него, а верхняя граница сердца (ушко ЛП) — на уровне верхнего края III ребра у левого края грудины. Артериальное кровоснабжение сердца (рис. 1.5) осуществляется преимущественно правой (4) и левой (3) коронарными артериями (соответственно ПКА и ЛКА). ЛКА делится на две крупные ветви: переднюю межжелудочковую ветвь (ПМЖВ) и огибающую ветвь (ОВ). Нередко встречается и третья (диагональная) ветвь ЛКА, обычно отходящая от ОВ.
Крупные вены сердца, собирающие кровь преимущественно из стенки ЛЖ, впадают в коронарный синус, расположенный на задней поверхности сердца (рис. 1.2, б). Оттуда кровь попадает в ПП. Часть вен, собирающих кровь из стенки ПЖ, впадает в ПП, минуя коронарный синус. Наконец, малые вены сердца (вены Вьессена–Тебезия) впадют непосредственно в полость желудочков и предсердий. |
|
1.1.2. Основные функции сердца |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
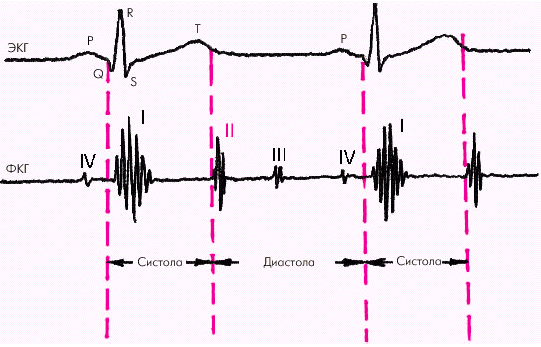
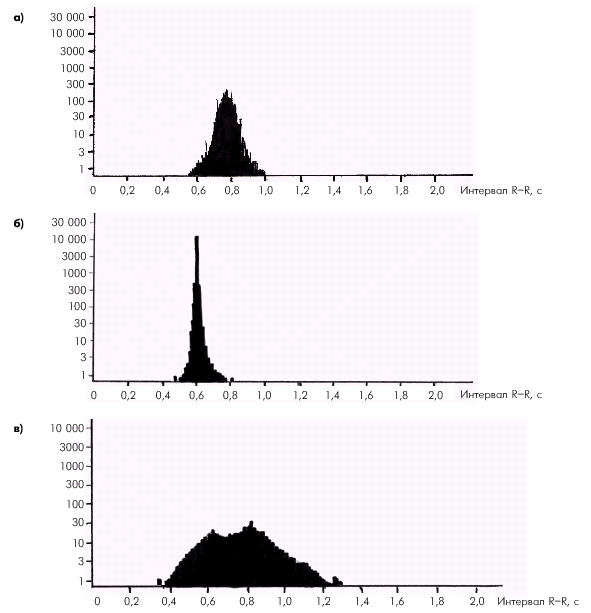
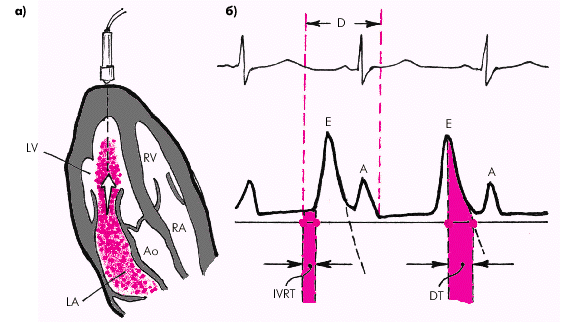
Фазовая структура сердечного цикла Работа сердца как насоса обеспечивается сложной последовательностью сокращения и расслабления желудочков и предсердий, что составляет фазовую структуру сердечного цикла, которая представлена на рис. 1.19.
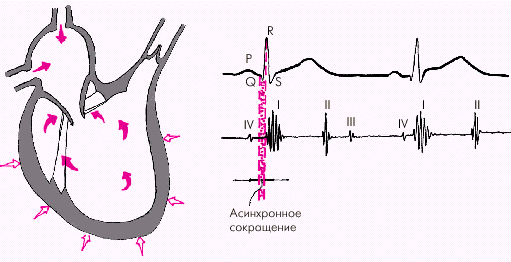
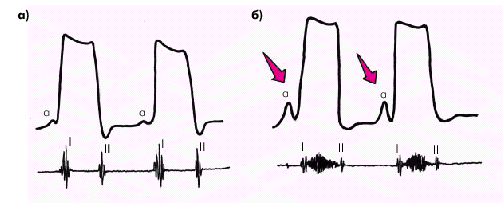
Систола желудочков начинается с фазы асинхронного сокращения, которая определяется от начала комплекса QRS на ЭКГ до первых высокочастотных осцилляций I тона сердца на ФКГ (рис. 1.20). В течение этой фазы электрическое возбуждение быстро распространяется по миокарду желудочков и инициирует сокращение отдельных мышечных волокон. Их сокращение происходит асинхронно, поэтому внутрижелудочковое давление не возрастает, хотя форма желудочков существенно меняется. В конце этой фазы атриовентрикулярные клапаны неплотно смыкаются, но их напряжения и, соответственно, колебательных движений еще не наблюдается.
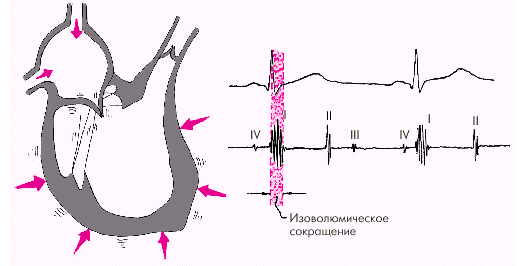
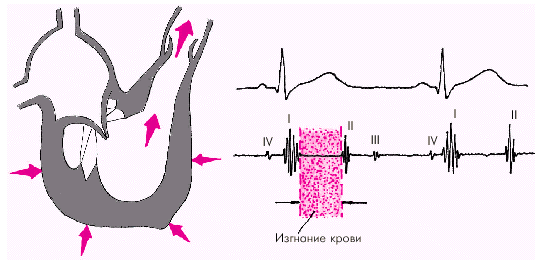
Фаза изоволюмического сокращения (рис. 1.21) характеризуется быстрым и мощным сокращением миокарда желудочков, в результате чего в условиях полностью закрытых атриовентрикулярных и полулунных клапанов происходит резкое повышение внутрижелудочкового давления. Во время этой фазы возникает I тон сердца.
Как только давление в желудочках становится чуть больше чем в аорте и легочной артерии, открываются полулунные клапаны, и кровь поступает в магистральные сосуды — начинается фаза изгнания (рис. 1.22).
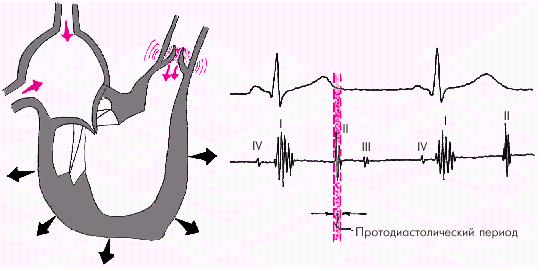
Диастола желудочков включает 5 фаз. Протодиастолический период (рис. 1.23) соответствует времени закрытия полулунных клапанов аорты и легочной артерии. В результате начавшегося расслабления миокарда желудочков давление в них падает чуть ниже давления в магистральных сосудах, что и является причиной закрытия клапанов. Во время этой фазы возникает II тон сердца.
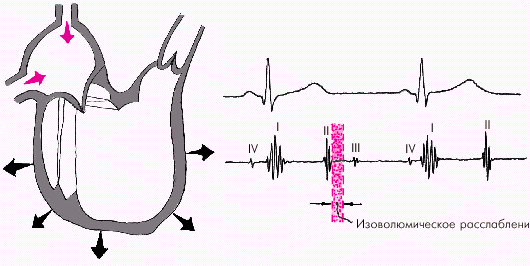
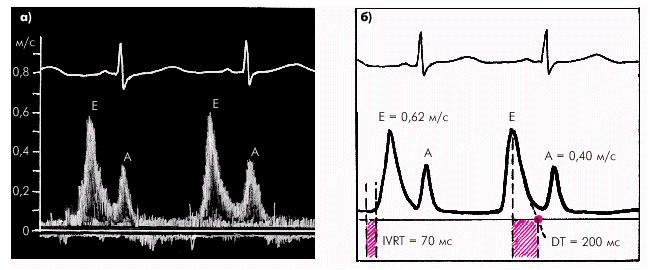
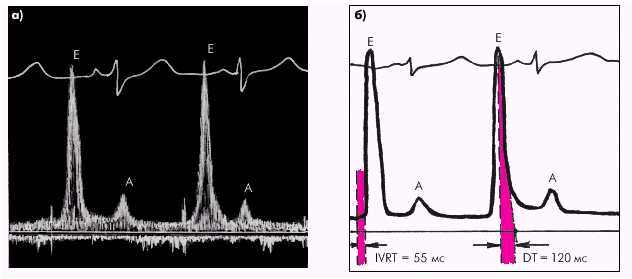
Во время фазы изоволюмического расслабления (рис. 1.24) продолжается активное расслабление желудочков, давление в них падает до уровня давления в предсердиях, после чего открываются атриовентрикулярные клапаны. Фаза изоволюмического расслабления в норме протекает в условиях герметически закрытых атриовентрикулярных и полулунных клапанов, и обьем желудочков не меняется.
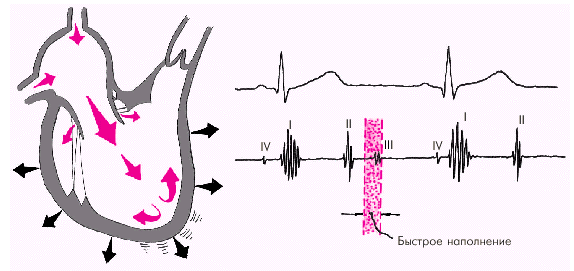
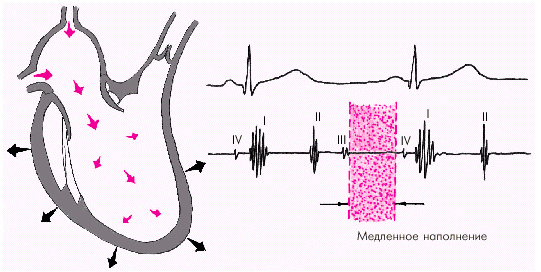
Далее начинается продолжительный период наполнения желудочков, включающий три диастолические фазы. Во время фазы быстрого наполнения (рис. 1.25) кровь «пассивно», под действием градиента давлений поступает из предсердия в желудочки, причем в течение этой фазы происходит максимальное наполнение желудочков кровью. В конце этой фазы при определенных условиях (см. ниже) может возникнуть III дополнительный тон сердца.
В дальнейшем давление в предсердии и желудочке выравнивается, и наполнение последних замедляется. Это фаза медленного наполнения желудочков (рис. 1.26).
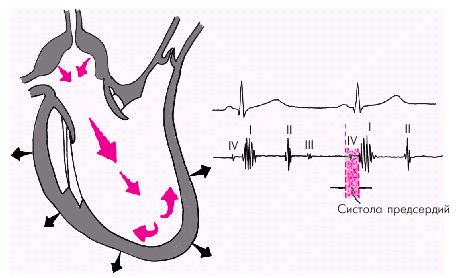
Последняя диастолическая фаза (фаза систолы предсердий) характеризуется сокращением миокарда предсердий и активным изгнанием крови из предсердий в желудочки (риc. 1.27). В конце этой фазы створки атриовентрикулярных клапанов «всплывают» и неплотно смыкаются — желудочек вновь готов к очередному сокращению. При определенных условиях (см. ниже) во время этой фазы может возникнуть IV дополнительный тон сердца.
Давление в камерах сердца Описанная последовательность сокращения и расслабления предсердий и желудочков обеспечивает достижение давлений в полостях сердца и магистральных сосудах, необходимых для нормального выброса крови в артериальную систему и адекватного наполнения камер сердца во время диастолы. Нормальные величины давления приведены в табл. 1.1. Таблица 1.1 Нормальные величины давления в полостях сердца и магистральных сосудах в покое (мм рт. ст.)
Как видно из таблицы, в норме систолическое давление в ЛЖ и аорте значительно выше, чем в ПЖ и легочной артерии, тогда как величины диастолического давления в этих отделах отличаются в меньшей степени. Обращают на себя внимание также очень близкие значения конечно-диастолического давления в ЛЖ (КДДлж), среднего давления в ЛП и диастолического давления в легочной артерии. Особое практическое значение имеет определение конечно-диастолического давления в ЛЖ, величина которого в покое и при физической нагрузке часто используется для характеристики функции желудочка. Повышение КДДлж ведет к росту давления в левом предсердии и легочных капиллярах. Если оно превышает 25–30 мм рт. ст., развивается альвеолярный отек легких. Таким образом, повышение КДДлж в большинстве случаев является весьма неблагоприятным прогностическим признаком. Снижение КДДлж нередко является указанием на наличие гиповолемии, сопровождающейся, как правило, уменьшением конечно-диастолического объема ЛЖ (кровопотеря, шок различного происхождения, длительный пароксизм суправентрикулярной или желудочковой тахикардии и т.п.). Систолическая функция сердца Основным показателем, характеризующим систолическую функцию сердца, является величина сердечного выброса. Сердечный выброс (или минутный объем крови — МО) — это количество крови, выбрасываемой желудочком в минуту. В норме эта величина варьирует в широких пределах: при необходимости сердечный выброс может увеличиваться в 3–5 раз по сравнению с покоем. Сердечный выброс рассчитывается следующим образом:
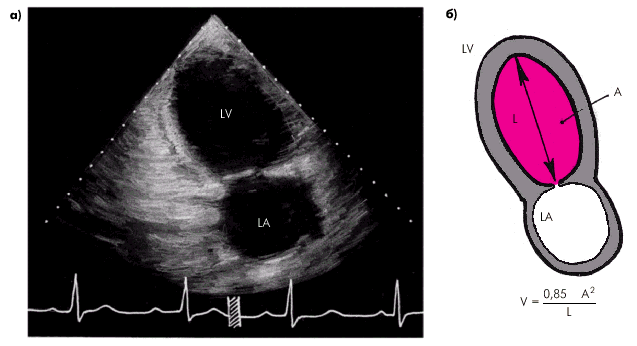
где МО — минутный объем крови (сердечный выброс), УО — ударный объем, ЧСС — частота сердечных сокращений. Помимо величины сердечного выброса (МО), в клинике рассчитывают и другие показатели, часть из которых, по сути, являются производными МО и ЧСС: · ударный объем (УО) — количество крови, выбрасываемой желудочком в магистральный сосуд при каждом сокращении:
где КДО — конечно-диастолический, а КСО — конечно-систолический объемы желудка; · фракцию выброса (ФВ) — отношение УО к конечно-диастолическому объему желудочка (в %):
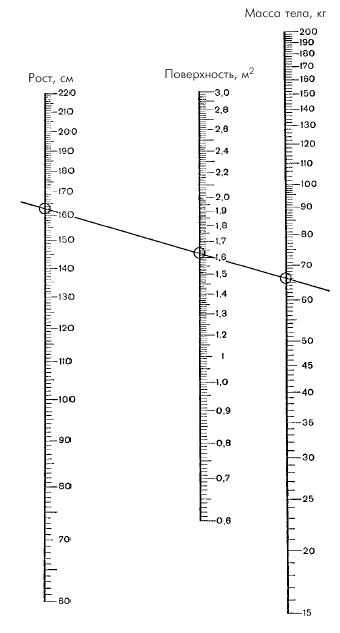
где ФВ — фракция выброса, УО — ударный объем; КДО — конечно-диастолический объем желудочка, КСО — конечно-систолический объем. Фракция выброса (ФВ) — важнейший интегральный показатель систолической функции сердца, указывающий, какая часть конечно-диастолического объема крови (КДО) выбрасывается из желудочков во время их систолы. · Сердечный индекс (СИ), который представляет собой отношение МО крови к площади поверхности тела (S, м2). СИ вычисляют по формуле:
При этом площадь поверхности тела (S) определяют по номограмме (рис. 1.28) или рассчитывают по специальной формуле: · ударный индекс (УИ) — отношение ударного объема к площади поверхности тела (S, м2). УИ вычисляют по формуле:
где S — площадь поверхности тела (м2). Для адекватной оценки систолической функции сердца необходимо учитывать также: · конечно-диастолический объем желудочка (КДО); · конечно-систолический объем желудочка (КСО); · конечно-диастолическое давление в желудочке (КДД).
Чтобы правильно интерпретировать изменения сердечного выброса и другие гемодинамические показатели в каждом конкретном случае необходимо оценивать все факторы, влияющие на значения этого показателя.
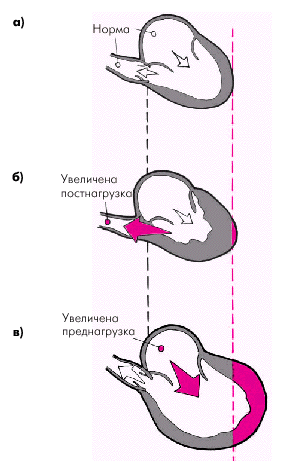
Величина преднагрузки. Уменьшение диастолического наполнения желудочков и КДО сопровождается падением сердечного выброса и УО. Наоборот, чем больше наполнение желудочков в диастолу (КДО), тем, согласно закону Старлинга, больше сила последующего сокращения и, соответственно, величина УО, МО и т.п. Правда, это последнее положение справедливо только до тех пор, пока сердечная мышца не окажется «перерастянутой», когда дальнейшее увеличение КДО приводит не к увеличению, а к уменьшению силы сокращения и УО. Величина преднагрузки и КДО желудочков зависит от многих факторов, важнейшими из которых являются следующие (рис. 1.29). 1. Объем циркулирующей крови (ОЦК). Его уменьшение (при кровопотере, шоке, обезвоживании) закономерно приводит к снижению сердечного выброса, а увеличение (задержка натрия и жидкости в организме, не связанная с сердечной недостаточностью) — к повышению МО. 2. Приток крови к сердцу в большинстве случаев является решающим фактором, определяющим величину КДО желудочков. Увеличение притока крови к правым отделам сердца и, соответственно, минутного объема (МО) наблюдается: 1) при горизонтальном положении тела пациента; 2) при увеличении тонуса вен при мышечной работе, психоэмоциональном напряжении и т.п., а также 3) при увеличении «насосной» функции скелетных мышц (мышечная нагрузка). Уменьшение притока крови и сердечного выброса наблюдается: 1) при вертикальном положении тела пациента; 2) при увеличении внутригрудного давления (напряженный пневмоторакс, обструктивные заболевания легких, приступы малопродуктивного кашля и др.); 3) при повышении давления в полости перикарда (экссудативный или констриктивный перикардит, гидроперикард); 4) при резком падении тонуса вен (обморок, коллапс, прием нитроглицерина и т.п.); 5) при гиподинамии (за счет отсутствия «насосного» действия скелетных мышц). 3. Сокращение предсердий. При отсутствии синхронизированного с работой желудочков сокращения предсердий (мерцательная аритмия, трепетание предсердий) уменьшается диастолическое наполнение желудочков и, соответственно, сердечный выброс. 4. Общая продолжительность диастолы. Тахикардия сопровождается значительным уменьшением продолжительности диастолы и, соответственно, величины преднагрузки. При синусовой брадикардии, наоборот, наблюдается увеличение наполнения желудочков. Инотропное состояние (сократимость) миокарда во многих случаях является главным фактором, определяющим величину сердечного выброса. Сократимость миокарда в свою очередь определяется следующими факторами. 1. Активностью симпатической нервной системы. 2. Частотой сердечных сокращений (ЧСС). 3. Наличием у больного некоторых патологических состояний, угнетающих сократимость миокарда (гипоксемии, ацидоза, гиперкапнии, ишемии сердечной мышцы, воспаления миокарда и т.п.). 4. Массой функционирующего миокарда, уменьшение которой при выраженной ишемии сердечной мышцы, инфаркте миокарда, кардиосклерозе приводит к снижению сократимости. 5. Выраженной дилатацией желудочков любого генеза, которая, согласно закону Старлинга, приводит к снижению максимально возможного напряжения миокарда (см. выше). 6. Лекарственными средствами, обладающими инотропным действием — отрицательным (блокаторы b-адренорецепторов, новокаинамид, хинидин, барбитураты и др.) или положительным (норадреналин и его производные, сердечные гликозиды и др.). Величина постнагрузки желудочков соответствует сопротивлению, которое испытывает желудочек при своем сокращении (рис. 1.30). Степень и скорость укорочения мышечного волокна и значения сердечного выброса обратно пропорциональны постнагрузке, испытываемой сердечной мышцей. Величину постнагрузки определяют несколько факторов: 1. Уровень давления крови в аорте и легочной артерии. 2. Степень напряжения сердечной мышцы, возрастающая при значительной дилатации сердца (закон Лапласа). 3. Величина системного и легочного сосудистого сопротивления. 4. Объем циркулирующей крови (ОЦК). 5. Вязкость крови и другие параметры. Таким образом, все перечисленные факторы, влияющие на систолическую функцию сердечной мышцы, сложным образом взаимодействуют между собой. Поэтому интерпретация изменений каждого гемодинамического показателя, характеризующего преднагрузку, сократимость миокарда и постнагрузку, требует одновременной оценки всех остальных. Например, ФВ (так же, как и величина сердечного выброса) может уменьшаться не только при снижении сократимости желудочков, но и при гиповолемии (шок, острая кровопотеря), уменьшении притока крови к правому сердцу (снижение преднагрузки), при резком и быстром подъеме АД (увеличение постнагрузки) и т.п.
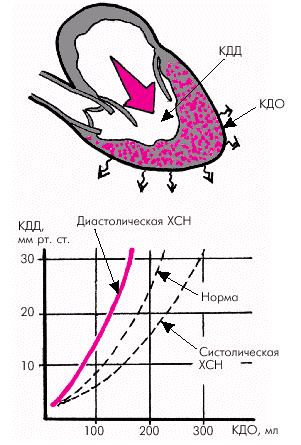
В других случаях, несмотря на снижение инотропной функции миокарда, сердечный выброс может длительное время оставаться в пределах нормальных значений, хотя резко повышенными оказываются конечно-диастолическое давление и объем желудочка (КДД и КДО), а также давление в предсердии и легочной артерии. В этих случаях сохранение должной величины МО обеспечивается повышенным растяжением сердечной мышцы, увеличением конечно-диастолического объема желудочка и включением механизма Старлинга. Диастолическая функция сердца Диастолическая функция сердца — это способность желудочков во время диастолы вместить необходимый объем крови (КДО), поступающей в них из предсердий. Диастолическая функция определяется:
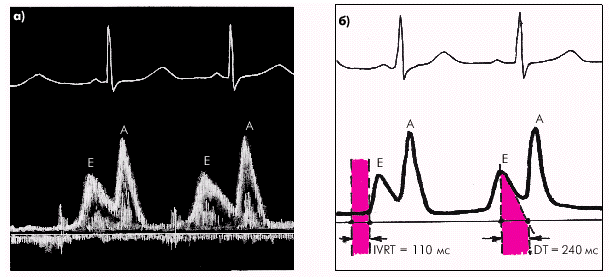
Диастолическая функция желудочков самым тесным образом связана с величиной преднагрузки. Податливый желудочек легко заполняется кровью, что способствует нормальному растяжению мышечных волокон и последующему адекватному сокращению. Наоборот, «жесткий» желудочек не в состоянии принять необходимый объем крови. В этих случаях, для того чтобы достичь нормального растяжения мышечных волокон и обеспечить должную преднагрузку, необходимо более высокое, чем в норме, давление наполнения. В результате повышается КДД в желудочке, что способствует сохранению до поры до времени нормальной величины КДО и сердечного выброса (рис. 1.31). Важным следствием уменьшения податливости желудочка является также компенсаторное увеличение силы сокращения предсердия, которое интенсивно выталкивает в конце диастолы последний объем крови, заполняющий желудочек, увеличивая преднагрузку и, соответственно, сохраняя нормальный УО и сердечный выброс. При мерцательной аритмии, когда отсутствует единое сокращение предсердий, происходит значительное снижение преднагрузки, УО и сердечного выброса. Последний показатель в результате этого может снижаться на 15–25%.
Таким образом, главными показателями диастолической функции желудочков являются: · скорость активного диастолического расслабления желудочка (оценивается по продолжительности фазы изоволюмического расслабления); · структура диастолического наполнения желудочка (оценивается по результатам допплер-эхокардиографического исследования трансмитрального или транстрикуспидального потока крови); · уровень конечно-диастолического давления (КДД) в желудочке и среднего давления в предсердии; · эффективность сокращений предсердий. При нарушении диастолической функции ЛЖ происходит увеличение времени его изоволюмического расслабления, изменение структуры диастолического наполнения и возрастает КДД в ЛЖ и среднее давление в ЛП. При этом показатели систолической функции ЛЖ (МО, СИ, ФВ, УО, УИ и др.) остаются нормальными или малоизмененными. Отсутствует также дилатация желудочка (нормальные значения КДО).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
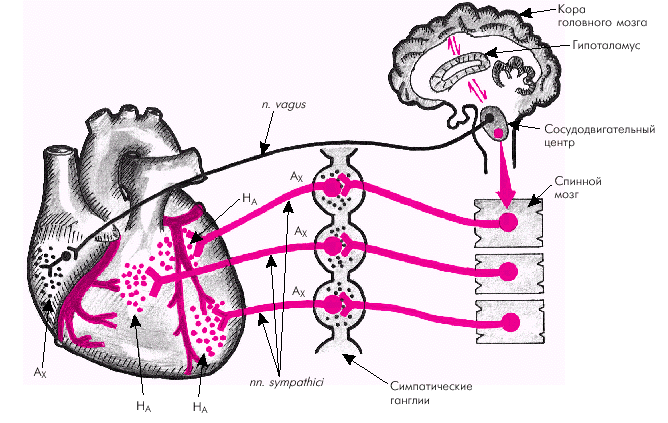
Сердце обладает хорошо развитой многоступенчатой системой регуляции, приспосабливающей его деятельность к постоянно меняющимся условиям функционирования системы кровообращения и потребностям организма. Внутрисердечная регуляция сердца осуществляется в первую очередь за счет деятельности так называемой метасимпатической нервной системы, нейроны которой располагаются в многочисленных интрамуральных ганглиях сердца. В ответ на раздражение рецепторов, расположенных в самом сердце (например, механорецепторов растяжения предсердий и желудочков), метасимпатическая нервная система рефлекторно регулирует силу и скорость сокращения миокарда, скорость его расслабления, ЧСС, скорость атриовентрикулярного проведения и другие параметры сердечной деятельности. Важно, что эти приспособительные реакции осуществляются независимо от функционирования центральных регуляторных механизмов, в том числе от изменений симпатических и парасимпатических влияний на сердце. Большое значение имеют также внутриклеточные механизмы регуляции, обеспечивающие, например, функционирование известного механизма Старлинга (увеличение силы сокращения в ответ на растяжение миофибрилл при увеличении кровенаполнения сердца) или компенсаторное удлинение диастолы в ответ на усиление работы сердца. Внесердечная (центральная) регуляция осуществляется благодаря хорошо развитой двойной (симпатической и парасимпатической) иннервации сердца, схематически представленной на рис. 1.32. Действие этих систем на миокард, проводящую систему сердца и гладкомышечные клетки сосудов реализуется с помощью специфических рецепторов клеток-мишеней: · симпатические влияния осуществляются благодаря взаимодействию катехоламинов с a- и b-адренергическими рецепторами; · парасимпатические — в результате взаимодействия ацетилхолина (АХ) со специфическими мускариновыми М-холинорецепторами (рис. 1.33).
a- и b-адренорецепторы, впервые описанные в 1948 г. R.P. Ahlquist, представляют собой два функционально различных типа рецепторов. Их стимуляция норадреналином (НА), выделяющимся из окончаний симпатических нервов, или адреналином (А), образующимся в надпочечниках и доставляемым к клеткам-мишеням с током крови, «запускает» различные генетически запрограммированные внутриклеточные процессы. Конечный эффект симпатической стимуляции зависит, главным образом, от соотношения в клетках тех или иных органов и тканей a- и b-адренорецепторов. В табл. 1.2 перечислены важнейшие эффекты стимуляции a- и b-адренорецепторов. Таблица 1.2 Важнейшие эффекты стимуляции адренорецепторов
В сердце, как известно, преобладают b1-адренорецепторы, стимуляция которых сопровождается положительным инотропным, хронотропным и дромотропным эффектами. В результате повышается сократимость миокарда, увеличивается ЧСС (положительный хронотропный эффект), сила и скорость сокращения предсердий и желудочков (положительный инотропный эффект), скорость расслабления миокарда, ускоряется проведение электрического импульса в атриовентрикулярном узле (положительный дромотропный эффект), увеличивается возбудимость сердечной мышцы (батмотропный эффект). Стимуляция a1-рецепторов, также присутствующих в миокарде (хотя и в меньшем количестве), сопровождается положительным инотропным эффектом. Кроме того, длительное воздействие медиаторов на a1-адренорецепторы кардиомиоцитов ведет к постепенному развитию гипертрофии сердечной мышцы. На рис. 1.33 показано, что чрезмерно высокая концентрация норадреналина в синапсах стимулирует a2-адренорецепторы, расположенные в пресинаптических окончаниях симпатических нервов, иннервирующих сосуды, что ведет к ингибированию высвобождения норадреналина. Наоборот, воздействие норадреналина на пресинаптические b2-рецепторы активирует высвобождение этого медиатора из нервных окончаний симпатических нервов. Возбуждение парасимпатических нервов (n. vagi) сопровождается высвобождением медиатора ацетилхолина (АX), который взаимодействует с М-холинорецепторами клеток-мишеней, вызывая урежение сердечных сокращений (отрицательный хронотропный эффект), замедление проводимости по атриовентрикулярному узлу вплоть до полной блокады проведения (отрицательный дромотропный эффект), уменьшение силы и скорости сокращения (отрицательный инотропный эффект). Интересно, что ацетилхолин, освобождаемый из нервных окончаний парасимпатических волокон способен стимулировать М-холинорецепторы, расположенные на окончаниях симпатических волокон, что приводит к угнетению освобождения из них норадреналина (см. рис. 1.33).
В табл. 1.3 представлены основные эффекты стимуляции М-холинорецепторов. Таблица 1.3 Важнейшие эффекты стимуляции М-холинорецепторов
|
|
1.2. Сосудистая система |
|
|
|
1.2.1. Морфология сосудистой системы |
|||
|
|
1.2.2. Гемодинамика
|
|||||||||||||||||
|
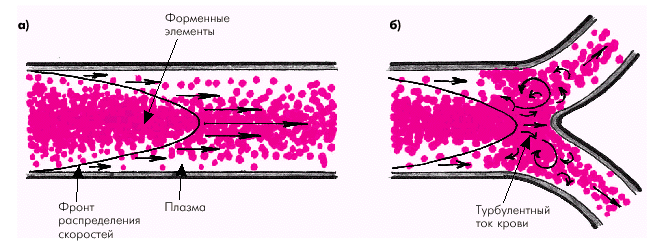
Движение крови по сосудам подчиняется законам гемодинамики. Движущей силой кровотока является градиент давления между артериальной и венозной областями сосудистой системы. У взрослого здорового человека кровоток в сосудах носит, главным образом, ламинарный характер, причем центральный осевой поток крови, состоящий в основном из форменных элементов, имеет максимальную скорость, а периферические слои, непосредственно прилежащие к стенке сосуда и состоящие из плазмы, — минимальную скорость (рис. 1.36, а). Турбулентный ток крови в норме возникает в местах разветвлений и естественных сужений и изгибов аорты и крупных артерий (рис. 1.36, б).
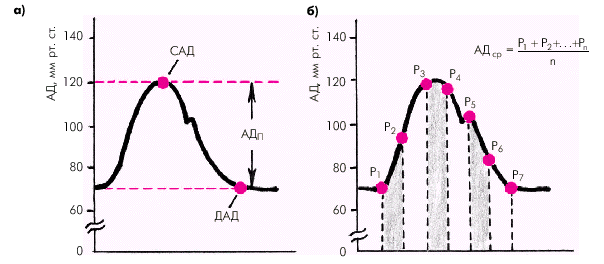
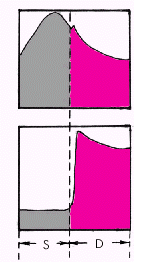
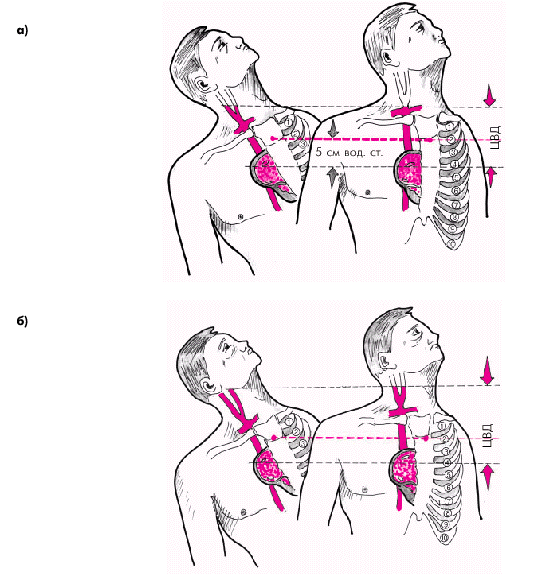
Средняя скорость кровотока в различных сосудистых областях зависит от градиента давлений в начале и в конце сосуда и величины сосудистого сопротивления, которое, в свою очередь, определяется вязкостью крови и поперечным сечением сосуда. Чем больше градиент давлений и/или чем меньше вязкость крови и суммарное поперечное сечение сосудов данной области, тем выше линейная скорость кровотока. В аорте она максимальна (50–70 см/с), в артериях и артериолах, суммарный поперечный просвет и сосудистое сопротивление которых во много раз больше, средняя линейная скорость падает (20–40 см/с в аорте и около 0,5 см/с — в артериолах). Наибольшей суммарной площадью просвета обладают капилляры. Здесь скорость движения крови не превышает 0,05 см/с. Общее время прохождения «частиц» крови по большому и малому кругам кровообращения в норме составляет примерно 23 с. Артериальное давление (АД) является важнейшим интегральным показателем функционирующей системы кровообращения. На протяжении сердечного цикла уровень АД постоянно меняется, повышаясь в начале изгнания и снижаясь во время диастолы. В момент сердечного выброса часть крови, находящейся в проксимальном сегменте восходящей аорты, получает значительное ускорение, тогда как остальная часть крови, обладающая инерцией, ускоряется не сразу. Это приводит к кратковременному повышению давления в аорте, стенки которой несколько растягиваются. По мере того как остальная часть крови ускоряет свое движение под влиянием пульсовой волны, давление в аорте начинает падать, но все же в конце систолы остается более высоким, чем в ее начале. Во время диастолы давление равномерно снижается, но АД не падает до нуля, что связано с эластическими свойствами артерий и достаточно высоким периферическим сопротивлением. Таким образом, уровень АД зависит от нескольких факторов: · величины сердечного выброса; · емкости сосудистой (артериальной) системы; · интенсивности оттока крови; · упругого напряжения стенок артериальных сосудов; · объема циркулирующей крови и т.д. Различают систолическое, диастолическое, пульсовое и среднее АД (рис. 1.37). Систолическое АД (САД) — это максимальное давление в артериальной системе, развиваемое во время систолы левого желудочка. Оно обусловлено в основном ударным объемом сердца и эластичностью аорты и крупных артерий. Диастолическое АД (ДАД) — это минимальное давление в артерии во время диастолы сердца. Оно во многом определяется величиной тонуса периферических артериальных сосудов. Пульсовое АД (АДп) — это разность между систолическим и диастолическим АД.
Среднее АД (АДср) — это результирующая всех переменных значений АД на протяжении сердечного цикла, вычисленная путем интегрирования кривой пульсового колебания давления во времени (рис. 1.37, б):
где Р1, …, Рn — переменные значения давлений на протяжении сердечного цикла, n — число измерений давления на протяжении сердечного цикла. В клинике среднее АД для периферических артерий принято вычислять по формуле:
Среднее АД является важнейшей интегральной гемодинамической характеристикой системы кровообращения. Это та средняя величина давления, которая была бы способна при отсутствии пульсовых колебаний давления дать такой же гемодинамический эффект, какой наблюдается при естественном, колеблющемся движении крови в крупных артериях (И.А. Ефимова). |
|||||||||||||||||
|
|||||||||||||||||
|
Изменения центральной и региональной гемодинамики, постоянно происходящие в организме под действием разнообразных внешних и внутренних факторов, осуществляются за счет изменений минутного объема (сердечный выброс и ЧСС) и сосудистого сопротивления (просвет кровеносных сосудов, преимущественно артериол). Местные (периферические) механизмы Местные механизмы саморегуляции сосудистого тонуса обеспечивают адекватный кровоток в органах в зависимости от уровня метаболизма в них. Периферические механизмы саморегуляции позволяют поддерживать необходимую объемную скорость кровотока в жизненно важных органах (головной мозг, сердце, почки) даже при резком изменении системного АД — его падении или повышении.
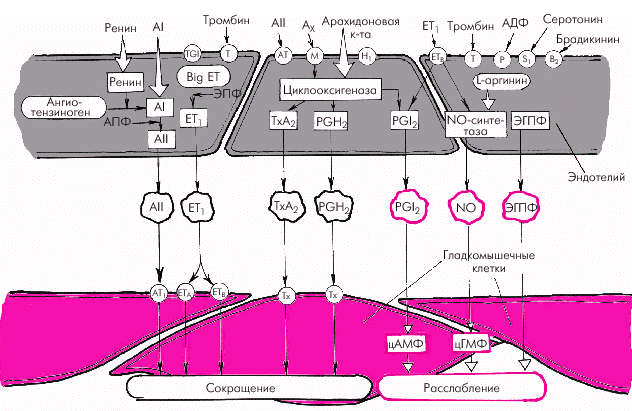
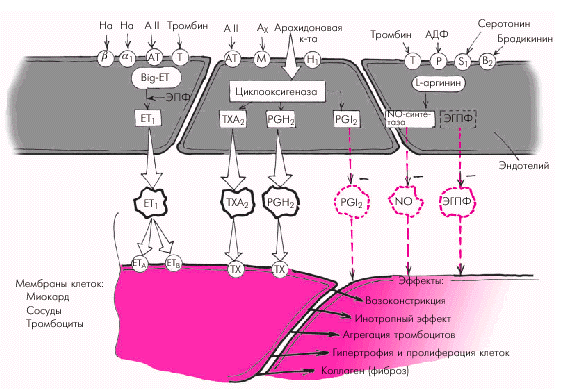
Эндотелиальные факторы Решающее значение в регуляции сосудистого тонуса придается в последние годы так называемым эндотелиальным факторам (рис. 1.38). Было установлено, что сосудистый эндотелий является местом образования целого ряда соединений, участвующих в регуляции сосудистого тонуса, функции тромбоцитов и свертывания крови. В настоящее время выделяют несколько вазодилатирующих и вазоконстрикторных субстанций.
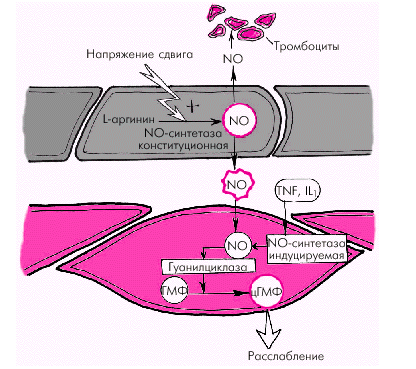
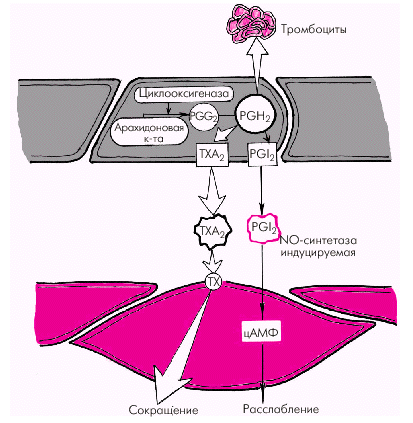
Вазодилатирующие факторы. Основными эндотелийзависимыми вазодилатирующими факторами, оказывающими влияние на сосудистый тонус и агрегацию тромбоцитов, являются эндотелиальный расслабляющий фактор (оксид азота, NO), простациклин PGI2 и эндотелиальный гиперполяризующий фактор (ЭГПФ). 1. Эндотелиальный расслабляющий фактор (оксид азота, NO), обеспечивает выраженную релаксацию гладких мышц артерий, артериол и вен, а также препятствует адгезии и агрегации тромбоцитов. Оксид азота продуцируется сосудистым эндотелием из L-аргинина спонтанно, а также при стимулировании эндотелиальной клетки рядом биологически активных веществ и медиаторов (ацетилхолин, гистамин, брадикинин, субстанция Р и др.), продукция которых возрастает в том числе при физической нагрузке и увеличении работы сердца. Освободившийся из L-аргинина оксид азота (NO) активирует гуанилатциклазу гладкомышечной клетки с образованием цГМФ, что приводит к ее активному расслаблению (рис. 1.39).
2. Простациклин также относится к числу важнейших вазодилататоров, препятствующих вазоконстрикторному эффекту тромбоксана А2 и агрегации тромбоцитов. Простациклин PGI2 является продуктом метаболизма арахидоновой кислоты, освобождающейся стимулированными тромбоцитами, из которой под действием циклооксигеназы синтезируется либо простациклин PGI2, либо тромбоксан А2 (рис. 1.40). 3. Эндотелиальный гиперполяризующий фактор (ЭГПФ), также вырабатываемый эндотелиальными клетками, вызывает гиперполяризацию мембран гладкомышечных клеток (подробнее — см. главу 3) и снижает их чувствительность к разнообразным констрикторным влияниям. Выделение ЭГПФ вызывает открытие калиевых каналов гладкомышечных клеток, что сопровождается расслаблением сосудов. Характерно, что в отличие от оксида азота, ЭГПФ выделяется эндотелием не постоянно, а только под действием некоторых стимулов (ацетилхолин, брадикинин, тромбин, гистамин, субстанция Р, АДФ, АТФ и др.).
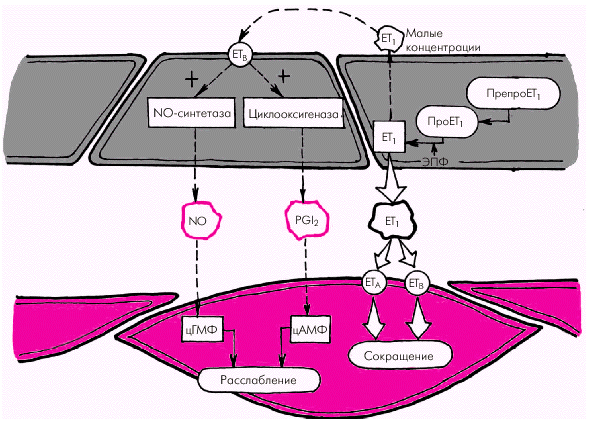
Вазоконстрикторные факторы. К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЕТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др. 1. Эндотелин-1 (ЕТ1) является наиболее мощным из всех известных вазоконстрикторов. Процесс образования ЕТ1 включает несколько стадий (рис. 1.41). Вначале из предшественника эндотелинов (препроэндотелина) образуется так называемый «большой эндотелин» (проэндотелин), который, в свою очередь, под действием эндотелин-превращающего фермента (ЭПФ) трансформируется в активный полипептид, состоящий из 21 аминокислоты, — эндотелин-1 (ЕТ1). Связываясь со специфическими рецепторами клеточных мембран (ЕТА и ЕТВ), эндотелин-1 повышает внутриклеточную концентрацию ионов Са2+, что ведет к усилению сокращения гладких мышц сосудистой стенки. В физиологических условиях концентрация ЕТ1 в плазме очень мала, что связано, прежде всего, с ингибированием синтеза эндотелина-1 описанными выше вазодилатирующими субстанциями (оксидом азота и простациклином РGI2). Малые количества ЕТ1 активируют образование эндотелиальными клетками этих факторов расслабления (рис. 1.41, левая часть). В более высоких концентрациях ЕТ1 стимулирует рецепторы ЕТА и ЕТВ гладкомышечных клеток, вызывая стойкую и выраженную вазоконстрикцию (рис. 1.41, правая часть). Образование ЕТ1 усиливается при воздействии на эндотелиальные клетки тромбина, вазопрессина, интерлейкина-1, ангиотензина II и других веществ, а также при возникновении гипоксии, повышении АД, ускорении кровотока и т.п.
2. Тромбоксан А2 и простагландин РGН2 относятся к числу активных эндотелиальных вазоконстрикторов, обладающих также свойством активировать агрегацию тромбоцитов и тромбообразование. Являясь продуктами метаболизма арахидоновой кислоты, они присутствуют во многих тканях организма, в том числе в сосудистом эндотелии (см. рис. 1.38 и 1.40). 3. Тканевой ангиотензин II (АII) также относится к числу мощных вазоконстрикторов, образующихся в эндотелии различных сосудистых областей (см. рис. 1.38). Он образуется из неактивного ангиотензина I (АI) под действием тканевого ангиотензин-превращающего фермента (АПФ). Этот фермент присутствует в эндотелиальных клетках, что обеспечивает образование АII непосредственно на поверхности эндотелия. Взаимодействуя со специфическими ангиотензиновыми рецепторами (АТ1) гладкомышечных клеток, он также увеличивает внутриклеточную концентрацию Са2+, усиливая сокращение гладких мышц сосудистой стенки. В физиологических условиях существует оптимальное соотношение выработки эндотелиальных вазодилатирующих и вазоконстрикторных субстанций, которое полностью соответствует метаболическим потребностям органа и основным параметрам центральной гемодинамики. При действии на сосудистый эндотелий различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и др.) начинают преобладать вазоконстрикторные механизмы регуляции сосудистого тонуса и развивается так называемая дисфункция эндотелия. Последняя характеризуется повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов, процессов пристеночного тромбообразования и т.п.
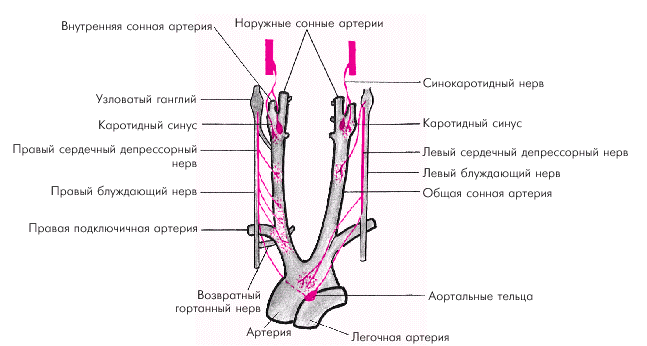
Продукты метаболизма В интенсивно работающем органе под действием продуктов метаболизма (ионов Н+, аденозина, АТФ, АДФ, АМФ, СО2, молочной кислоты и др.) и биологически активных веществ (брадикинина, гистамина и др.) также происходит снижение тонуса артериол и прекапиллярных сфинктеров и увеличивается, таким образом, число функционирующих капилляров. Наоборот, при снижении метаболизма эти эффекты уменьшаются и происходит адекватное ограничение органного кровотока. Одним из таких продуктов метаболизма является аденозин — вещество, играющее важную роль в распаде макроэргических фосфатных соединений. Доказано, что усиление метаболизма органа (например, сердца) закономерно сопровождается ускоренным дефосфорилированием АМФ с образованием аденозина, который, поступая в межклеточное пространство, вызывает значительное расширение артериол и увеличение органного кровотока. Центральные механизмы регуляции Центральные механизмы регуляции сосудистого тонуса включают в себя афферентное (сенсорное), центральное и эфферентное звенья. Афферентное звено представлено многочисленными баро- и хеморецепторами, расположенными в нескольких рефлексогенных зонах сосудистой системы (аорта, синокаротидная зона, сосуды легких и др.) (рис. 1.42). Барорецепторы реагируют на степень и скорость растяжения стенки сосудов (или полостей сердца). При повышении АД или наполнения камер сердца барорецепторы отвечают усилением афферентной импульсации, при снижении АД — ее уменьшением. Хеморецепторы дуги аорты, синокаротидной зоны и других рефлексогенных зон (сердце, почки, органы пищеварения) аналогично реагируют на изменение в крови концентрации О2, СО2, ионов Н+. Чувствительные волокна от баро- и хеморецепторов дуги аорты и каротидного синуса проходят в составе синокаротидного нерва, ветвей языкоглоточного нерва и депрессорного нерва (рис. 1.42). Центральное звено регуляции сосудистого тонуса — вазомоторный центр — представлено различными функционально связанными между собой нервными структурами, расположенными в продолговатом, спинном мозге, гипоталамусе, коре больших полушарий. Эфферентное звено включает нервные и гуморальные механизмы регуляции сосудистого тонуса. В зависимости от скорости развития циркуляторных эффектов различают: 1) механизмы быстрого кратковременного действия; 2) механизмы промежуточного действия; 3) механизмы длительного действия.
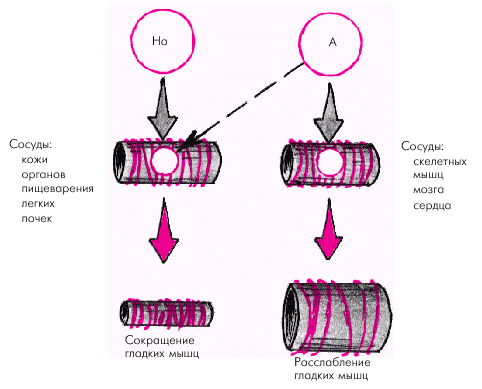
К механизмам быстрого кратковременного действия относятся нервные рефелекторные реакции, возникающие при раздражении баро- и хеморецепторов описанных рефлексогенных зон, а также при ишемии ЦНС. Эти реакции развиваются в течение нескольких секунд и реализуются через рефлекторные изменения активности симпатической и парасимпатической нервных систем, а также через изменение концентрации гуморальных веществ — адреналина и норадреналина. Раздражение барорецепторов аорты и каротидного синуса (например, при повышении АД или механическом воздействии на эти зоны) закономерно приводит к снижению симпатических (вазоконстрикторных) и усилению парасимпатических (депрессорных) влияний. В результате снижается сосудистый тонус, а также частота и сила сокращения сердца, что способствует нормализации АД. Наоборот, при падении АД (например, при кровопотере) импульсация с барорецепторов уменьшается и начинают преобладать симпатические влияния — увеличение ЧСС, сердечного выброса и сосудистого тонуса. Аналогичным образом возникает ответ на раздражение В-рецепторов растяжения предсердий и рецепторов растяжения желудочков, например, при быстром увеличении их наполнения. В результате снижения тонуса симпатических и повышения активности парасимпатических нервов развивается брадикардия и вазодилатация. Возбуждение хеморецепторов дуги аорты и каротидного синуса при снижении напряжения О2, повышении напряжения СО2 или увеличении концентрации ионов Н+ в крови приводит к сужению резистивных сосудов и подъему АД. К такому же эффекту приводит рефлекторная реакция на ишемию ЦНС, например, при недостаточном кровоснабжении головного мозга, гипоксемии или резком падении АД. Повышение концентрации Н+ и СО2 сопровождается раздражением хеморецепторов ствола мозга и значительным подъемом АД. Симпатической нервной системе принадлежит ведущая роль в регуляции тонуса периферических сосудов. Влияние адреналина и норадреналина на тонус различных сосудистых областей зависит от концентрации этих веществ в крови и от соотношения в разных сосудах a- и b-адренорецепторов (рис. 1.43). Как известно, возбуждение a-рецепторов сопровождается сокращением гладких мышц, а возбуждение b-рецепторов — их расслаблением. Норадреналин воздействует преимущественно на a-адренорецепторы, вызывая в экстремальных условиях увеличение сосудистого тонуса, системного периферического сопротивления и АД. Адреналин взаимодействует как с a-, так и с b-адренорецепторами. В физиологических концентрациях он возбуждает преимущественно b-рецепторы, вызывая расслабление гладкой мускулатуры сосудов, особенно тех из них, в которых преобладают b-адренорецепторы (скелетные мышцы, мозг, сердце). Одновременно адреналин повышает УО и ЧСС, в результате чего в обычных физиологических условиях (в покое, при умеренной физической нагрузке, эмоциональном возбуждении) уровень системного АД под действием адреналина существенно не меняется. В этих условиях главный циркуляторный эффект адреналина заключается в перераспределении сердечного выброса и обеспечении интенсивного кровотока в скелетных мышцах, мозге и сердце.
В экстремальных ситуациях (сильный эмоциональный стресс, острое кровотечение и т.п.), когда концентрация адреналина в крови повышается в десятки раз, может проявляться его взаимодействие с a-адренорецепторами сосудов и преобладать сосудосуживающие реакции (особенно в коже, органах пищеварения и легких, в которых имеется большое количество a-рецепторов). Главным регуляторным механизмом промежуточного действия является почечная ренин-ангиотензиновая система (РАС). Ее активация, наступающая при снижении кровоснабжения почек любого генеза (падение АД, сужение почечных сосудов и т.п.), сопровождается выделением ренина, который способствует превращению ангиотензиногена в ангиотензин I (рис. 1.44). Последний под действием АПФ превращается в ангиотензин II, обладающий мощным вазоконстрикторным действием. Кроме того, ангиотензин II возбуждает центральные и периферические симпатические структуры. Все это приводит к росту периферического сопротивления и повышению (нормализации) АД. Следует помнить, что существует альтернативный путь трансформации АI в АII, без участия АПФ (см. ниже).
К регуляторным механизмам длительного действия относят почечные системы контроля за объемом жидкости, системы альдостерона и вазопрессина, механизмы действия которых разбираются в последующих главах. |
|||||||||||||||||
|
|||||||||||||||||
|
В норме у человека величина коронарного кровотока в покое составляет 0,8–0,9 мл/г/мин), или примерно 5–6% от общего МО. Поскольку синтез макроэргических соединений в сердечной мышце может осуществляться почти исключительно в аэробных условиях и восполнение энергии за счет анаэробных процессов затруднено, в физиологических условиях постоянные колебания интенсивности обменных процессов в сердечной мышце и, соответственно, изменяющейся потребности миокарда в кислороде должны удовлетворяться почти исключительно за счет соответствующих изменений величины коронарного кровотока. Например, во время выполнения интенсивной мышечной работы коронарный кровоток должен увеличиться в 4–5 раз по сравнению с состоянием покоя. Это возможно только благодаря существованию сложной многоступенчатой системы нейрогуморальной регуляции коронарного кровотока, любые нарушения в деятельности которой неизбежно ведут к возникновению коронарной недостаточности.
Величина коронарного кровотока регулируется прежде всего уровнем метаболизма сердечной мышцы и, соответственно, потребностью миокарда в кислороде. Последняя, как известно, определяется тремя основными факторами. 1. Величиной внутримиокардиального напряжения, т.е. силой, приходящейся на единицу поверхности поперечного сечения желудочков в момент их сокращения. 2. Частотой сердечных сокращений (ЧСС). 3. Сократимостью сердечной мышцы (уровнем ее инотропизма). Напряжение миокарда. Согласно уравнению Лапласа, напряжение миокарда (F) прямо пропорционально внутрижелудочковому давлению (Р) и радиусу полости желудочка (r) и обратно пропорционально толщине его стенок (h):
Максимальное напряжение стенки желудочка возникает в период систолы, когда давление в желудочке резко возрастает и достигает уровня давления в аорте. Следовательно, наибольшее напряжение, развиваемое стенкой желудочка, в первую очередь, определяется величиной систолического АД (САД). Исключение составляют случаи обструкции выносящего тракта ЛЖ (стеноз устья аорты, ГКМП и др.), когда внутрижелудочковое давление становится существенно выше давления в аорте и последнее не может полностью охарактеризовать величину напряжения миокарда желудочка.
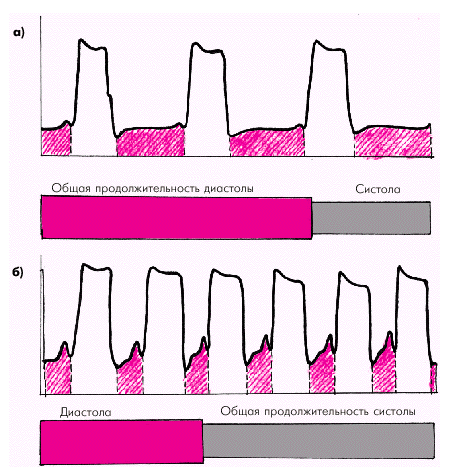
Во время диастолы напряжение стенки желудочка определяется преимущественно уровнем преднагрузки и зависит от величины КДД и КДО. Чем больше диастолические размеры полости ЛЖ (дилатация, аневризма) или выше КДД, тем больше напряжение стенки желудочка и выше потребность миокарда в кислороде. Следует отметить, что напряжение, развиваемое стенкой ПЖ, оказывается значительно меньшим, чем ЛЖ, что связано главным образом с меньшей величиной давления в ЛА и меньшими размерами ПЖ. Частота сердечных сокращений (ЧСС) является важным независимым фактором, влияющим на потребление миокардом кислорода. Увеличение ЧСС сопровождается по понятным причинам изменением временных соотношений между систолой и диастолой (рис. 1.45). При этом существенно увеличивается «чистое» рабочее время желудочков, т.е. общая продолжительность всех систол за единицу времени. В связи с этим потребление миокардом кислорода возрастает примерно пропорционально корню квадратному из ЧСС. Следует заметить, что в клинике для количественной характеристики потребления миокардом кислорода давно используется показатель так называемого «двойного произведения» (ДП), который рассчитывается следующим образом:
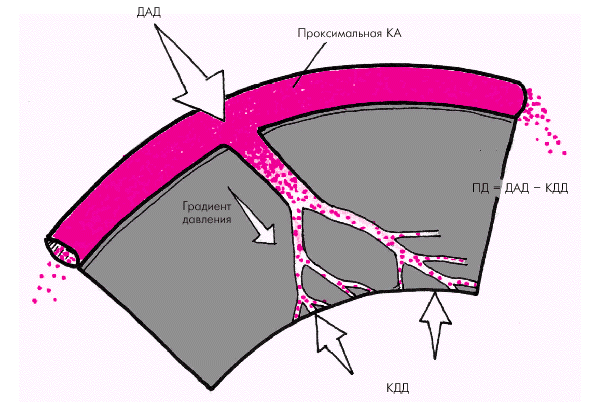
где САД — систолическое АД. Чем выше показатель «двойного произведения» в покое или при нагрузке, тем большее напряжение развивает сердечная мышца и тем более высокой оказывается потребность миокарда в кислороде. Она становится еще более высокой, если в результате патологических процессов оказываются увеличенными размеры ЛЖ (дилатация, аневризма). Сократимость. Уровень инотропизма сердечной мышцы (см. выше) оказывает существенное влияние на потребность миокарда в кислороде. Правда, имеется сложность прямой количественной оценки сократимости миокарда у человека. Факторы, влияющие на величину коронарного кровотока Величина коронарного кровотока зависит от двух основных факторов: 1. Перфузионного давления, т.е. давления, которое обеспечивает движение крови по коронарным сосудам. 2. Общего сопротивления коронарных сосудов. Перфузионное давление определяется разностью давлений на входе и выходе системы венечных сосудов (рис. 1.46). Входным давлением для коронарного кровообращения является диастолическое давление крови в аорте, поскольку во время систолы происходит сжатие сосудов окружающим миокардом, и его перфузия осуществляется в основном во время диастолы (см. ниже). Чем выше диастолическое АД, тем (при прочих равных условиях) больше перфузионное давление и выше коронарный кровоток. Выходным давлением для коронарного кровотока является величина внутримиокардиального напряжения, определяющего степень сжатия сети микроциркуляции. При известных допущениях внутримиокардиальное напряжение, которое развивает желудочек во время диастолы, может быть приравнено к внутрижелудочковому давлению, в частности, к конечно-диастолическому давлению в желудочке (КДД). Из сказанного следует, что чем выше уровень ДАД и ниже внутрижелудочковое давление (например, КДД), тем больше перфузионное давление во время диастолы и выше поток крови в коронарных сосудах.
В патологических условиях при снижении ДАД ниже 60–70 мм рт. ст. (недостаточность клапана аорты, коллапс и др.) перфузионное давление падает, и коронарный кровоток может существенно уменьшиться. С другой стороны, любое повышение КДД и/или КДО ЛЖ, вызванное увеличением преднагрузки, дилатацией полости желудочка или развитием выраженной гипертрофии миокарда ЛЖ, закономерно сопровождается снижением перфузионного давления и ухудшением коронарного кровотока. Такой же эффект наблюдается при увеличении сократимости миокарда, а также при увеличении ЧСС. Влияние высокого интрамиокардиального (или внутрижелудочкового) давления на величину коронарного кровотока хорошо иллюстрируется почти полным прекращением перфузии миокарда во время систолы желудочков (рис. 1.47). При этом силы, сжимающие субэндокардиальные сосуды, по понятным причинам существенно выше сил, которые сдавливают субэпикардиальную микроциркуляторную сеть. Поэтому в отличие от субэндокардиального кровотока ЛЖ перфузия субэпикардиальных отделов миокарда ЛЖ во время систолы полностью не прекращается. Это означает, что при различных патологических состояниях, ограничивающих коронарный кровоток, наиболее уязвимой для возникновения ишемии всегда оказывается субэндокардиальная микроциркуляторная сеть ЛЖ.
Поскольку внутримиокардиальное напряжение стенки ПЖ существенно ниже, чем левого, кровоток в бассейне ПКА меньше подвержен влиянию этого напряжения во время систолы ПЖ и изменяется, главным образом, в соответствии с перепадами давления в аорте. Следует подчеркнуть, что в физиологических условиях, независимо от возможных колебаний уровня давления в аорте, изменяющихся величин преднагрузки или других гемодинамических параметров, уровень перфузионного давления и величина коронарного кровотока всегда соответствуют потребности миокарда в кислороде, что обеспечивается нормальным функционированием системы нейрогуморальной регуляции тонуса коронарных артерий (см. ниже). Сопротивление коронарных сосудов. Различают несколько функциональных компонентов, из которых складывается общее сопротивление коронарных сосудов (рис. 1.48). В норме крупные эпикардиальные КА (R1) вносят относительно малый вклад в общее сопротивление коронарной системы. Определенное значение, по-видимому, имеет «шероховатость» стенок крупных КА, особенности их анатомического строения. Повышение гематокрита (Ht) и/или вязкости крови в целом увеличивает общее сопротивление коронарных сосудов, а их уменьшение способствует снижению сопротивления. Иная ситуация складывается в условиях патологии, например, при формировании атеросклеротических бляшек или внутрисосудистых тромбов, сужающих просвет крупной КА. В этих случаях резко повышается сопротивление коронарной системы, что существенно ограничивает коронарный кровоток.
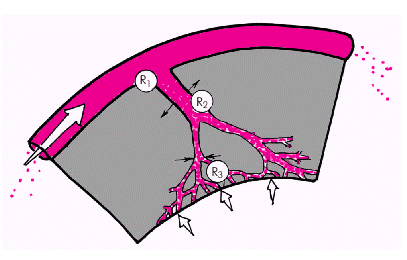
Наибольшее влияние на величину коронарного кровотока оказывает динамическое сопротивление резистивных КА (артериол) (R2). Именно на уровне артериол происходит ауторегуляторное изменение тонуса КА (их расширение или сужение), что в физиологических условиях обеспечивает адекватность коронарного кровотока постоянно меняющимся потребностям миокарда в кислороде. Наконец, третьим важнейшим компонентом общего сопротивления коронарного русла является величина внутримиокардиального напряжения (или внутрижелудочкового давления) (R3), увеличение которого, как было показано выше, ведет к сдавлению микроциркуляторного русла, росту общего сопротивления коронарной системы и ограничению кровотока. Механизмы регуляции коронарного кровотока К числу основных механизмов регуляции тонуса КА относятся: 1. Местные механизмы саморегуляции, включая эндотелиальные и метаболические факторы. 2. Нервные механизмы регуляции. Местная регуляция коронарного кровотока. В нормальных условиях основное (но не единственное) влияние на сопротивление коронарных сосудов оказывает уровень метаболизма миокарда. Любое усиление обменных процессов, обусловленное увеличением пост- или преднагрузки, ЧСС, сократимости миокарда или уменьшением перфузионного давления (см. выше), сопровождается высвобождением из клеток миокарда и сосудистого эндотелия ряда веществ, обладающих мощным вазодилатирующим действием. Расширение резистивных КА (артериол) приводит к снижению сопротивления коронарного русла и увеличению коронарного кровообращения. Выше были описаны основные вазодилатирующие субстанции, участвующие в регуляции местного кровотока: · эндотелиальный расслабляющий фактор (оксид азота, NO); · простациклин PGI2; · эндотелиальный гиперполяризующий фактор (ЭГПФ); · аденозин; · брадикинин и др. Помимо описанных факторов, вызывающих расширение венечных сосудов при увеличении работы сердца и повышении потребности миокарда в кислороде, в метаболической регуляции коронарного кровотока, по-видимому, определенную роль играет непосредственное снижение рО2, повышение рСО2, ионов К+ и уменьшение рН, хотя значение этих факторов регуляции коронарного кровотока полностью не изучено. В норме, как известно, существует сбалансированность выработки вазодилатирующих и вазоконстрикторных субстанций, которая обеспечивает полное соответствие коронарного кровотока метаболическим потребностям сердечной мышцы. Возникающая под действием различных повреждающих факторов дисфункция эндотелия является основной причиной нарушений регуляции коронарного кровотока, повышения тонуса КА, ускорения агрегации тромбоцитов и процессов пристеночного тромбообразования. Нервная регуляция коронарного кровотока. Поскольку гладкомышечные клетки коронарных сосудов обладают как a- и b-адренергическими, так и М-холинергическими рецепторами, нервная регуляция коронарного кровотока осуществляется обоими отделами вегетативной нервной системы. В целом стимуляция a-адренорецепторов вызывает сужение КА, а b2–адренорецепторов и М-холинорецепторов — их расширение (см. табл. 1.2 и 1.3). Однако оценивая конечные эффекты активации симпатической и парасимпатической нервных систем, следует учитывать не только прямое влияние такой активации на гладкомышечные клетки венечных сосудов, но и опосредованное их действие на уровень обменных процессов в миокарде, ЧСС, сократимость сердечной мышцы и т.д. Например, в физиологических условиях стимуляция симпатических эфферентных волокон вызывает опосредованное a-адренорецепторами прямое сосудосуживающее действие, которое сменяется затем стабильной и выраженной метаболической дилатацией КА. Последняя обусловлена стимуляцией a1- и b1-адренорецепторов рабочего миокарда и, соответственно, увеличением обменных процессов и потребности сердца в кислороде, вызывающем метаболическое расслабление гладкомышечных клеток коронарных сосудов под действием аденозина, оксида азота, простациклина и других факторов. Естественно, в патологических условиях вазодилатационный эффект активации САС по разным причинам может быть существенно ослаблен. Кроме того, стимуляция a1-адренорецепторов может вызвать выраженный спазм крупных КА. Стимуляция парасимпатических эфферентных волокон вызывает прямое сосудорасширяющее действие, опосредованное М-холинергическими рецепторами гладкомышечных клеток коронарных сосудов. Кроме того, медиатор парасимпатической нервной системы ацетилхолин, воздействуя на пресинаптические М-рецепторы, расположенные в окончаниях симпатических нервов, ингибирует освобождение норадреналина из симпатических нервных окончаний, ограничивая тем самым эффекты симпатической активации. Следует также учитывать, что активация парасимпатической нервной системы сопровождается снижением инотропизма сердечной мышцы, уменьшением ЧСС, что способствует восстановлению баланса между потребностью миокарда в кислороде и реальной величиной коронарного кровотока. Таким образом, каждое звено регуляции коронарного кровотока должно рассматриваться как сложный каскад взаимосвязанных эффектов, направленных не только на прямое изменение тонуса КА, но и воздействующих на другие факторы, определяющие соотношение коронарного кровотока и потребности миокарда в кислороде. |
|||||||||||||||||
|
|
||||||||||||||||
|
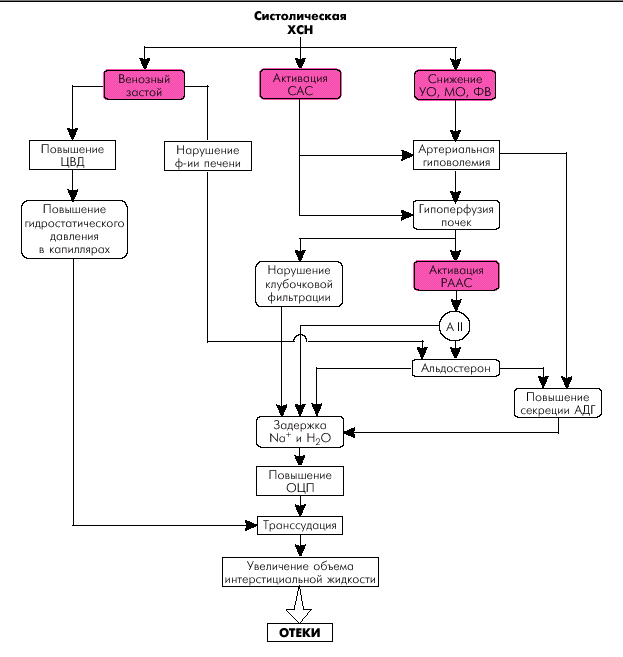
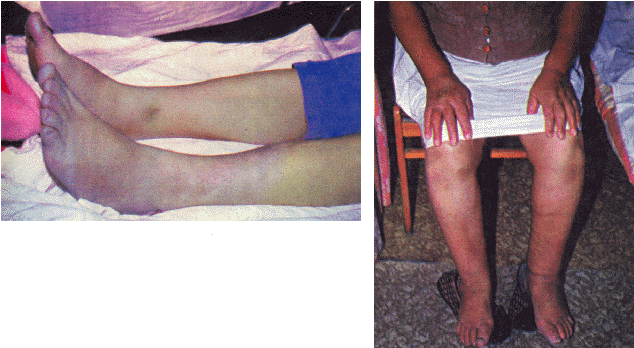
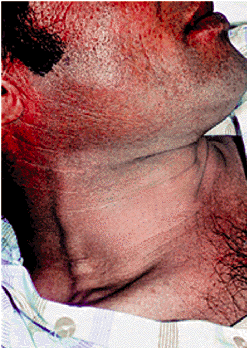
Сердечная недостаточность (СН) — это состояние, при котором: 1. Сердце не может полностью обеспечить должный минутный объем крови (МО), т.е. перфузию органов и тканей, адекватную их метаболическим потребностям в покое или при физической нагрузке. 2. Или относительно нормальный уровень МО и перфузии тканей достигается за счет чрезмерного напряжения внутрисердечных и нейроэндокринных компенсаторных механизмов, прежде всего за счет увеличения давления наполнения полостей сердца и активации САС, ренин-ангиотензиновой и других систем организма. В большинстве случаев речь идет о сочетании обоих признаков СН — абсолютного или относительного снижения МО и выраженного напряжения компенсаторных механизмов. СН выявляется у 1–2% населения, причем ее распространенность увеличивается с возрастом. У лиц старше 75 лет СН встречается в 10% случаев. Почти все заболевания сердечно-сосудистой системы могут осложняться СН, являющейся наиболее частой причиной госпитализации, снижения трудоспособности и смерти больных. |
|
||||||||||||||||
|
|
||||||||||||||||
|
В зависимости от преобладания тех или иных механизмов формирования СН выделяют следующие причины развития этого патологического синдрома. I. Поражения сердечной мышцы (миокардиальная недостаточность). 1. Первичные:
2. Вторичные:
II. Гемодинамическая перегрузка желудочков сердца. 1. Повышение сопротивления изгнанию (увеличение постнагрузки):
2. Увеличение наполнения камер сердца (увеличение преднагрузки):
III. Нарушение наполнения желудочков сердца. 1. Стеноз левого или правого атриовентрикулярного отверстия. 2. Экссудативный и констриктивный перикардит. 3. Перикардиальный выпот (тампонада сердца). 4. Заболевания с повышенной жесткостью миокарда и диастолической дисфункцией:
IV. Повышение метаболических потребностей тканей (СН с высоким МО). 1. Гипоксические состояния:
2. Повышение обмена веществ:
3. Беременность.
|
|
||||||||||||||||
|
2.2. Патогенез |
|
||||||||||||||||
|
|
|
||||||||||||||||
|
2.2.1. Механизмы систолической и диастолической дисфункции желудочков
|
|||||||
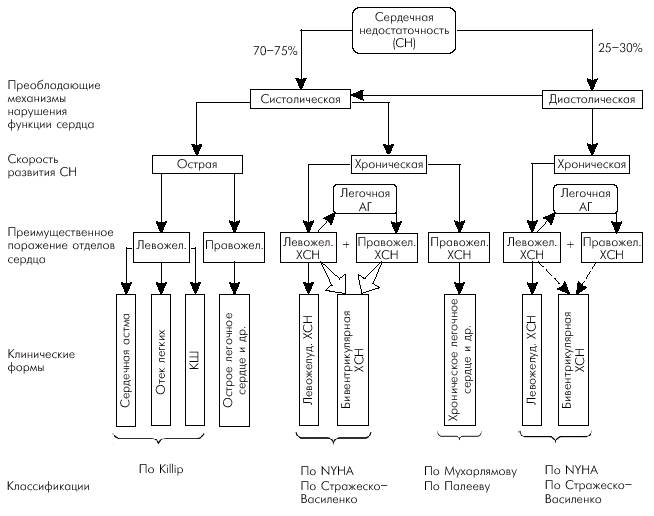
|
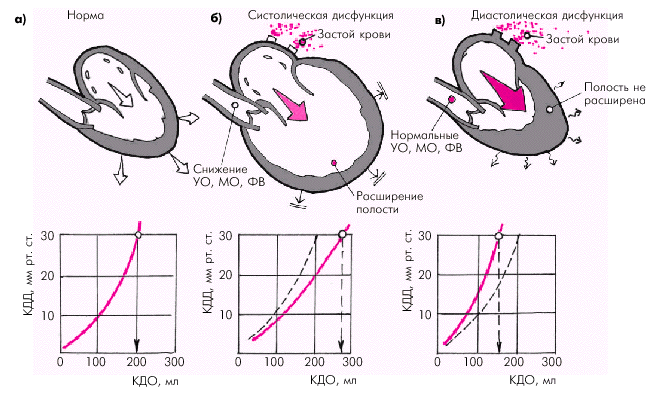
Многообразие причин сердечной недостаточности объясняет существование различных клинических и патофизиологических форм этого патологического синдрома, при каждой из которых преобладает преимущественное поражение тех или иных отделов сердца и действие различных механизмов компенсации и декомпенсации. В большинстве случаев (около 70–75%) речь идет о преимущественном нарушении систолической функции сердца, которая определяется степенью укорочения сердечной мышцы и величиной сердечного выброса (МО). Напомним, что УО и МО определяются тремя гемодинамическими факторами. 1. Исходной длиной мышечного волокна, или конечно-диастолическим объемом (КДО) желудочка, т.е. величиной преднагрузки, которая, в свою очередь, зависит от объема циркулирующей крови (ОЦК), притока крови к сердцу, эффективности сокращения предсердий и других факторов. 2. Инотропным состоянием (сократимостью) миокарда желудочков, которое зависит от активности САС, частоты сердечных сокращений (ЧСС), массы функционирующего миокарда, состояния обменных процессов в кардиомиоцитах, величины коронарной перфузии и т.д. 3. Внутримиокардиальным напряжением, которое должна развивать сердечная мышца во время своего сокращения, чтобы преодолеть сопротивление изгнанию крови, т.е. величиной постнагрузки. Напряжение миокарда, в свою очередь, зависит от уровня давления в аорте или легочной артерии, массы функционирующего миокарда, от размеров полости желудочка и т.п. На конечных этапах развития систолической дисфункции наиболее характерную последовательность гемодинамических изменений можно представить следующим образом (рис. 2.1, б):
Последний гемодинамический признак СН сопровождается наиболее “яркими” и четко очерченными клиническими проявлениями СН (одышка, отеки, гепатомегалия и т.п.) и определяет клиническую картину двух ее форм. При левожелудочковой СН развивается застой крови в малом круге кровообращения, а при правожелудочковой СН — в венозном русле большого круга. Быстрое развитие систолической дисфункции желудочка приводит к возникновению острой СН (лево- или правожелудочковой). Такая ситуация возникает, например, при остром повреждении сердечной мышцы (ИМ, миокардит и др.) или внезапном возрастании величины преднагрузки (разрыв межжелудочковой перегородки или папиллярной мышцы при ИМ, введение в сосудистое русло больших количеств жидкости) или постнагрузки (резкий подъем АД при гипертоническом кризе или тромбоэмболия легочной артерии, сопровождающаяся возрастанием давления в ЛА).
Длительное существование гемодинамической перегрузки объемом или сопротивлением (ревматические пороки сердца) или постепенное прогрессирующее снижение сократимости миокарда желудочка (например, при его ремоделировании после перенесенного ИМ или длительном существовании хронической ишемии сердечной мышцы) сопровождается формированием хронической СН (ХСН).
Примерно в 25–30% случаев в основе развития СН лежат нарушения диастолической функции желудочков. Диастолическая дисфункция развивается при заболеваниях сердца, сопровождающихся нарушением расслабления и наполнения желудочков. Наиболее типичными примерами заболеваний, при которых диастолическая дисфункция проявляется как бы в “чистом” виде, являются аортальный стеноз, ГКМП, экссудативный и констриктивный перикардит, рестриктивные заболевания сердца и др. Кроме того, диастолическая дисфункция желудочков нередко сочетается с систолической дисфункцией, например, при ИБС или АГ. В этих случаях ухудшение диастолического наполнения обусловлено как увеличением ригидности сердечной мышцы (длительная ишемия миокарда, фиброз, гипертрофия), так и нарушением процессов активного расслабления (снижение энергетического обеспечения, повышение концентрации внутриклеточного Са2+ и т.п.). Нарушение растяжимости миокарда желудочков приводит к тому, что для обеспечения достаточного диастолического наполнения желудочка кровью и сохранения нормального УО и МО необходимо значительно более высокое давление наполнения, соответствующее более высокому КДД желудочка (см. рис. 1.31). Как видно на рис. 2.1, в, кривая зависимости КДО и КДД при диастолической дисфункции ЛЖ смещается влево и вверх. Поэтому даже небольшой прирост КДО обеспечивается за счет чрезмерно высокого КДД или давления наполнения. Кроме того, замедление релаксации желудочка приводит к перераспределению диастолического наполнения в пользу предсердного компонента, и значительная часть диастолического кровотока осуществляется не во время фазы быстрого наполнения желудочка, как в норме, а во время активной систолы предсердия. Эти изменения способствуют увеличению давления и размеров предсердия, повышая риск возникновения застоя крови в венозном русле малого или большого круга кровообращения. Иными словами, диастолическая дисфункция желудочков может сопровождаться клиническими признаками ХСН при нормальной сократимости миокарда и сохраненном сердечном выбросе. При этом полость желудочка обычно остается нерасширенной, поскольку нарушается соотношение КДД и КДО желудочка (рис. 2.1, в).
Следует обратить внимание на то, что во многих случаях ХСН имеет место сочетание систолической и диастолической дисфункции желудочков, что необходимо учитывать при выборе соответствующей медикаментозной терапии. Из приведенного выше определения СН следует, что этот патологический синдром может развиться не только в результате уменьшения насосной (систолической) функции сердца или его диастолической дисфункции, но и при значительном увеличении метаболических потребностей органов и тканей (гипертиреоз, беременность и т.п.) или при снижении кислородной транспортной функции крови (анемии). В этих случаях МО может оказаться даже повышенным (СН с “высоким МО”), что связано обычно с компенсаторным увеличением ОЦК. По современным представлениям формирование систолической или диастолической СН тесным образом связано с активацией многочисленных кардиальных и экстракардиальных (нейрогормональных) компенсаторных механизмов. При систолической дисфункции желудочков такая активация вначале носит адаптационный характер и направлена преимущественно на поддержание на должном уровне МО и системного АД. При диастолической дисфункции конечным результатом включения компенсаторных механизмов является повышение давления наполнения желудочков, что обеспечивает достаточный диастолический приток крови к сердцу. Однако в последующем практически все компенсаторные механизмы трансформируются в патогенетические факторы, способствующие еще большему нарушению систолической и диастолической функции сердца и формированию значительных изменений гемодинамики, характерных для СН. |
|||||||
|
|||||||
|
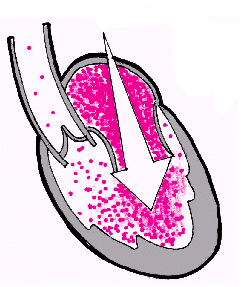
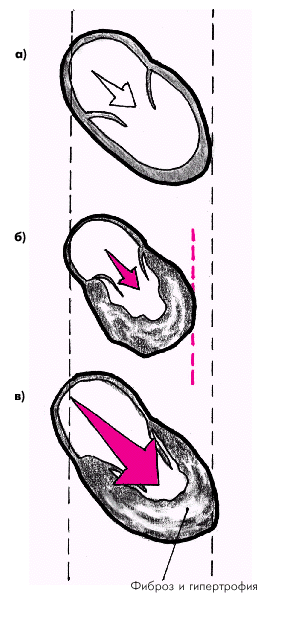
К числу важнейших кардиальных адаптационных механизмов относятся гипертрофия миокарда и механизм Старлинга. Различают концентрическую и эксцентрическую гипертрофию миокарда желудочков. Длительное хроническое увеличение постнагрузки на какой-либо отдел сердца ведет, как известно, к развитию концентрической гипертрофии миокарда — утолщению мышечной стенки без расширения полости желудочка (рис. 2.2, б). Такая ситуация характерна для артериальной гипертензии, стеноза устья аорты или легочной артерии, для легочной артериальной гипертензии, развивающейся при митральном стенозе, легочном сердце и других заболеваниях. На начальных стадиях этих заболеваний гипертрофия миокарда способствует уменьшению внутримиокардиального напряжения за счет увеличения толщины стенки, позволяя желудочку развивать достаточное внутрижелудочковое давление в систолу. При другом типе хронической гемодинамической перегрузки сердца — увеличении преднагрузки — развивается эксцентрическая гипертрофия, т.е. тоногенная дилатация полости желудочка, сопровождающаяся умеренной гипертрофией миокарда (рис. 2.2, в). Наиболее часто причинами эксцентрической гипертрофии являются:
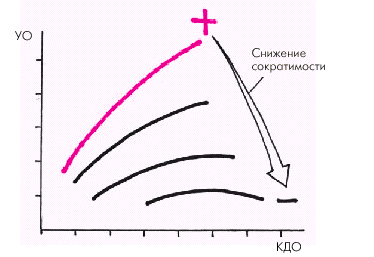
Умеренная дилатация камер сердца вначале также носит компенсаторный характер, поскольку растяжение кардиомиоцитов, согласно механизму Старлинга, ведет к увеличению силы последующего сокращения и величины выполненной работы (рис. 2.3). Наконец, при повреждении самой сердечной мышцы (например, при хронической ишемии миокарда) или снижении массы функционирующего миокарда (острый ИМ, постинфарктный кардиосклероз) также развивается гипертрофия сердечной мышцы и так называемая “тоногенная” дилатация ЛЖ, что в течение определенного времени способствует сохранению достаточной величины сердечного выброса. Рано или поздно компенсаторная реакция сердца на гемодинамическую перегрузку или повреждение миокарда желудочков оказывается недостаточной и происходит снижение сердечного выброса. Так, при гипертрофии сердечной мышцы со временем происходит “изнашивание” сократительного миокарда: истощаются процессы белкового синтеза и энергетического обеспечения кардиомиоцитов, нарушается соотношение между сократительными элементами и капиллярной сетью, повышается концентрация внутриклеточного Са2+ , развивается фиброз сердечной мышцы и т.п. Одновременно происходит снижение диастолической податливости камер сердца и развивается диастолическая дисфункция гипертрофированного миокарда. Кроме того, наблюдаются выраженные нарушения метаболизма миокарда: уменьшается АТФ-азная активность миозина, обеспечивающего сократимость миофибрилл за счет гидролиза АТФ; нарушается сопряжение возбуждения с сокращением; нарушается образование энергии в процессе окислительного фосфорилирования и истощаются запасы АТФ и КФ.
В результате уменьшается сократимость миокарда, величина МО, возрастает КДД желудочка и появляется застой крови в венозном русле малого или большого круга кровообращения. Важно помнить, что эффективность механизма Старлинга, обеспечивающего сохранение МО за счет умеренной (“тоногенной”) дилатации желудочка, резко снижается при повышении КДД в ЛЖ больше 18–20 мм рт. ст. Чрезмерное растяжение стенок желудочка (“миогенная” дилатация) сопровождается лишь незначительным увеличением или даже уменьшением силы сокращения, что способствует снижению сердечного выброса. При диастолической форме СН реализация механизма Старлинга вообще затруднена вследствие ригидности и неподатливости стенки желудочка. Как было показано выше, для достижения должного КДО в этих случаях необходимо очень высокое давление наполнения, КДД желудочка. В результате на самых ранних стадиях диастолической ХСН может развиваться застой крови в малом круге кровообращения. |
|||||||
|
|||||||
|
По современным представлениям, основную роль как в процессах адаптации сердца к гемодинамическим перегрузкам или первичному повреждению сердечной мышцы, так и в формировании характерных для СН изменений гемодинамики играет активация нескольких нейроэндокринных систем, важнейшими из которых являются:
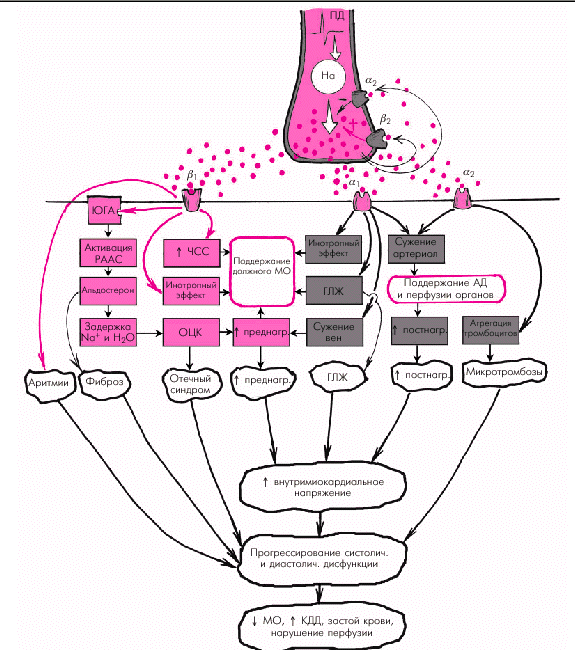
Гиперактивация симпатико-адреналовой системы Гиперактивация симпатико-адреналовой системы и повышение концентрации катехоламинов (А и На) является одним из наиболее ранних компенсаторных факторов при возникновении систолической или диастолической дисфункции сердца. Особенно важной оказывается активация САС в случаях развития острой СН. Эффекты такой активации реализуются прежде всего через a- и b-адренергические рецепторы клеточных мембран различных органов и тканей. Основными следствиями активации САС являются (рис. 2.4):
Таким образом, на начальных этапах развития заболевания повышение активности САС способствует увеличению сократимости миокарда, притока крови к сердцу, величины преднагрузки и давления наполнения желудочков, что в конечном итоге приводит к сохранению в течение определенного времени достаточного сердечного выброса. Однако длительная гиперактивация САС у больных хронической СН может иметь многочисленные негативные последствия, способствуя: 1. Значительному увеличению преднагрузки и постнагрузки (за счет чрезмерной вазоконстрикции, активации РААС и задержки натрия и воды в организме). 2. Повышению потребности миокарда в кислороде (в результате положительного инотропного эффекта активации САС). 3. Уменьшению плотности b-адренергических рецепторов на кардиомиоцитах, что со временем приводит к ослаблению инотропного эффекта катехоламинов (высокая концентрация катехоламинов в крови уже не сопровождается адекватным увеличением сократимости миокарда). 4. Прямому кардиотоксическому эффекту катехоламинов (некоронарогенные некрозы, дистрофические изменения миокарда). 5. Развитию фатальных желудочковых нарушений ритма (желудочковой тахикардии и фибрилляции желудочков) и т.д.
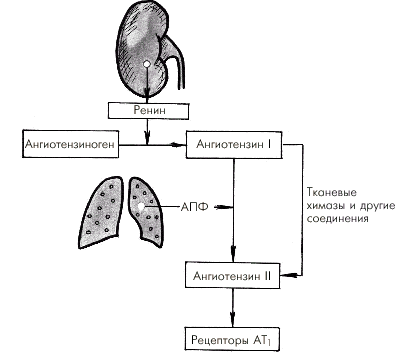
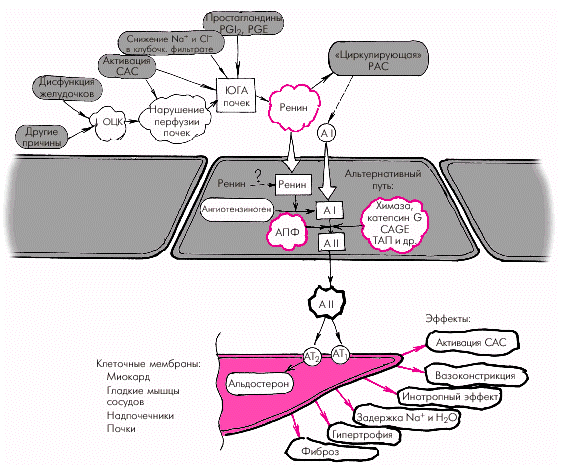
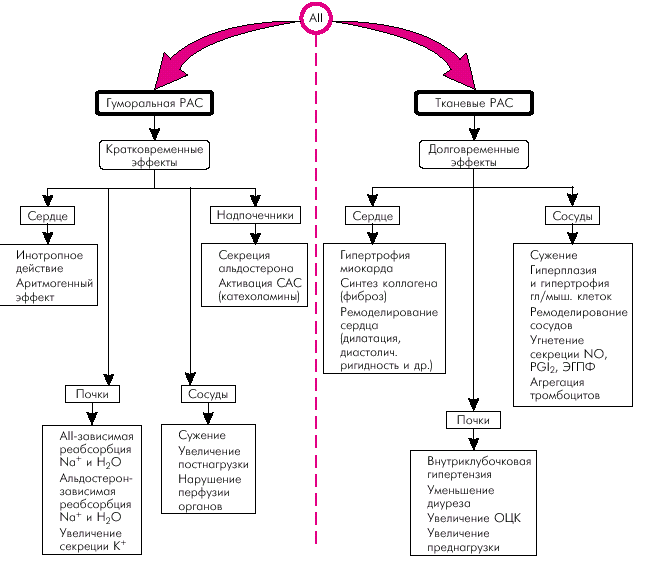
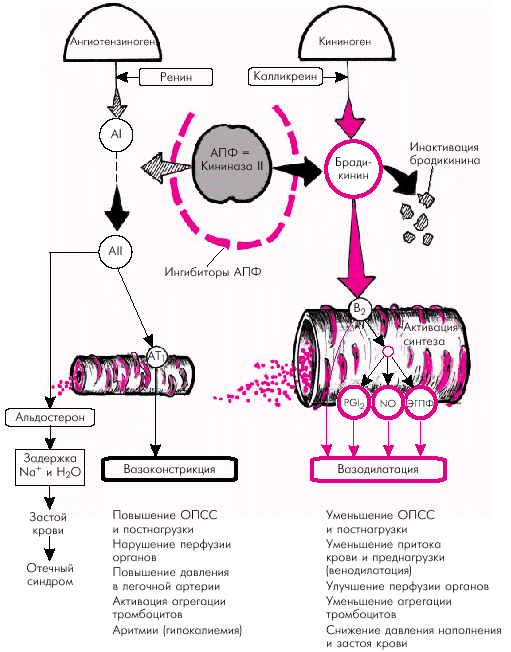
Гиперактивация ренин-ангиотензин-альдостероновой системы Гиперактивация РААС играет особую роль в формировании СН. При этом имеет значение не только почечно-надпочечниковая РААС с циркулирующими в крови нейрогормонами (ренином, ангиотензином-II, ангиотензином-III и альдостероном), но и локальные тканевые (в том числе миокардиальная) ренин-ангиотензиновые системы. На рис. 2.5. показана упрощенная схема РААС. Активация почечной ренин-ангиотензиновой системы, наступающая при любом самом незначительном снижении перфузионного давления в почках, сопровождается выделением клетками ЮГА почек ренина, расщепляющего ангиотензиноген с образованием пептида — ангиотензина I (АI). Последний под действием ангиотензин-превращающего фермента (АПФ) трансформируется в ангиотензин II, который является основным и наиболее мощным эффектором РААС. Характерно, что ключевой фермент этой реакции — АПФ — локализуется на мембранах эндотелиальных клеток сосудов легких, проксимальных канальцев почек, в миокарде, плазме, где и происходит образование АII. Его действие опосредуется специфическими ангиотензиновыми рецепторами (АТ1 и АТ2), которые находятся в почках, сердце, артериях, надпочечниках и т.д. Важно, что при активации тканевых РАС имеются и другие пути (помимо АПФ) превращения АI в АII: под действием химазы, химазоподобного фермента (CAGE), катепсина G, тканевого активатора плазминогена (ТАП) и др.
Наконец, воздействие АII на АТ2-рецепторы клубочковой зоны коркового вещества надпочечников приводит к образованию альдостерона, основным эффектом которого является задержка в организме натрия и воды, что способствует увеличению ОЦК. В целом активация РААС сопровождается следующими эффектами:
Активация РААС при острой СН и на начальных этапах развития хронической СН имеет компенсаторное значение и направлена на поддержание нормального уровня АД, ОЦК, перфузионного давления в почках, увеличение пред- и постнагрузки, увеличение сократимости миокарда. Однако в результате длительной гиперактивации РААС развивается ряд отрицательных эффектов: 1. увеличение ОПСС и снижение перфузии органов и тканей; 2. чрезмерное увеличение постнагрузки на сердце; 3. значительная задержка жидкости в организме, что способствует формированию отечного синдрома и повышению преднагрузки; 4. инициация процессов ремоделирования сердца и сосудов, в том числе гипертрофии миокарда и гиперплазии гладкомышечных клеток; 5. стимуляция синтеза коллагена и развитие фиброза сердечной мышцы; 6. развитие некроза кардиомиоцитов и прогрессирующее повреждение миокарда с формированием миогенной дилатации желудочков; 7. повышение чувствительности сердечной мышцы к катехоламинам, что сопровождается возрастанием риска возникновения фатальных желудочковых аритмий у больных СН. Система аргинин-вазопрессин (антидиуретический гормон) Антидиуретический гормон (АДГ), секретируемый задней долей гипофиза, участвует в регуляции проницаемости для воды дистальных отделов канальцев почек и собирательных трубок. Например, при недостатке в организме воды и дегидратации тканей происходит уменьшение объема циркулирующей крови (ОЦК) и увеличение осмотического давления крови (ОДК). В результате раздражения осмо- и волюморецепторов усиливается секреция АДГ задней долей гипофиза. Под влиянием АДГ повышается проницаемость для воды дистальных отделов канальцев и собирательных трубок, и, соответственно, усиливается факультативная реабсорбция воды в этих отделах. В итоге выделяется мало мочи с высоким содержанием осмотически активных веществ и высокой удельной плотностью мочи. Наоборот, при избытке воды в организме и гипергидратации тканей в результате увеличения ОЦК и уменьшения ОДК происходит раздражение осмо- и волюморецепторов, и секреция АДГ резко снижается или даже прекращается. В результате реабсорбция воды в дистальных отделах канальцев и собирательных трубках снижается, тогда как Na+ продолжает реабсорбироваться в этих отделах. Поэтому выделяется много мочи с низкой концентрацией осмотически активных веществ и низкой удельной плотностью. Нарушение функционирования этого механизма при сердечной недостаточности может способствовать задержке воды в организме и формированию отечного синдрома. Чем меньше сердечный выброс, тем больше раздражение осмо- и волюморецепторов, что приводит к увеличению секреции АДГ и, соответственно, задержке жидкости. Предсердный натрийуретический пептид Предсердный натрийуретический пептид (ПНУП) является своеобразным антагонистом вазоконстрикторных систем организма (САС, РААС, АДГ и других). Он продуцируется миоцитами предсердий и выделяется в кровоток при их растяжении. ПНУП вызывает вазодилатирующий, натрийуретический и диуретический эффекты, угнетает секрецию ренина и альдостерона. Секреция ПНУП — это один из наиболее ранних компенсаторных механизмов, препятствующих чрезмерной вазоконстрикции, задержке Nа+ и воды в организме, а также увеличению пред- и постнагрузки. Активность ПНУП быстро усиливается по мере прогрессирования СН. Однако, несмотря на высокий уровень циркулирующего ПНУП, степень его положительных эффектов при хронической СН заметно снижается, что связано, вероятно, с уменьшением чувствительности рецепторов и увеличением расщепления пептида. Поэтому максимальный уровень циркулирующего ПНУП ассоциируется с неблагоприятным течением хронической СН. Нарушения эндотелиальной функции Нарушениям эндотелиальной функции в последние годы придается особое значение в формировании и прогрессировании ХСН. Дисфункция эндотелия, возникающая под действием различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и т.д.), характеризуется преобладанием вазоконстрикторных эндотелийзависимых влияний и закономерно сопровождается повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов и процессов пристеночного тромбообразования (см. главу 1). Напомним, что к числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЭТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др. Они оказывают существенное влияние не только на сосудистый тонус, приводя к выраженной и стойкой вазоконстрикции, но и на сократимость миокарда, величину преднагрузки и постнагрузки, агрегацию тромбоцитов и т.д. (подробнее см. главу 1). Важнейшим свойством эндотелина-1 является его способность “запускать” внутриклеточные механизмы, приводящие к усилению белкового синтеза и развитию гипертрофии сердечной мышцы. Последняя, как известно, является важнейшим фактором, так или иначе осложняющим течение СН. Кроме того, эндотелин-1 способствует образованию коллагена в сердечной мышце и развитию кардиофиброза. Существенную роль вазоконстрикторные субстанции играют в процессе пристеночного тромбообразования (рис. 2.6). Показано, что при тяжелой и прогностически неблагоприятной ХСН уровень эндотелина-1 повышен в 2–3 раза. Его концентрация в плазме крови коррелирует с выраженностью нарушений внутрисердечной гемодинамики, давлением в легочной артерии и уровнем летальности у пациентов с ХСН.
Таким образом, описанные эффекты гиперактивации нейрогормональных систем вместе с типичными нарушениями гемодинамики лежат в основе характерных клинических проявлений СН. Причем, симптоматика острой СН главным образом определяется внезапно наступившими расстройствами гемодинамики (выраженным снижением сердечного выброса и ростом давления наполнения), микроциркуляторными нарушениями, которые усугубляются активацией САС, РААС (преимущественно почечной). В развитии хронической СН в настоящее время большее значение придают длительной гиперактивации нейрогормонов и эндотелиальной дисфункции, сопровождающихся выраженной задержкой натрия и воды, системной вазоконстрикцией, тахикардией, развитием гипертрофии, кардиофиброза и токсическим повреждением миокарда. |
|
2.3. Клиническая картина |
|
|
|
2.3.1. Основные клинические формы сердечной недостаточности
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В зависимости от скорости развития симптомов СН, преимущественного поражения левых или правых отделов сердца, а также преобладания систолической или диастолической дисфункции ЛЖ, различают несколько клинических форм СН (рис. 2.7). 1. Систолическая и диастолическая СН. Систолическая СН обусловлена нарушением насосной функции сердца, а диастолическая — расстройствами расслабления миокарда желудочков. Такое деление всех случаев СН на систолическую и диастолическую достаточно условно, поскольку существует немало заболеваний, для которых характерна как систолическая, так и диастолическая дисфункция ЛЖ. Тем не менее диагностика и лечение СН с преобладанием диастолической дисфункции имеют свои существенные особенности, которые требуют специального обсуждения.
2. Острая и хроническая СН. Клинические проявления острой СН развиваются в течение нескольких минут или часов, а симптоматика хронической СН — от нескольких недель до нескольких лет от начала заболевания. Характерные клинические особенности острой и хронической СН позволяют практически во всех случаях достаточно легко различать эти две формы сердечной декомпенсации. Однако следует иметь в виду, что острая, например, левожелудочковая недостаточность (сердечная астма, отек легких) может возникать на фоне длительно текущей хронической СН. 3. Левожелудочковая, правожелудочковая, бивентрикулярная (тотальная) СН. При левожелудочковой (или “левосердечной”) недостаточности преобладает симптоматика венозного застоя крови в малом круге (одышка, удушье, отек легких, положение ортопноэ, влажные хрипы в легких и др.), а при правожелудочковой — в большом круге кровообращения (отеки, гепатомегалия, набухание шейных вен и др.). Следует все же иметь в виду, что такое четкое деление клинической картины заболевания на лево- и правожелудочковую недостаточность наиболее характерно для острой СН. Симптоматология хронической СН часто развивается по типу бивентрикулярной (тотальной) СН, когда имеет место застой крови в венах как малого, так и большого кругов кровообращения. Причем в большинстве случаев имеет место первичное поражение левых отделов сердца (постинфарктный кардиосклероз, АГ и др.), которое со временем приводит к застою крови в легких и формированию легочной артериальной гипертензии. Последняя является причиной вторичного поражения ПЖ (гипертрофия, дилатация, нарушение систолической функции) и присоединения клинических признаков правожелудочковой СН. Задержка натрия и воды, вазоконстрикция, тахикардия, ремоделирование как левых, так и правых отделов сердца, обусловленные длительной гиперактивацией САС, РААС и других нейрогормональных систем, способствуют формированию именно бивентрикулярной (тотальной) хронической СН. Только при первичном поражении ПЖ или его длительной перегрузке (например, при хроническом легочном сердце) постепенно формируется симптоматика изолированной правожелудочковой хронической СН. 4. СН с низким и высоким сердечным выбросом. В большинстве случаев систолической СН (острой или хронической) имеет место тенденция к снижению абсолютных значений сердечного выброса (уменьшение УО, МО, СИ, УИ, ФВ). Такая ситуация возникает при остром ИМ, ИБС, АГ, миокардитах и других заболеваниях. Однако в тех случаях, когда исходно имеется увеличение метаболических потребностей органов и тканей или недостаточность кислородной транспортной функции крови (гипертиреоз, хроническое легочное сердце, беременность, артерио-венозные шунты, болезнь Педжета, анемия), как правило, выявляется умеренное компенсаторное повышение сердечного выброса, обусловленное, в частности, увеличением ОЦК в результате значительной задержки натрия и жидкости под влиянием активации РААС. Ниже приведено описание отдельных клинических форм острой и хронической систолической, а также хронической диастолической СН. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Наиболее частыми причинами острой СН являются: 1. Острый ИМ, в том числе:
2. Декомпенсация хронической СН, обусловленной любым заболеванием сердца. 3. Остро развившаяся клапанная недостаточность (митрального, трикуспидального, аортального). 4. Внезапное резкое повышение системного АД (например, гипертонический криз). 5. Аритмии:
6. Тромбоэмболия легочной артерии (ТЭЛА). 7. Распространенный ИМ правого желудочка. 8. Тампонада сердца. 9. Травмы сердца. 10. Анемии. 11. “Тиреотоксическое сердце”. В большинстве случаев развивается острая левожелудочковая недостаточность, которая клинически может проявляться сердечной астмой, альвеолярным отеком легких и кардиогенным шоком. Острая правожелудочковая недостаточность наиболее часто развивается при распространенном ИМ правого желудочка, ТЭЛА и тампонаде сердца. Наконец, при анемиях и “тиреотоксическом сердце” может развиться СН с высоким сердечным выбросом. Клиническая картина, диагностика и лечение всех видов острой лево- и правожелудочковой недостаточности подробно изложены в разделах “ИМ”, “Тромбоэмболия ЛА” и “Легочное сердце”. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Как видно из схемы, представленной на рис. 2.7, при наиболее распространенных заболеваниях, связанных с первичным повреждением или хронической перегрузкой ЛЖ (ИБС, постинфарктный кардиосклероз, АГ и др.), последовательно развиваются клинические признаки хронической левожелудочковой недостаточности, легочной артериальной гипертензии и правожелудочковой недостаточности. На определенных этапах сердечной декомпенсации начинают проявляться признаки гипоперфузии периферических органов и тканей, связанной как с гемодинамическими нарушениями, так и с гиперактивацией нейрогормональных систем. Это и составляет основу клинической картины бивентрикулярной (тотальной) СН, наиболее часто встречающейся в клинической практике. При хронической перегрузке ПЖ или первичном повреждении этого отдела сердца развивается изолированная правожелудочковая хроническая СН (например, хроническое легочное сердце). Ниже приведено описание клинической картины хронической систолической бивентрикулярной (тотальной) СН. Жалобы Одышка (dyspnoe) — один из наиболее ранних симптомов хронической СН. Вначале одышка возникает только при физической нагрузке и проходит после ее прекращения. По мере прогрессирования болезни одышка начинает появляться при все меньшей нагрузке, а затем и в покое. Одышка появляется в результате повышения КДД и давления наполнения ЛЖ и свидетельствует о возникновении или усугублении застоя крови в венозном русле малого круга кровообращения. Непосредственными причинами одышки у больных хронической СН являются:
Все три причины ведут к уменьшению газообмена в легких и раздражению дыхательного центра. Ортопноэ (orthopnoe) — это одышка, возникающая в положении больного лежа с низким изголовьем и исчезающая в вертикальном положении. Одышка появляется обычно через несколько минут пребывания больного в постели, но быстро проходит, как только он садится или занимает полусидячее положение. Нередко такие больные, ложась в постель, подкладывают под голову несколько подушек и в таком полусидячем положении проводят всю ночь. Ортопноэ возникает в результате увеличения венозного притока крови к сердцу, наступающего в горизонтальном положении больного, и еще большего переполнения кровью малого круга кровообращения. Появление такого вида одышки, как правило, свидетельствует о значительных нарушениях гемодинамики в малом круге кровообращения и высоком давлении наполнения (или давлении “заклинивания” — см. ниже). Непродуктивный сухой кашель у больных хронической СН нередко сопровождает одышку, появляясь либо в горизонтальном положении больного, либо после физической нагрузки. Кашель возникает вследствие длительного застоя крови в легких, набухания слизистой бронхов и раздражения соответствующих кашлевых рецепторов (“сердечный бронхит”). В отличие от кашля при бронхолегочных заболеваниях у больных с хронической СН кашель является непродуктивным и проходит после эффективного лечения сердечной недостаточности. Сердечная астма (“пароксизмальная ночная одышка”) — это приступ интенсивной одышки, быстро переходящей в удушье. Приступ чаще всего развивается ночью, когда больной находится в постели. Больной садится, но это часто не приносит заметного облегчения: удушье постепенно нарастает, сопровождаясь сухим кашлем, возбуждением, страхом больного за свою жизнь. Быстрое ухудшение состояния больного заставляет его обратиться за медицинской помощью. После проведения неотложной терапии приступ обычно купируется, хотя в тяжелых случаях удушье продолжает прогрессировать и развивается отек легких. Сердечная астма и отек легких относятся к проявлениям острой СН и вызываются быстрым и значительным уменьшением сократимости ЛЖ, увеличением венозного притока крови к сердцу и застоя в малом круге кровообращения. Клиническая картина сердечной астмы и отека легких подробно описана в главе 6.
Выраженная мышечная слабость, быстрое утомление и тяжесть в нижних конечностях, появляющиеся даже на фоне небольших физических нагрузок, также относятся к ранним проявлениям хронической СН. Эти симптомы далеко не всегда коррелируют с тяжестью одышки, выраженностью отечного синдрома и других признаков СН. Они обусловлены нарушением перфузии скелетных мышц, причем не только за счет уменьшения величины сердечного выброса, но и в результате спастического сокращения артериол, вызванного высокой активностью САС, РААС, эндотелина и уменьшением расширительного резерва сосудов. Сердцебиение. Ощущение сердцебиений чаще всего связано с характерной для больных с СН синусовой тахикардией, возникающей в результате активации САС. Сердцебиения вначале появляются при физической нагрузке, а затем и в покое, как правило, свидетельствуя о прогрессирующем нарушении функционального состояния сердца. В других случаях, жалуясь на сердцебиение, больные имеют в виду ощущение сильных ударов сердца, связанных, например, с увеличением пульсового АД. Наконец, жалобы на сердцебиение и перебои в работе сердца могут указывать на наличие у больных разнообразных нарушений сердечного ритма, например, на появление фибрилляции предсердий или частую экстрасистолию. Отеки на ногах — одна из наиболее характерных жалоб больных с хронической СН. На ранних стадиях недостаточности отеки локализуются в области стоп и лодыжек, появляются у больных к вечеру, а к утру могут проходить. По мере прогрессирования СН отеки распространяются на область голеней и бедер и могут сохраняться в течение всего дня, усиливаясь к вечеру. Отеки и другие проявления отечного синдрома связаны, в первую очередь, с задержкой Nа+ и воды в организме, а также с застоем крови в венозном русле большого круга кровообращения (правожелудочковая недостаточность) и повышением гидростатического давления в капиллярном русле. Подробнее патогенез отеков описан в разделе “Осмотр”. Никтурия — увеличение диуреза в ночное время — также весьма характерный симптом, появляющийся у больных уже на ранних стадиях развития хронической СН. Абсолютное или относительное преобладание диуреза в ночное время связано с тем, что днем, когда больной большую часть времени находится в физически активном состоянии, выполняя те или иные нагрузки, начинает сказываться недостаточная перфузия почек, что сопровождается некоторым снижением диуреза. Такая гипоперфузия почек по крайней мере частично может быть связана со своеобразным адаптационным перераспределением кровотока, направленным прежде всего на обеспечение кровоснабжения жизненно важных органов (головной мозг, сердце). Ночью, когда больной находится в горизонтальном положении, а метаболические потребности периферических органов и тканей уменьшаются, почечный кровоток возрастает, и диурез увеличивается. Следует иметь в виду, что в терминальной стадии хронической СН, когда сердечный выброс и почечный кровоток резко уменьшаются даже в покое, наблюдается значительное уменьшение суточного диуреза — олигурия. К проявлениям хронической правожелудочковой (или бивентрикулярной) СН относятся также жалобы больных на боли или чувство тяжести в правом подреберье, связанные с увеличением печени и растяжением глиссоновой капсулы, а также на диспепсические расстройства (снижение аппетита, тошноту, рвоту, метеоризм и др.). Осмотр При общем осмотре больного с хронической СН прежде всего обращают внимание на некоторые объективные признаки, связанные с застоем крови в малом или большом круге кровообращения, хотя на ранних стадиях заболевания они могут отсутствовать. Положение ортопноэ (orthopnoe) — это вынужденное сидячее или полусидячее положение в постели, как правило, с опущенными вниз ногами (рис. 2.8, см. цветную вклейку в конце книги). Такое положение характерно для больных с тяжелой левожелудочковой недостаточностью и выраженным застоем крови в малом круге кровообращения. Положение ортопноэ больные занимают не только во время приступа сердечной астмы или отека легких, но и при выраженной одышке (ортопноэ), усиливающейся в горизонтальном положении (см. выше).
Цианоз у больных с хронической СН обусловлен замедлением кровотока на периферии, в результате чего увеличивается экстракция кислорода тканями. Это приводит к увеличению содержания восстановленного гемоглобина выше 40–50 г/л и сопровождается периферическим цианозом — акроцианозом (рис. 2.9). Акроцианоз у больных с хронической СН часто сочетается с похолоданием кожи конечностей, что также указывает на замедление периферического кровотока.
Отеки у больных с правожелудочковой или бивентрикулярной недостаточностью обусловлены рядом причин (рис. 2.10): увеличением гидростатического давления в венозном русле большого круга кровообращения, снижением онкотического давления плазмы (ОДП) в результате застоя крови в печени и нарушения синтеза белков, нарушением проницаемости сосудов, задержкой натрия и воды, вызванной активацией РААС и т.п. Однако наибольшее значение имеет повышение гидростатического давления крови. В норме (рис. 2.11, а) в венозном русле периферического кровотока гидростатичекое давление крови (темные столбики) существенно меньше онкотического (светлые столбики), что способствует поступлению воды из тканей в сосудистое русло. Наоборот, при венозном застое (рис. 2.11, б) гидростатическое давление в венозном русле может оказаться выше онкотического, что сопровождается выходом воды из сосудистого русла в ткани. Периферические отеки у больных с хронической СН локализуются обычно в местах наибольшего гидростатического давления в венах. В течение длительного времени они располагаются на нижних конечностях, вначале в области стоп и лодыжек, а затем в области голеней. Как правило, отеки симметричны, т.е. выражены одинаково на обеих ногах. Преобладание отечности одной из конечностей, как правило, свидетельствует о местном нарушении венозного кровотока, например, при одностороннем илеофеморальном тромбозе. Отеки на ногах у больных с хронической СН обычно сочетаются с акроцианозом и похолоданием конечностей. При длительном существовании отеков появляются трофические изменения кожи — ее истончение и гиперпигментация (рис. 2.12, см. цветную вклейку).
Наконец, у тяжелых больных, длительно находящихся на постельном режиме, отеки располагаются преимущественно в области крестца, ягодиц и задней поверхности бедер. Набухание шейных вен является важным клиническим признаком повышения центрального венозного давления (ЦВД), т.е. давления в правом предсердии (ПП), и застоя крови в венозном русле большого круга кровообращения (рис. 2.13, см. цветную вклейку).
Ориентировочное представление о величине ЦВД можно составить при осмотре вен шеи. У здоровых лиц в положении лежа на спине со слегка приподнятым изголовьем (примерно под углом 45°) поверхностные вены шеи или не видны, или бывают наполненными только в пределах нижней трети шейного участка вены (рис. 2.14, а). В вертикальном положении наполнение вен уменьшается и исчезает совсем. При этом в норме уровень наполнения вен шеи на 1–3 см выше горизонтальной линии, проведенной через угол, образованный рукояткой и телом грудины (угол Людовика) и соответствующий месту прикрепления II ребра к грудине. Если учесть, что угол Людовика в любом положении пациента примерно на 5 см выше правого предсердия, то ЦВД можно измерить, определив расстояние от угла Людовика до уровня наполнения шейных вен (это расстояние измеряют строго вертикально). Прибавив к этому расстоянию 5 см, получим примерное значение ЦВД, например, 3 см + 5 см = 8 см вод. ст. При застое крови в большом круге кровообращения наполнение вен оказывается существенно выше уровня угла Людовика (более чем на 4–5 см) и сохраняется при поднимании головы и плеч и даже в вертикальном положении (рис. 2.14, б).
Абдоминально-югулярный (или гепато-югулярный) рефлюкс также является надежным показателем высокого ЦВД. Абдоминально-югулярная проба проводится путем непродолжительного (в течение 10 с) надавливания ладонью руки на переднюю брюшную стенку в околопупочной области. Исследование проводится при спокойном дыхании. Надавливание на переднюю брюшную стенку и увеличение венозного притока крови к сердцу в норме, при достаточной сократительной способности ПЖ, не сопровождаются набуханием шейных вен и увеличением ЦВД. Возможно лишь небольшое (не более 3–4 см вод. ст.) и непродолжительное (первые 5 с давления) возрастание венозного давления. У больных с бивентрикулярной (или правожелудочковой) ХСН, снижением насосной функции ПЖ и застоем в венах большого круга кровообращения абдоминально- югулярная проба приводит к усилению набухания вен шеи и возрастанию ЦВД не менее чем на 4 см вод. ст. Положительная абдоминально-югулярная проба косвенно свидетельствует не только об ухудшении гемодинамики правых отделов сердца, но и о возможном повышении давления наполнения ЛЖ, т.е. о выраженности бивентрикулярной ХСН. Оценка результатов абдоминально-югулярной пробы в большинстве случаев позволяет уточнить причину периферических отеков, особенно в тех случаях, когда отсутствует значительное расширение вен шеи или другие внешние признаки правожелудочковой недостаточности. Положительные результаты пробы свидетельствуют о наличии застоя в венах большого круга кровообращения, обусловленном правожелудочковой недостаточностью. Отрицательный результат пробы исключает сердечную недостаточность как причину отеков. В этих случаях следует думать о другом генезе отеков (гипоонкотические отеки, тромбофлебит глубоких вен голеней, прием антагонистов кальция и др.).
В терминальной стадии хронической СН нередко развивается так называемая “сердечная кахексия”, важнейшими физикальными признаками которой являются резкое снижение массы тела, уменьшение толщины подкожно-жирового слоя, атрофия височных мышц и мышц гипотенора. Ее возникновение связывают с выраженными дистрофическими изменениями внутренних органов и скелетных мышц, обусловленными критическим снижением их перфузии и длительной гиперактивацией САС, РААС и других нейрогормональных систем. По-видимому, решающее значение имеет активация системы цитокинов, в частности фактора некроза опухолей альфа (ФНОa), которые обладают прямым повреждающим действием на периферические ткани. Повышение уровня цитокинов, в первую очередь ФНОa, ассоциируется также с иммуновоспалительными реакциями. Важными причинами развития сердечной кахексии являются также нарушения функции органов брюшной полости, вызванные застоем крови в системе воротной вены: ухудшение всасывания в кишечнике, снижение белково-синтетической функции печени, выраженная анорексия, тошнота, рвота и.т.п. Исследование органов дыхания Осмотр грудной клетки. Подсчет частоты дыхательных движений (ЧДД) позволяет ориентировочно оценить степень вентиляционных нарушений, обусловленных хроническим застоем крови в малом круге кровообращения. Во многих случаях одышка у больных ХСН носит характер тахипноэ, без отчетливого преобладания объективных признаков затруднения вдоха или выдоха. В тяжелых случаях, связанных со значительным переполнением легких кровью, что ведет к повышению ригидности легочной ткани, одышка может приобретать характер инспираторного диспноэ. В случае изолированной правожелудочковой недостаточности, развившейся на фоне хронических обструктивных заболеваний легких (например, легочное сердце), одышка имеет экспираторный характер и сопровождается эмфиземой легких и другими признаками обструктивного синдрома (подробнее см. ниже). В терминальной стадии ХСН нередко появляется апериодическое дыхание Чейна– Стокса, когда короткие периоды учащенного дыхания чередуются с периодами апноэ. Причиной появления такого типа дыхания является резкое снижение чувствительности дыхательного центра к СО2 (углекислому газу), что связано с тяжелой дыхательной недостаточностью, метаболическим и дыхательным ацидозом и нарушением перфузии головного мозга у больных ХСН. При резком повышении порога чувствительности дыхательного центра у больных ХСН дыхательные движения “инициируются” дыхательным центром только при необычно высокой концентрации СО2 в крови, которая достигается лишь в конце 10–15-секундного периода апноэ. Несколько частых дыхательных движений приводят к снижению концентрации СО2 до уровня ниже порога чувствительности, в результате чего период апноэ повторяется. Аускультация легких. При хронической левожелудочковой недостаточности и длительном застое крови в малом круге кровообращения в нижних отделах легких часто выслушиваются мелкопузырчатые незвучные влажные хрипы или крепитация, обычно на фоне ослабленного везикулярного или жесткого дыхания. Эти побочные дыхательные шумы выслушиваются симметрично с обеих сторон. Крепитация нередко выслушивается при хроническом венозном интерстициальном застое крови в легких и обусловлена раскрытием на высоте максимального вдоха спавшихся альвеол. Теоретически спадение легочных альвеол во время выдоха может произойти и при отсутствии застоя крови в легких, однако объем воздуха в альвеолах, при котором это произойдет (“объем спадения альвеол”), очень мал и при обычном выдохе практически не достигается. При наличии венозного застоя крови в малом круге кровообращения и увеличении массы легочного интерстиция объем спадения альвеол увеличен и поэтому на выдохе достигается легче. Таким образом, при наличии интерстициального застоя альвеолы спадаются на выдохе уже при обычном дыхании. В результате на высоте последующего вдоха может выслушиваться крепитация. Влажные мелкопузырчатые “застойные” хрипы в легких возникают в результате гиперпродукции жидкого бронхиального секрета. Влажные хрипы обычно выслушиваются с обеих сторон, преимущественно в нижних отделах легких. При альвеолярном отеке легких, осложняющем течение ХСН, появление влажных хрипов связано с транссудацией в альвеолы небольшого количества плазмы крови, которая быстро достигает бронхов и, вспениваясь при дыхании, создает типичную аускультативную картину отека легких. В отличие от хронического венозного застоя, при альвеолярном отеке легких хрипы быстро распространяются на всю поверхность грудной клетки и становятся средне- и крупнопузырчатыми, что говорит о нахождении пенистого серозного секрета в крупных бронхах и трахее. В этих случаях у больного появляется клокочущее дыхание, слышимое на расстоянии. Следует помнить, что в отдельных случаях у больных с хроническим застоем крови в малом круге кровообращения могут выслушиваться сухие хрипы при полном отсутствии влажных. Сухие хрипы в этих случаях возникают в результате выраженного отека и набухания слизистой бронхов невоспалительного характера. Они могут указывать на наличие застоя крови в легких только в том случае, если в анамнезе отсутствуют указания на сопутствующие бронхиальную астму или хронический бронхит. Гидроторакс (транссудат в плевральной полости) нередко встречается у больных с бивентрикулярной ХСН. Обычно жидкость локализуется в правой плевральной полости, а количество транссудата не превышает 100–200 мл. При этом справа ниже угла лопатки и в аксиллярной области определяется небольшое притупление перкуторного звука и ослабление дыхания. Наблюдается также отклонение трахеи в сторону, противоположную скоплению транссудата. Побочные дыхательные шумы для гидроторакса не характерны. Следует помнить, что плевральный выпот может быть симптомом не только правожелудочковой, но и левожелудочковой недостаточности, поскольку отток плевральной жидкости происходит как в вены большого круга кровообращения, так и в систему малого круга. Исследование сердечно-сосудистой системы Результаты пальпации, перкуссии и аускультации сердца у больных с хронической СН прежде всего определяются характером основного заболевания, осложнившегося развитием сердечной декомпенсации. Тем не менее можно выделить некоторые общие, хотя и неспецифические, признаки, характерные для большинства больных ХСН. Пальпация и перкуссия сердца. Верхушечный толчок и левая граница относительной тупости сердца, как правило, смещены влево за счет расширения полости ЛЖ (рис. 2.16, а). При возникновении легочной артериальной гипертензии и вовлечении в патологический процесс правых отделов сердца пальпируются усиленный и разлитой сердечный толчок и эпигастральная пульсация, которые свидетельствуют о дилатации и гипертрофии ПЖ (рис. 2.16, б). В более редких случаях можно обнаружить смещение вправо правой границы относительной тупости и расширение абсолютной тупости сердца (рис. 2.16, в). Следует помнить, что иногда сердечный толчок может выявляться также при значительном увеличении ЛП, поскольку оно топографически располагается позади ПЖ и при своем расширении оттесняет ПЖ кпереди. В отличие от пульсации, обусловленной гипертрофией и дилатацией ПЖ (истинный сердечный толчок), пульсация, связанная с увеличением ЛП, определяется локально слева от грудины и не распространяется на эпигастральную область. Аускультация сердца. Тахикардия часто выявляется у больных с ХСН. Увеличение ЧСС способствует, как известно, поддержанию более высоких значений сердечного выброса, поскольку МО = УО х ЧСС. В то же время следует помнить, что тахикардия является весьма неблагоприятным фактором, ведущим к росту внутримиокардиального напряжения и величины постнагрузки на ЛЖ. Кроме того, при тахикардии происходит укорочение диастолической паузы, что неблагоприятно сказывается на диастолическом наполнении желудочков (см. главу 1).
При аускультации сердца у больных ХСН нередко выявляются разнообразные нарушения сердечного ритма и проводимости, в частности, фибрилляция предсердий и экстрасистолия. Сердечные аритмии не только усугубляют характерные для ХСН гемодинамические расстройства, но и существенно ухудшают прогноз больных с сердечной декомпенсацией. Диагностика нарушений сердечного ритма подробно описана в главе 3. При ХСН важно оценить и правильно интерпретировать изменения громкости основных тонов сердца и появление дополнительных тонов. Ослабление I и II тонов наблюдается у многих больных ХСН, обычно указывая на уменьшение скорости сокращения и расслабления дилатированного ЛЖ. Однако при высоком давлении в ЛА во II межреберье слева от грудины может определяться акцент II тона на ЛА (рис. 2.17, а). Если одновременно замедляется изгнание крови из ПЖ (например, при его гипертрофии и/или снижении сократимости), на ЛА, помимо акцента II тона, определяется его расщепление за счет более позднего возникновения пульмонального компонента II тона (рис. 2.17, б).
На верхушке сердца у больных ХСН с выраженной систолической дисфункцией и дилатированным желудочком нередко определяется дополнительный патологический III тон сердца и, соответственно, выслушивается трехчленный протодиастолический ритм галопа (рис. 2.18, б). Он возникает в конце фазы быстрого наполнения в результате гидравлического удара о стенку желудочка порции крови, перемещающейся под действием градиента давления из предсердия в желудочек. В норме при хорошем диастолическом тонусе сердечной мышцы и нормальном давлении в предсердии удар порции крови, поступающей из предсердия, как бы амортизируется нормально расслабляющимся миокардом желудочка (рис. 2.18, а). При любой объемной перегрузке желудочка, сопровождающейся его дилатацией, в том числе у больных ХСН, амплитуда и скорость диастолического расслабления падают и становятся существенно меньше объемной скорости кровотока из предсердия. Поэтому амортизации гидравлического удара крови о стенку дилатированного желудочка не происходит, и возникает III патологический тон сердца (рис. 2.18, б).
Левожелудочковый протодиастолический ритм галопа следует выслушивать на верхушке сердца, лучше в положении больного на левом боку. При поражении ПЖ, сопровождающемся его объемной перегрузкой и дилатацией, в том числе у больных ХСН, можно выслушать правожелудочковый протодиастолический ритм галопа Он лучше определяется над мечевидным отростком или в V межреберье у левого края грудины. Патологический IV тон и, соответственно, пресистолический ритм галопа обычно выявляется у больных с выраженной диастолической дисфункцией ЛЖ (“жесткий”, неподатливый желудочек) в момент усиленного сокращения ЛП (рис. 2.19). Поэтому любые причины, ведущие к увеличению жесткости стенки желудочка (гипертрофия, ишемия, фиброз и др.) и давления наполнения, в том числе у больных с систолической ХСН, могут вызвать появление патологического IV тона. Наоборот, при отсутствии сокращения предсердий (мерцательная аритмия) или разобщении сокращений предсердий и желудочков (АВ-блокада III степени) IV тон не выявляется. Следует все же помнить, что для больных с систолической ХСН и объемной перегрузкой желудочка наиболее характерно появление протодиастолического ритма галопа.
Артериальный пульс. Изменения артериального пульса у больных ХСН зависят от стадии сердечной декомпенсации, выраженности гемодинамических расстройств и наличия нарушений сердечного ритма и проводимости. В тяжелых случаях артериальный пульс частый (pulsus frequens), нередко аритмичный (pulsus irregularis), слабого наполнения и напряжения (pulsus parvus et tardus). Уменьшение величины артериального пульса и его наполнения, как правило, указывают на значительное снижение УО и скорости изгнания крови из ЛЖ. При наличии мерцательной аритмии или частой экстрасистолии у больных ХСН важно определить дефицит пульса (pulsus deficiens). Он представляет собой разность между числом сердечных сокращений и частотой артериального пульса. Дефицит пульса чаще выявляется при тахисистолической форме мерцательной аритмии (см. главу 3) в результате того, что часть сердечных сокращений возникает после очень короткой диастолической паузы, во время которой не происходит достаточного наполнения желудочков кровью. Эти сокращения сердца происходят как бы “впустую” и не сопровождаются изгнанием крови в артериальное русло большого круга кровообращения. Поэтому число пульсовых волн оказывается значительно меньшим, чем количество сердечных сокращений. Естественно, при уменьшении сердечного выброса дефицит пульса возрастает, свидетельствуя о значительном снижении функциональных возможностей сердца. Альтернирующий пульс (pulsus alternans) характеризуется регулярным чередованием пульсовых волн большой и малой амплитуды при правильном (чаще синусовом) ритме (рис. 2.20). Чаще всего альтернирующий пульс можно обнаружить у больных с тяжелой левожелудочковой миокардиальной недостаточностью, главным образом, у пациентов с АГ и ИБС. Альтернирующий пульс сочетается с таким же регулярным изменением величины ударного выброса и громкости тонов сердца. Причины альтернирующего пульса у больных ХСН до конца не выяснены. Полагают, что это связано с выраженной неоднородностью мышцы ЛЖ, некоторые участки которого, например, области ишемизированного “гибернирующего” миокарда (см. главу 5), отвечают механическим сокращением не на каждый приходящий к ним электрический импульс. Это может быть связано, например, с более продолжительным рефрактерным периодом кардиомиоцитов, расположенных в данной ишемизированной зоне, или с другими причинами. Кстати, в части случаев альтернирующий пульс сочетается с такой же регулярной альтернацией желудочковых комплексов QRS на ЭКГ (электрическая альтернация). Так или иначе, появление альтернирующего пульса у больных ХСН является весьма неблагоприятным признаком, указывающим на тяжесть гемодинамических расстройств. Артериальное давление. В тех случаях, когда у больного ХСН до появления симптомов сердечной декомпенсации отсутствовала артериальная гипертензия (АГ), уровень АД по мере прогрессирования СН нередко снижается. В тяжелых случаях систолическое АД (САД) достигает 90–100 мм рт. ст., а пульсовое АД — около 20 мм рт. ст., что связано с резким снижением сердечного выброса.
У больных АГ цифры АД могут быть повышены, но в терминальной стадии ХСН, как правило, имеется отчетливая тенденция к снижению давления. Исследование других органов Печень. При застое в венах большого круга кровообращения практически всегда наблюдается увеличение печени (застойная гепатомегалия). Печень при пальпации увеличена, край ее закруглен. Если застой в венах большого круга развивается достаточно быстро, печень может быть болезненной при пальпации. Со временем может развиваться так называемый кардиальный цирроз печени. Край печени тогда становится заостренным, а сама печень очень плотной. Асцит выявляется, как правило, в тяжелых случаях правожелудочковой и бивентрикулярной недостаточности, особенно при констриктивном перикардите или недостаточности трехстворчатого клапана. Его появление при систолической ХСН свидетельствует о наличии выраженной надпеченочной портальной гипертензии. Таким образом, симптоматика ХСН весьма многообразна и позволяет прежде всего составить представление о преимущественном поражении левых или правых отделов сердца и застое крови в соответствующем круге кровообращения. Однако следует помнить, что перечисленные ниже признаки лево- и правожелудочковой недостаточности не исчерпывают всей клинической картины хронической систолической СН. Такие признаки, как тахикардия, никтурия, быстрая мышечная утомляемость, тяжесть в нижних конечностях, сердечная кахексия и другие, не могут быть объяснены только гемодинамическими расстройствами в малом или большом круге кровобращения, поскольку в их генезе решающее значение имеет активация САС, РААС, системы цитокинов и т.п.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В нашей стране используются две клинические классификации хронической СН, которые существенно дополняют друг друга. Одна из них, созданная Н.Д. Стражеско и В.Х. Василенко при участии Г.Ф. Ланга и утвержденная на ХII Всесоюзном съезде терапевтов (1935 г.), основана на функционально-морфологических принципах оценки динамики клинических проявлений сердечной декомпенсации (табл. 2.1). Классификация приведена с современными дополнениями, рекомендованными Н.М. Мухарлямовым, Л.И. Ольбинской и др. Таблица 2.1 Классификация хронической сердечной недостаточности, принятая на XII Всесоюзном съезде терапевтов в 1935 г. (с современными дополнениями)
Хотя классификация Н.Д. Стражеско и В.Х. Василенко удобна для характеристики бивентрикулярной (тотальной) хронической СН, она не может использоваться для оценки тяжести изолированной правожелудочковой недостаточности, например, декомпенсированного легочного сердца. Функциональная классификация хронической СН Нью-Йоркской кардиологической ассоциации (NYHA, 1964) основана на чисто функциональном принципе оценки тяжести состояния больных хронической СН без характеристики морфологических изменений и нарушений гемодинамики в большом или малом круге кровобращения. Она проста и удобна для применения в клинической практике и рекомендована к использованию Международным и Европейским обществами кардиологов. Согласно этой классификации, выделяют 4 функциональных класса (ФК) в зависимости от переносимости больными физической нагрузки (табл. 2.2). Таблица 2.2 Нью-Йоркская классификация функционального состояния больных с хронической сердечной недостаточностью (в модификации), NYHA, 1964.
Формулируя диагноз хронической СН, целесообразно использовать обе классификации, существенно дополняющие друг друга. При этом следует указывать стадию хронической СН по Н.Д. Стражеско и В.Х. Василенко, а в скобках — функциональный класс СН по NYHA, отражающий функциональные возможности данного пациента. Обе классификации достаточно просты в работе, поскольку основаны на оценке клинических признаков СН. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Диагностика выраженной хронической СН с четко очерченными клиническими проявлениями обычно не представляет больших трудностей. Она основана преимущественно на следующих клинических критериях сердечной декомпенсации (P. Mc. Kee, 1971), приведенных в табл. 2.3. Для постановки диагноза хронической СН в большинстве случаев необходимо наличие двух “больших” критериев или одного “большого” и двух “малых” критериев. Вместе с тем следует помнить, что для диагностики ранних стадий хронической СН (в том числе скрытой систолической дисфункции желудочков), которые могут выявляться у 40% больных СН, этого набора клинических признаков явно недостаточно. Для диагностики бессимптомной систолической дисфункции желудочков требуется тщательное инструментальное обследование, включающее ЭхоКГ, нагрузочные пробы, радионуклидные методы исследования и др. Таблица 2.3 Критерии диагностики хронической сердечной недостаточности (по P. Mc. Kee, 1971 в модификации)
Тщательное лабораторное и инструментальное исследование больных с клиническими признаками ХСН проводится со следующими целями. 1. Диагностика основного заболевания, приведшего к возникновению ХСН. 2. Уточнение характера и степени морфологических изменений желудочков и предсердий. 3. Количественная оценка систолической и диастолической функции желудочков сердца, а также степени нарушений гемодинамики в малом и большом кругах кровообращения. 4. Объективная оценка степени активации САС, РААС и других нейрогормональных систем организма. 5. Объективный контроль за эффективностью лечения больных ХСН. В табл. 2.4. перечислены основные наиболее распространенные в клинической практике лабораторные и инструментальные тесты, рекомендуемые для обследования больных ХСН. Результаты такого комплексного обследования в большинстве случаев позволяют установить причину ХСН, оценить характер и степень нарушений гемодинамики и поражений других органов. Кроме того, в зависимости от оснащенности лечебного учреждения и с учетом имеющихся показаний и противопоказаний у больных ХСН целесообразно проведение суточного мониторирования ЭКГ по Холтеру, функциональных нагрузочных тестов, а также радионуклидных и других методов исследования. Таблица 2.4 Основные лабораторные и инструментальные тесты, рекомендованные для обследования больных ХСН (если больные не были обследованы по этой программе ранее)
К числу инструментальных диагностических тестов, обязательных при обследовании больных ХСН, относятся: ЭКГ, рентгенография органов грудной клетки, эхокардиографическое исследование (в одномерном, двухмерном и допплеровском режимах) и суточное мониторирование ЭКГ по Холтеру. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ЭКГ, зарегистрированная в покое, дает возможность выявить признаки перенесенного ИМ (патологический зубец Q), хронической ишемии миокарда, гипертрофии ЛЖ и/или ПЖ, различных нарушений ритма и проводимости. Диагностическое значение этих нарушений кратко приведено в таблице. Следует помнить, что наличие нормальной ЭКГ покоя в большинстве случаев (хотя и не всегда) позволяет почти полностью исключить диагноз хронической сердечной недостаточности. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Суточное мониторирование ЭКГ по Холтеру у больных ХСН позволяет выявить важные в диагностическом и прогностическом отношении проявления электрической нестабильности сердечной мышцы и нарушения перфузии миокарда. 1. Преходящие нарушения ритма при суточном мониторировании ЭКГ обнаруживают у большинства больных ХСН, причем в 1,7–2,3 раза чаще, чем при регистрации ЭКГ покоя. Желудочковые аритмии высоких градаций (частые, политопные и полиморфные, парные, групповые желудочковые экстрасистолы, “пробежки” желудочковой тахикардии и т.д.) — это один из предикторов внезапной сердечной смерти у больных ХСН. Частота желудочковых аритмий хорошо коррелирует с выраженностью систолической дисфункции и снижением насосной функции сердца. Наличие наджелудочковых аритмий чаще ассоциируется с диастолической дисфункцией ЛЖ и размерами полости левого предсердия (ЛП). 2. Эпизоды болевой и безболевой ишемии миокарда у больных ИБС, осложненной ХСН, также хорошо выявляются с помощью холтеровского мониторирования. Признаками преходящей ишемии миокарда являются смещения сегмента RS–Т ниже или выше изоэлектрической линии на 1,0 мм и более по сравнению с исходным уровнем. Известно, что по мере прогрессирования сердечной декомпенсации у больных ИБС уменьшаются частота и тяжесть болевой ишемии (в виде типичных приступов стенокардии) и, наоборот, увеличиваются количество и продолжительность эпизодов так называемой безболевой ишемии миокарда, т.е. преходящих депрессий сегмента RS–Т, не сопровождающихся приступом болей в области сердца. По современным представлениям, именно безболевая ишемия миокарда является прогностически неблагоприятной и повышает риск возникновения ИМ и внезапной сердечной смерти (подробнее — см. главу 5). Таким образом, у больных ХСН, развившейся на фоне ИБС, суточное мониторирование ЭКГ по Холтеру является единственным методом, позволяющим количественно оценить суммарную суточную продолжительность диагностически значимых нарушений коронарного кровотока, что важно для выбора адекватного лечения больных ХСН. 3. Вариабельность сердечного ритма (ВСР) (HRV — heart rate variability) — это количественная оценка изменчивости длительности интервалов R–R последовательных циклов сердечных сокращений. Как в норме, так и при различных заболеваниях сердечно-сосудистой системы на изменчивость сердечного ритма влияет множество кардиальных и экстракардиальных факторов, в том числе соотношение активности симпатической и парасимпатической нервных систем, центральных, гуморальных влияний. Изменения ВСР являются результатом действия всей совокупности названных факторов. Важно, что количественные показатели ВСР прежде всего интегрально отражают активность важнейших нейрогормональных систем организма (САС, РААС и др.), что имеет важное прогностическое значение у больных, перенесших ИМ, больных ХСН, кардиомиопатиями и другими заболеваниями сердца. Существует несколько способов математической оценки распределения во времени интервалов R–R различной продолжительности. На рис. 2.21 представлены гистограммы вариабельности сердечного ритма, полученные у здорового человека и у больных ХСН. На оси абсцисс откладывается величина интервалов R–R, а на оси ординат — количество (абсолютное или относительное) интервалов R–R данной продолжительности. На рис. 2.21, а видно, что у здорового человека гистограмма значений интервалов R–R близка к так называемому нормальному распределению и очень напоминает классическую кривую Гаусса. При гиперсимпатикотонии (рис. 2.21, б) гистограмма имеет узкое основание, заостренную вершину и смещена влево — в область более низких значений интервалов R–R (укорочение R–R соответствует увеличению ЧСС). Даже простая визуальная оценка такой гистограммы свидетельствует об уменьшении ВСР. Наоборот, при преобладании активности парасимпатической нервной системы (рис. 2.21, в) гистограмма имеет широкое основание, закругленную вершину и смещена вправо — в область более высоких значений интервалов R–R (т.е. меньших значений ЧСС). В данном случае можно говорить о возрастании ВСР. Доказано, что у больных с постинфарктным кардиосклерозом, кардиомиопатиями и ХСН имеется существенное снижение ВСР, что связывают с длительной гиперактивацией нейрогормональных систем (САС, РААС и др.).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Функциональные нагрузочные тесты проводятся главным образом с целью выявления ранних стадий ХСН (ФК I–II по NYHА), симптомы которой (одышка, утомляемость, тяжесть в конечностях и т.д.) возникают только при физической нагрузке. Согласно рекомендациям Комитета экспертов ВОЗ, у больных с более высокими функциональными классами ХСН (III–IV) нагрузочные тесты проводить не следует. Для определения толерантности к физической нагрузке используют велоэргометрическую пробу, тредмил-тест, 6-минутный тест-ходьбу и др. При этом в качестве показателя физической работоспособности используют объем выполненной нагрузки (в кгм, джоулях или метрах пройденной за 6 мин дистанции), величину максимального потребления кислорода (VO2 max) или/и величину ФВ ЛЖ. 6-минутный тест-ходьба — это наиболее простой и распространенный способ оценки физической работоспособности больных ХСН. Обследование проводят обычно в больничном коридоре длиной не менее 30–50 м. После измерения исходных АД, ЧСС и регистрации ЭКГ больному предлагают в течение 6 мин ходить по коридору и затем измеряют (в метрах) пройденную дистанцию. Темп ходьбы пациенты выбирают самостоятельно с таким расчетом, чтобы после окончания теста они не могли бы продолжать ходьбу без появления одышки, мышечной утомляемости или тяжести в ногах. Если во время отведенных на исследование 6 мин больной пойдет слишком быстро и появятся перечисленные выше симптомы, он должен снизить темп ходьбы или даже остановиться, причем эта задержка должна включаться в общую продолжительность теста — 6 мин. Если тест выполнен правильно, пройденная пациентом за 6 мин дистанция хорошо соответствует ФК ХСН по NYHА (табл. 2.5). Таблица 2.5 Параметры физической активности и потребления кислорода у больных с различными ФК хронической сердечной недостаточности (по NYHА)
Из таблицы видно, что дистанцию более 550 м за 6 мин преодолевают только здоровые люди (ФК 0 по NYHА). 6-минутная дистанция больных ХСН I ФК составляет от 426 м до 549 м, а ХСН II ФК — от 301 м до 425 м. Для пациентов III и IV ФК по NYHА 6-минутная дистанция не превышает, соответственно, 300 м и 150 м. Дополнительная оценка максимального потребления кислорода во время физической нагрузки позволяет еще более надежно классифицировать больных по степени снижения функциональных возможностей (табл. 2.5). Для определения максимального потребления кислорода регистрируют газовый состав выдыхаемого воздуха в процессе выполнения физической нагрузки (тредмил-теста или велоэргометрии). У здорового человека потребление кислорода при физической нагрузке увеличивается пропорционально ее мощности и повышению МО (рис. 2.22). При достижении определенного уровня нагрузки скорость прироста потребления кислорода начинает отставать от увеличения мышечной работы. Этот уровень и соответствует так называемому максимальному потреблению кислорода (VO2 max). У здоровых лиц максимальное потребление кислорода составляет более 22 мл/мин/м2, а у больных ХСН — уменьшается. Чем ниже VO2 max, тем меньше физическая работоспособность больного ХСН и тем тяжелее прогноз заболевания. Величина максимального потребления кислорода используется для объективной оценки функционального класса ХСН по NYHА и прогноза заболевания (табл. 2.5). Например, у больных с VO2 max Ј 10 мл/мин/м2 прогноз крайне неблагоприятный и 1-годовая летальность составляет 75%.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Рентгенография органов грудной клетки позволяет выявить важные морфологические изменения в легких и сердце, характерные для больных ХСН. Правильная интерпретация результатов рентгенологического исследования необходима для выявления у больных ХСН:
Рентгенография органов грудной клетки помогает также в диагностике инфильтративных, фиброзирующих и обструктивных заболеваний легких, клинические проявления которых могут напоминать клиническую картину ХСН (одышка, тахикардия и др.) или быть причиной изолированной правожелудочковой недостаточности (например, хронического легочного сердца). Методика рентгенографии легких и сердца подробно изложена в последующих главах руководства. В данном разделе обсуждаются возможности рентгенологической диагностики венозного застоя в легких, признаков легочной артериальной гипертензии, а также их сочетания. Как было показано выше, эти изменения весьма характерны для большинства больных бивентрикулярной ХСН, развившейся на фоне заболеваний, протекающих с преимущественным поражением левых отделов сердца (ИБС, постинфарктный кардиосклероз, АГ, миокардиты, кардиомиопатии, митральные и аортальные пороки сердца и т.д.). Вначале левожелудочковая (левосердечная) недостаточность сопровождается повышением давления наполнения ЛЖ и/или среднего давления в ЛП и легочных венах, что ведет к застою крови в венозном русле малого круга кровообращения (венозному полнокровию). Позднее к этим расстройствам часто (но не всегда) присоединяется повышение легочного сосудистого сопротивления (спазм, структурные изменения легочных артериол), что приводит к развитию легочной артериальной гипертензии. Последняя, как правило, сочетается с венозным полнокровием. Легочная артериальная гипертензия, обусловленная повышением легочного сосудистого сопротивления, характеризуется преимущественно двумя основными рентгенологическими признаками:
Это сочетание по сути и определяет основные рентгенологические признаки легочной артериальной гипертензии, к которым относятся (рис. 2.23, б): 1. расширение ствола и крупных ветвей (правой и левой) легочной артерии и усиление их пульсации, выявляемой при рентгеноскопии. На рентгенограммах в прямой проекции определяется удлинение и выбухание второй дуги левого контура срединной тени (подробнее см. ниже); 2. резко выраженное сужение периферических артерий, которые оказываются как бы укороченными, “обрубленными”. В связи с этим происходит обеднение легочного рисунка на периферии легочных полей и повышение их прозрачности, тогда как корни легких могут быть несколько расширены и уплотнены; 3. признаки увеличения размеров правого желудочка (см. главу 13). Сочетание первых двух признаков, получившее название “прыжка калибра легочной артерии”, чрезвычайно характерно для легочной артериальной гипертензии, вызванной повышением легочного сосудистого сопротивления. Венозный застой в малом круге кровообращения, развившийся у больных ХСН, является следствием повышения давления в ЛП. На начальной стадии развития венозный застой сопровождается выраженным периваскулярным отеком в участках легких с наиболее богатым кровоснабжением и перераспределением кровотока в другие отделы легких с исходно меньшей интенсивностью циркуляции крови (преимущественно в верхушечные отделы легких). Наблюдается значительное расширение легочных вен (рис. 2.23, в). При повышении давления в левом предсердии до 18–25 мм рт. ст. развивается интерстициальный, а при дальнейшем росте давления — альвеолярный отек легких. Как правило, в этих случаях к венозному застою в малом круге кровообращения присоединяются признаки легочной артериальной гипертензии, возникающей в результате повышения легочного сосудистого сопротивления. Такое сочетание венозного застоя и легочной артериальной гипертензии наиболее характерно для больных с тяжелой систолической ХСН. Рентгенологически при таком сочетании венозного застоя и артериальной гипертензии, часто свидетельствующем о начинающемся интерстициальном отеке легких (рис. 2.23, г и 2.24), выявляются следующие характерные признаки.
Таким образом, рентгенологическое исследование позволяет не только выявить важные признаки начинающегося интерстициального отека легких, но и дифференцировать “чистый” венозный застой в легких от венозного полнокровия, сочетающегося с легочной артериальной гипертензией.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Эхокардиографическое исследование позволяет получить ценную информацию о морфологических и функциональных изменениях в сердце у больных ХСН. С помощью эхокардиографии (ЭхоКГ) уточняют:
Получение столь обширной информации возможно только при комплексном использовании трех основных режимов эхокардиографии: одномерного (М-режима), двухмерного (В-режима) и допплеровского режима. Оценка систолической функции левого желудочка Для определения размеров камер сердца во время систолы и диастолы желудочков ультразвуковой датчик устанавливают обычно в левой парастернальной (рис. 2.26, а) и/или верхушечной позиции (рис. 2.26, б), что позволяет хорошо визуализировать оба предсердия и желудочка, МЖП, заднюю стенку ЛЖ, атриовентрикулярные клапаны и другие структуры сердца. Исследование в одномерном М-режиме чаще проводят из левого парастернального доступа по длинной оси сердца (см. рис. 2.26, а). Угол наклона датчика выбирают таким образом, чтобы ультразвуковой луч как бы “рассекал” сердце на уровне створок митрального клапана, аортального клапана, а также на уровне папиллярных мышц. Для ориентировочного определения глобальной систолической функции ЛЖ используют направление ультразвукового луча в сторону верхушки и сухожильных нитей (хорд) митрального клапана. При этом на экране хорошо визуализируется полость ЛЖ, которая ограничена спереди (вверху) МЖП, а сзади (внизу) — собственно задней стенкой ЛЖ (рис. 2.27). При этом на одномерных эхокардиограммах регистрируются отчетливые систоло-диастолические колебания размера полости ЛЖ, а также толщины МЖП и задней стенки ЛЖ. В норме во время систолы желудочков МЖП и задняя стенка ЛЖ утолщаются и их внутренние контуры, обращенные в полость ЛЖ, движутся навстречу друг другу. При этом размер полости ЛЖ уменьшается и в конце систолы составляет в норме 22–38 мм. Это конечно-систолический размер ЛЖ (КСРЛЖ). Во время диастолы МЖП и задняя стенка ЛЖ истончаются и их внутренние контуры движутся в противоположные стороны, а размер полости ЛЖ увеличивается. В конце диастолы измеряется конечно-диастолический размер ЛЖ (КДРЛЖ), который в норме достигает 38–56 мм. Эти измерения можно использовать не только для выявления дилатации ЛЖ, но и для вычисления важнейших гемодинамических показателей — конечного систолического (КСО) и конечного диастолического (КДО) объемов, величины ударного объема (УО), фракции выброса (ФВ) и других (подробнее см. ниже). В табл. 2.6. представлены некоторые эхокардиографические показатели, полученные в М-режиме у здоровых лиц. Расчет показателей систолической функции ЛЖ по данным, полученным при одномерном ЭхоКГ, проводится по формуле L. Teicholz:
где V — систолический или диастолический объем ЛЖ (КСО или КДО) и D — переднезадний размер ЛЖ в систолу или диастолу (КСР или КДР). УО определяется как разница КДО и КСО, а ФВ — как отношение УО к КДО. Таблица 2.6 Некоторые эхокардиографические показатели у здоровых лиц (М-режим)
Существенно более точные результаты вычисления глобальной сократимости ЛЖ могут быть получены при количественной оценке двухмерных эхокардиограмм. Наиболее пригоден для этой цели метод дисков (модифицированный метод Симпсона [Simpson]), основанный на планиметрическом определении и суммировании площадей 20 дисков, представляющих собой своеобразные поперечные срезы ЛЖ на разных уровнях. Для расчета систолических и диастолических объемов ЛЖ получают два взаимоперпендикулярных двухмерных изображения сердца из верхушечного доступа в позициях двухкамерного и четырехкамерного сердца (рис. 2.28). После выделения курсором в обеих проекциях внутреннего контура ЛЖ последний автоматически делится на 20 дисков (ai и bi) одинаковой высоты и вычисляется их площадь (Si):
Для расчета объема ЛЖ (V) площади 20 дисков суммируются, и сумма умножается на высоту каждого диска ЛЖ (L/20):
где L — длина ЛЖ. Так получают значения КДО и КСО.
Метод “площадь–длина”. При отсутствиии региональных нарушений сократимости может быть использован еще один простой и достаточно точный метод определения УО с помощью двухмерной эхокардиографии. На эхокардиограмме четырехкамерного или двухкамерного сердца (рис. 2.29), зарегистрированной из верхушечного доступа, планиметрически определяют площадь полости ЛЖ и его длину. Объем ЛЖ (V) определяют по формуле:
где А — площадь ЛЖ на изображении и L — длина полости ЛЖ. Дальнейший расчет гемодинамических показателей проводится по классическим формулам:
где МО — минутный объем, УИ — ударный индекс, СИ — сердечный индекс, S — площадь поверхности тела, определяемая по специальным номограммам.
Для оценки указанных гемодинамических показателей может быть использован метод допплер-эхокардиографии, основанный на измерении величины объемного кровотока через аортальный клапан. С этой целью из верхушечного доступа (см. рис. 2.26, б) в позициях двухкамерного или пятикамерного сердца проводят допплер-локацию выходного отдела ЛЖ в импульсном режиме, устанавливая контрольный объем (“фокусируя” ультразвуковой пучок) в центре выходного тракта на 10 мм проксимальнее закрытых створок аортального клапана (рис. 2.30, а), и получают систолический спектр линейной скорости кровотока в выходном отделе ЛЖ (рис. 2.30, б). При этом автоматически рассчитывают среднюю скорость кровотока (VСР) и интеграл линейной скорости кровотока (LVОТ VTI), т.е. сумму всех ее моментных значений во время изгнания крови в аорту (площадь под кривой допплерограммы, показанной на рис. 2.30, б). Величину LVОТ VTI можно представить также как произведение VСР (см/с) на длительность периода изгнания (ЕТ) в секундах:
После этого в режиме двухмерной ЭхоКГ, зарегистрированной из парастернального доступа по длинной оси ЛЖ, в середине систолы измеряют внутренний диаметр фиброзного кольца аортального клапана (D), автоматически рассчитывая площадь поперечного сечения корня аорты (рис. 2.30, в). Для расчета УО (мл) интеграл линейной скорости кровотока (в см) умножают на площадь поперечного сечения аорты — SAo (см2):
Понятно, что то же значение УО может быть получено при умножении средней линейной скорости кровотока (см/с) на продолжительность периода изгнания (ЕТ, в с) и площадь поперечного сечения аорты (см2):
где КДР и КСР — конечные диастолический и систолический размеры ЛЖ.
Скорость циркулярного укорочения волокон миокарда (VCF):
где dt — время сокращения ЛЖ. При снижении сократимости миокарда ЛЖ значения обоих индексов уменьшаются, причем более чувствительным показателем считается скорость циркулярного укорочения волокон миокарда (VCF) (И.М. Хейнонен, Р.Е. Денисов). Следует помнить, что расчет приведенных индексов сократимости проводится по данным одномерной ЭхоКГ и дает лишь ориентировочное представление о сократительной функции ЛЖ. Нормальные значения %DS и VCF колеблются в довольно широких пределах. Размер левого предсердия также несет важную информацию о функциональном состоянии левых отделов сердца. Его увеличение у больных ХСН косвенно свидетельствует о повышении давления наполнения и снижении функции ЛЖ. Размеры ЛП обычно измеряют в М-режиме из левой парастернальной позиции (рис. 2.31). При изменении угла наклона ультразвукового луча, показанного на рисунке, получают изображение аорты и левого предсердия, которое позволяет количественно оценить размеры этих отделов сердца. Как видно на рисунке, на экране сверху вниз определяются следующие структуры сердца: передняя стенка (RVW) и выходной тракт ПЖ (RVOT), основание аорты (Ао), полость ЛП (LА), задняя стенка ЛП. Передняя и задняя стенки основания аорты визуализируются в виде параллельных волнистых линий толщиной 2–3 мм. Они смещаются к датчику (вверх) во время систолы ЛЖ, и в противоположную сторону (вниз) — во время диастолы. Амплитуда их движения в норме достигает 10 мм. Диаметр устья аорты (“1”) измеряют от наружной поверхности ее передней стенки до внутренней поверхности задней стенки. В центре просвета аорты обычно визуализируется движение створок аортального клапана (АК): в систолу ЛЖ они расходятся, в диастолу смыкаются, образуя на эхокардиограмме типичную замкнутую кривую, напоминающую “коробочку”. Амплитуда раскрытия аортального клапана (“3”) в начале систолы ЛЖ в норме превышает 18 мм. Задняя стенка ЛП на одномерной эхокардиограмме в этой позиции во время систолы желудочков смещается в сторону от датчика (вниз) примерно на 8–10 мм. Диаметр ЛП (“2”) измеряют в период максимального движения задней стенки аорты вперед (на экране — вверх) в конце систолы (или в самом начале диастолы) от наружной поверхности задней стенки аорты до эндокардиальной поверхности ЛП. В норме этот размер составляет 19–33 мм. Следует отметить, что переднезадний размер ЛП, определяемый при М-модальном исследовании из парастернального доступа, обладает минимальной чувствительностью в диагностике дилатации предсердия, поскольку увеличение этого показателя обнаруживают, как правило, лишь на поздних стадиях расширения ЛП. Поэтому более предпочтительным является расчет объема ЛП по данным двухмерной ЭхоКГ (верхушечная позиция), который аналогичен определению объема ЛЖ по методу “площадь–длина” или по методу дисков (по Simpson). В норме размер ЛП составляет 19–33 мм. Его увеличение до 40 мм и более свидетельствует о повышении давления наполнения ЛЖ и риска застойных явлений в малом круге кровообращения. В табл. 2.7. представлены нормальные величины некоторых эхокардиографических показателей глобальной систолической функции ЛЖ. Таблица 2.7 Средние значения основных гемодинамических показателей по данным ЭхоКГ
Таким образом, основными гемодинамическими показателями, отражающими в первую очередь систолическую функцию желудочков, являются: УО, МО, СИ, ФВ, а также размеры ЛП, конечно-систолический (КСО) и конечно-диастолический (КДО) объемы ЛЖ. Нормальные значения УО и МО, а также размеров и объемов камер сердца колеблются в широких пределах и зависят от роста, массы тела и пола пациента. Поэтому для характеристики центральной гемодинамики обычно используют индексы этих показателей, т.е. отношение последних к площади поверхности тела. Наиболее ранним маркером уменьшения систолической функции ЛЖ является снижение ФВ ниже 40–45% (табл. 2.8). Понятно, что такое снижение ФВ, как видно из формулы его определения, как правило, сочетается с увеличением КСО и КДО, т.е. с дилатацией ЛЖ и его объемной перегрузкой. Такое сочетание особенно характерно для систолической формы ХСН. Следует, правда, иметь в виду сильную зависимость показателя ФВ от величины пред- и постнагрузки. Например, ФВ может уменьшаться не только при снижении сократимости миокарда желудочков, но и при гиповолемии (шок, острая кровопотеря и т.д.), уменьшении притока крови к правому сердцу, а также при быстром и резком подъеме АД (подробнее см. главу 1). Таблица 2.8 Характеристика систолической функции левого желудочка в зависимости от величины ФВ
Если у больного с ХСН имеется умеренно выраженная систолическая дисфункция ЛЖ, то уменьшение ФВ в течение некоторого времени может не сопровождаться снижением сердечного выброса, т.е. значений СИ. Это происходит, главным образом, в результате действия двух факторов:
Естественно, дальнейшее прогрессирование систолической дисфункции у больных ХСН приводит к уменьшению как ФВ, так и СИ и, соответственно, еще большему увеличению КСО, КДО и миогенной дилатации ЛЖ.
Методика эхокардиографической оценки диастолической функции ЛЖ описана в разделе 2.7. Оценка систолической функции правого желудочка Более сложной оказывается оценка глобальной систолической функции правого желудочка (ПЖ). Неплохие результаты могут быть получены при измерении диастолического размера ПЖ при регистрации М-модальной ЭхоКГ из парастернального доступа по короткой оси сердца (рис. 2.32). В норме КДРПЖ составляет около 15–20 мм, а при дилатации ПЖ обычно превышает 26 мм. Следует помнить, что нередко при таком способе исследования полость ПЖ и эндокардиальная поверхность его передней стенки видны неотчетливо в связи с наличием большого количества трабекул.
Дилатация ПЖ сравнительно хорошо выявляется при двухмерном исследовании в парастернальной позиции по короткой оси, а также в апикальной позиции четырехкамерного сердца. При диагностически значимом расширении ПЖ его размеры в этих позициях равны или даже превышают размеры ЛЖ (рис. 2.33), тогда как в норме имеют место обратные отношения.
Косвенное определение давления в легочной артерии Неинвазивное определение давления в малом круге кровообращения и диагностика легочной артериальной гипертензии необходимы для оценки тяжести течения и прогноза многих заболеваний сердца, в том числе сердечной недостаточности. М-модальное, и особенно двухмерное, ультразвуковое исследование позволяет выявить ряд косвенных признаков, характерных для повышения давления в легочной артерии: 1. Гипертрофию и дилатацию ПЖ (см. ниже). 2. Вторичную недостаточность легочного и трехстворчатого клапанов. 3. Изменение характера движения задней створки клапана легочной артерии. С помощью допплеровского исследования можно выявить наиболее достоверные качественные и количественные признаки гипертензии. Исследование систолического потока через клапан легочной артерии обычно проводят из левого парастернального доступа по короткой оси (рис. 2.34). Основная волна допплеркардиограммы направлена в сторону от ультразвукового датчика и располагается ниже базовой линии спектрограммы. Пик максимальной скорости, как правило, смещен к началу потока и имеет закругленную вершину. По сравнению с аортальным систолическим потоком крови поток в выходном отделе ПЖ и в устье легочной артерии меньшей амплитуды (не более 60–71 см/с) и имеет закругленную вершину.
Качественные критерии легочной гипертензии заключаются в изменении формы потока крови в выносящем тракте ПЖ и в устье клапана легочной артерии. При нормальном давлении в легочной артерии форма потока крови приближается к куполообразной и симметричной (рис. 2.35, а), а при легочной гипертензии становится треугольной или двухпиковой. Треугольный тип формы кривой характеризуется более быстрым формированием пика линейной скорости, который смещается к началу кривой (рис. 2.35, б). Двухпиковый тип кривой также отличается уменьшением времени начального ускорения кровотока в легочной артерии, после чего наблюдается мезосистолическое его замедление, а затем снова — позднесистолическое ускорение (рис. 2.35, в). Кривая линейной скорости при этом приобретает своеобразный W-образный вид.
Метод количественного определения среднего давления в легочной артерии (СрДЛА) (по A. Kitabatake с соавт., 1983). Данный метод отличается относительной простотой и в то же время достаточной точностью определения СрДЛА. Он основан на измерении некоторых количественных параметров, характеризующих систолический поток крови в выходном отделе ПЖ (рис. 2.36), и вычислении отношения времени ускорения потока (времени от начала кривой до ее пика — АсТ) к общей длительности изгнания из ПЖ (RVET). Было показано, что это отношение находится в обратной зависимости от величины среднего давления в легочной артерии. В табл. 2.9. представлены значения СрДЛА в зависимости от величины отношения AcT/RVET.
Таблица 2.9 Среднее давление в легочной артерии в зависимости от величины отношения AcT/RVET (по данным импульсной допплер-эхокардиографии)
Существуют и другие, более точные, способы эхокардиографического определения систолического и диастолического давления в легочной артерии. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Для характеристики состояния венозного русла большого круга кровообращения чаще всего применяют ультразвуковое исследование нижней полой вены. Это исследование позволяет объективизировать явления застоя крови в большом круге кровообращения, а также косвенно оценить уровень систолического давления в правом предсердии, т.е. центрального венозного давления (ЦВД). Исследование проводят из субкостального доступа. Датчик устанавливают под мечевидным отростком и ориентируют в позиции длинной оси нижней полой вены. У здорового человека при нормальном давлении в ПП, равном обычно 5 мм рт. ст., нижняя полая вена спадается после глубокого вдоха более чем на 50%. При наличии правожелудочковой недостаточности, повышении КДД в ПЖ и давления в ПП, наблюдается затруднение притока крови к сердцу. Поэтому коллабирование нижней полой вены во время вдоха существенно уменьшается, что является показателем застоя крови в венах большого круга кровообращения и свидетельствует о повышении давления в ПП (ЦВД). Кроме того, правожелудочковая недостаточность может сопровождаться расширением вен, относящихся к портальной системе: печеночной, воротной, верхней брыжеечной, селезеночной. Наблюдается также уменьшение величины их спадения во время глубокого вдоха.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
К числу дополнительных инструментальных методов исследования, которые используются у больных ХСН преимущественно в специализированных стационарах и крупных диагностических центрах, относятся:
Инвазивные методы исследования (катетеризацию полостей сердца и магистральных сосудов, КАГ и др.) применяют: 1. У больных ИБС и постинфарктным кардиосклерозом для решения вопроса о кардиохирургической реваскуляризации миокарда. 2. У больных с врожденными и приобретенными пороками сердца, у которых предполагается хирургическая коррекция порока. 3. У больных ГКМП и ДКМП перед проведением трансплантации сердца. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Основными целями лечения больных хронической систолической СН являются: 1. Устранение клинической симптоматики СН (одышки, повышенной утомляемости, тахикардии, отечного синдрома и т.д.). 2. Предотвращение поражений органов-мишеней (сердце, почки, головной мозг, сосуды, скелетная мускулатура). 3. Улучшение качества жизни. 4. Улучшение прогноза заболевания (продление жизни). При разработке индивидуальной тактики лечения следует учитывать большую неоднородность группы больных с признаками ХСН. Можно выделить несколько категорий таких больных:
Лечение каждой из этих категорий больных ХСН требует индивидуального дифференцированного подхода, учитывающего многие аспекты этиологии, патогенеза и клинической картины заболевания. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Правильно подобранное лечение основного заболевания, которое привело к развитию ХСН, во многих случаях может значительно уменьшить выраженность проявлений сердечной декомпенсации. К числу таких потенциально обратимых причин ХСН относятся:
Следует помнить, что без воздействия на основную причину ХСН во многих случаях трудно рассчитывать на положительные результаты лечения СН. С другой стороны, радикальное лечение основного заболевания у части больных ХСН не всегда возможно, в том числе в связи с наличием тяжелой недостаточности кровообращения. В этих случаях лечение должно быть направлено на уменьшение клинических проявлений сердечной декомпенсации и создание условий, которые бы позволили вновь вернуться к вопросу о целесообразности радикального лечения основного заболевания. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Не меньшее значение имеет выявление и устранение некоторых провоцирующих факторов — непосредственных причин ухудшения состояния больных ХСН. К числу наиболее частых из них относятся:
Большое значение имеют ятрогенные факторы, в частности, прием лекарственных средств (ЛС), вызывающих задержку натрия и воды (эстрогены, андрогены, хлорпропамид, глюкокортикоиды, миноксидил, НПВС и др.), обладающих отрицательным инотропным действием (верапамил, дилтиазем, некоторые антиаритмические ЛС I класса, b-адреноблокаторы в неадекватно больших дозах), ингибирующих образование сосудорасширяющих простагландинов и эндотелиальных факторов (НПВС, глюкокортикоиды), чрезмерное уменьшение преднагрузки (большие дозы диуретиков, ингибиторов АПФ и т.д.). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Рациональный лечебный режим. Больной ХСН нуждается в создании спокойной благожелательной обстановки дома и на работе. По возможности его следует оберегать от чрезмерного психоэмоционального напряжения и стрессовых ситуаций. В течение дня больной с СН должен иметь возможность отдохнуть, лежа в постели и придав ногам возвышенное положение. Очень важно обеспечить нормальную продолжительность сна — не менее 8–9 ч в сутки. Физические нагрузки. В настоящее время существенно пересмотрено отношение к ограничению физической нагрузки у больных ХСН. Доказано, что дозированная физическая активность больного с сердечной декомпенсацией, адекватная его функциональным возможностям, не только не приводит к прогрессированию СН, но и способствует снижению уровня нейрогормонов, повышению переносимости нагрузок и чувствительности к медикаментозному лечению. В результате повышается “эмоциональный тонус” больных и качество жизни. Резкое ограничение физической активности показано лишь в период нарастания признаков левожелудочковой недостаточности или при выраженном отечном синдроме, например у больных ФК III–IV по NYHA.
Физическая реабилитация пациентов с ХСН должна учитывать степень функциональных нарушений. Наиболее эффективны физические тренировки, организуемые для больных ХСН в специальных кардиологических и реабилитационных центрах, которые осуществляются под постоянным врачебным контролем за гемодинамикой и другими показателями. Однако более доступны самостоятельные физические упражнения, объем и интенсивность которых индивидуально определяются лечащим врачом. У больных с ФК IV по NYHA, которые при проведении 6-минутного теста-ходьбы могут пройти в умеренном темпе не более 150 м (см. выше), показаны регулярные дыхательные упражнения или физические упражнения в положении сидя. Например, больным можно рекомендовать редкое, медленное и глубокое дыхание с пролонгированным вдохом или выдохом (4–5 дыхательных циклов за 1 мин). У больных ФК III (дистанция 6-минутной ходьбы до 300 м), находящихся в стабильном состоянии, наиболее простым и доступным методом физической тренировки является дозированная ходьба. В течение первых 5 недель рекомендуется ежедневно проходить 1 км за 13–15 мин (всего около 8–10 км в неделю). В зависимости от индивидуальной переносимости, начиная с 6-й недели, увеличивают расстояние, пройденное за неделю до 10–20 км; при этом скорость ходьбы увеличивается до 11 мин на 1 км. Больным ФК I–II по NYHA (дистанция 6-минутной ходьбы, соответственно, до 500 м и 400 м) рекомендуют сочетание нескольких видов нагрузки, например ходьбы и плавания. В зависимости от функционального состояния больных и индивидуальной тренированности величина и мощность дозируемой физической нагрузки могут быть пересмотрены.
Диета больных ХСН должна быть калорийной, легкоусвояемой и скорректированной в отношении суточного приема соли и жидкости. Целесообразно дробное питание 5–6 раз в сутки. Общая калорийность питания рассчитывается с учетом массы тела (МТ) и ФК больных ХСН. Для характеристики МТ в настоящее время используют расчет так называемого индекса массы тела (ИМТ) по формуле:
В табл. 2.10. приведены значения ИМТ у пациентов с избыточным весом, ожирением и дефицитом МТ. Таблица 2.10 Характеристика массы тела в зависимости от величины ИМТ
Обычно для больных ХСН с нормальной МТ (ИМТ — 20–25), ведущих малоподвижный образ жизни или выполняющих легкую физическую нагрузку, общая калорийность суточного рациона составляет 1900–2500 ккал. Если у больных имеется избыточная МТ или ожирение, следует предусмотреть уменьшение пищевого рациона на 20–30%, в частности за счет содержания в пище животных жиров. Наоборот, при дефиците МТ (ИМТ меньше 20) у больных с сердечной кахексией суточная калорийность диеты должна быть на 20–30% больше. Из рациона питания больных ХСН целесообразно исключить шоколад, крепкий чай и кофе, острые блюда, копчености, продукты, богатые холестерином (животный жир, икра, мозги и т.п.), мучные изделия, жирные сорта мяса, сало и т.п. Резко ограничивают или исключают прием алкоголя и запрещают курение. Потребление поваренной соли обычно ограничивают до 5–6 г в сутки. Более значительное ограничение в пище натрия хлорида (до 1,5–3,0 г в сутки) показано в периоды дестабилизации состояния больных, при быстром прогрессировании симптомов левожелудочковой недостаточности или отечного синдрома. В этих случаях больным предлагается не подсаливать пищу и не употреблять продукты, содержащие повышенное количество NаCl (соленые огурцы, рыба, копчености). Даже такое ограничение обычно обеспечивает потребление соли не более 3,0 г в сутки. Если необходимо еще больше ограничить поступление NаСl (до 1,0–1,5 г в сутки), например, при выраженном отечном синдроме, пациентам ХСН дополнительно рекомендуют приготовление пищи без соли. Ограничение потребляемой жидкости должно быть достаточно разумным. При любой стадии ХСН не следует уменьшать количество вводимой жидкости меньше 0,8 л. Обычно оно составляет 1,2–1,5 л в сутки, включая все жидкие блюда (супы, чай, соки и т.п.). Даже на фоне отечного синдрома резкое ограничение вводимой жидкости в ряде случаев может сопровождаться повышением осмолярности плазмы, что приводит к избыточной продукции антидиуретического гормона (АДГ) и способствует еще большей задержке жидкости в организме и усилению отеков. В этих случаях ограничение приема натрия хлорида оказывается более эффективным, чем уменьшение количества вводимой жидкости. Больным ХСН рекомендуют употреблять в пищу продукты, содержащие калий (курагу, изюм, печеный картофель, орехи, брюссельскую капусту, бананы, персики, гречневую и овсяную крупу, телятину и др.). Калиевая диета особенно показана при лечении мочегонными средствами и сердечными гликозидами. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Представления о наиболее рациональных способах медикаментозной терапии больных ХСН за последние 50 лет претерпели существенные изменения. До 50-х годов прошлого века, когда господствовала так называемая кардиальная модель ХСН и вся симптоматика недостаточности кровообращения однозначно связывалась с падением сократимости миокарда, основным средством лечения считались сердечные гликозиды, обладающие положительным инотропным действием на сердце. В 50–60-е годы, когда разрабатывалась кардиоренальная модель ХСН, согласно которой ведущая роль в прогрессировании ХСН и избыточной задержке Nа+ и воды отводилась почкам (циркулирующая РААС), наряду с сердечными гликозидами стали активно внедряться разнообразные мочегонные средства. В 70-е годы была продемонстрирована роль нарушений периферического кровообращения в патогенезе ХСН (циркуляторная модель), и в клиническую практику стали широко внедряться периферические вазодилататоры, снижающие нагрузку на сердце. В 80–90-е годы сформировалась нейрогуморальная концепция патогенеза ХСН, связывающая изменения, происходящие в органах, в том числе в сердце, с активацией не только циркулирющих, но и тканевых нейрогормонов, в первую очередь катехоламинов, ангиотензина II, альдостерона, эндотелиальных факторов. Это привело к представлению о необходимости блокирования активности нейрогормонов с помощью ингибиторов АПФ и b-адреноблокаторов, несмотря на отрицательное инотропное действие последних на сердце. Наконец, в последние годы была вновь продемонстрирована ведущая роль гемодинамических расстройств, связанных с изменением систолической и диастолической функции миокарда, происходящим в том числе под влиянием нейрогормонов (миокардиальная, систоло-диастолическая модель).
В соответствии с этой концепцией все ЛС, применяемые при ХСН, можно разделить на 3 группы. 1. Основные (базисные) ЛС, эффективность и безопасность применения которых у больных ХСН хорошо доказана и не вызывает сомнений. К их числу относят 4 класса препаратов:
2. Дополнительные ЛС, эффективность которых также достаточно высока, но требуют уточнения некоторые вопросы показаний и противопоказаний, а также влияния этих препаратов на отдаленный прогноз больных ХСН. К дополнительным ЛС относятся:
3. Вспомогательные ЛС, применение которых необходимо в определенных конкретных клинических ситуациях:
Рассмотрим применение у больных ХСН базисных и некоторых вспомогательных (дополнительных) лекарственных препаратов. Ингибиторы АПФ По современным представлениям, ингибиторы АПФ являются “золотым стандартом” терапии больных ХСН (T. Cohn, 1988, E. Braunwald, 1991). В последние годы были получены убедительные доказательства способности ингибиторов АПФ замедлять прогрессирование ХСН, снижать летальность, улучшать прогноз и качество жизни больных ХСН. Механизм действия Механизм действия ЛС, относящихся к классу ингибиторов АПФ, связан с их способностью блокировать эффекты ключевого фермента РААС, “запускающего” целый каскад изменений в органах и тканях, которые закономерно приводят к развитию и прогрессированию СН (см. выше). При этом речь идет о действии ингибиторов АПФ как на ренально-надпочечниковую (гуморальную) РААС, так и на тканевые РАС (рис. 2.37). Последнее обстоятельство имеет особенно важное значение, поскольку активация именно тканевых нейрогормонов лежит в основе ремоделирования сердца и формирования систолической и диастолической дисфункции миокарда.
Напомним, что повышение в миокарде содержания тканевого АII сопровождается вазоконстрикцией коронарных сосудов, развитием гипертрофии миокарда, быстрым прогрессированием интерстициального фиброза, нарушением кальциевого обмена в кардиомиоцитах, что приводит к развитию диастолической ригидности миокарда и повышает риск развития аритмий. Кроме того, активация тканевых РАС в сосудистой стенке различных органов ведет к пролиферации гладкомышечных клеток, гипертрофии и утолщению стенки сосудов, а также уменьшает высвобождение эндотелиальных факторов релаксации. Повышается также агрегация тромбоцитов и риск тромбообразования, что еще больше усугубляет нарушения перфузии жизненно важных органов (сердце, головной мозг, почки).
Кроме того, воздействие ингибиторов АПФ на гуморальную (эндокринную) РААС и уменьшение образования циркулирующего АII также имеют несколько важных следствий. 1. Расширение сосудов (артериол и вен) обусловлено, прежде всего, уменьшением сосудосуживающих влияний самого АII. Однако следует помнить, что АПФ не только катализирует превращение АI в АII, но одновременно регулирует функциональное состояние калликреин-кининовой системы, являясь ферментом (кининаза II), инактивирующим один из наиболее мощных вазодилататоров организма — брадикинин (рис. 2.38). В результате подавления активности АПФ лекарственными препаратами, относящимися к его ингибиторам, увеличивается концентрация в крови брадикинина и развивается вазодилатация. Брадикинин, в свою очередь, стимулирует секрецию эндотелиальных факторов расслабления (PGI2, NO, ЭГПФ), также обладающих выраженным вазодилатирующим и антиагрегантным эффектами. В результате происходит системная артериальная вазодилатация, сопровождающаяся снижением ОПСС, системного АД и величины постнагрузки на ЛЖ. Венозная дилатация, развивающаяся под действием ингибиторов АПФ, способствует уменьшению притока крови к сердцу, снижению давления наполнения и, соответственно, величины преднагрузки. 2. Под действием ингибиторов АПФ уменьшается синтез альдостерона в надпочечниках, что сопровождается снижением альдостеронзависимой реабсорбции Nа+ и воды в дистальных канальцах почек. Одновременно уменьшается секреция ионов К+. 3. Снижая содержание циркулирующего АII, ингибиторы АПФ уменьшают ангиотензинзависимую реабсорбцию Nа+ и воды в проксимальных канальцах. Таким образом, происходящее под действием ингибиторов АПФ уменьшение задержки Nа+ и воды также ведет к уменьшению ОЦК и величины преднагрузки. 4. Наконец, ингибиторы АПФ подавляют стимулированное АII образование норадреналина и, соответственно, снижают активность САС.
Показания Лечение ингибиторами АПФ показано у большинства больных ХСН, независимо от генеза, стадии сердечной недостаточности и функционального класса ХСН. К числу наиболее частых клинических ситуаций, при которых целесообразно назначение ингибиторов АПФ (в качестве монотерапии или в комбинации с диуретиками, сердечными гликозидами и/или b-адреноблокаторами), относятся:
В настоящее время доказана эффективность ингибиторов АПФ практически у всех больных с сердечной недостаточностью, независимо от уровня активности почечно-надпочечниковой (гуморальной) РААС, в том числе при высокоренинной и низкоренинной формах ХСН. Побочные эффекты При лечении ингибиторами АПФ побочные эффекты в целом развиваются у 7–9% больных ХСН. К числу наиболее клинически значимых побочных эффектов ингибиторов АПФ относятся:
Артериальная гипотензия встречается у 4–5% больных ХСН, даже при правильном назначении ингибиторов АПФ. Наиболее часто артериальная гипотензия развивается в первые 1–3 дня от начала лечения. Следует помнить, что риск артериальной гипотензии увеличивается:
Особенно тяжелая артериальная гипотензия наблюдается у больных с высокоренинной формой ХСН с высоким содержанием циркулирующего ангиотензина II. Для этой формы заболевания характерны низкое пульсовое АД (меньше 20 мм рт. ст.), высокое ЦВД (шейные вены набухают в вертикальном положении пациента), признаки гипоперфузии периферических органов (холодные на ощупь, бледно-цианотические конечности) и гипонатриемия (меньше 130 ммоль/л), развивающаяся при длительном употреблении мочегонных средств. В этих случаях, как правило, наблюдаются выраженная систолическая дисфункция с критическим снижением сердечного выброса и ФВ, высокое давление наполнения желудочков, выраженный отечный синдром, рефрактерный к действию сердечных гликозидов, мочегонных и вазодилататоров. Единственным эффективным и патогенетически оправданным средством лечения высокоренинной формы ХСН являются ингибиторы АПФ. Однако быстрая гемодинамическая разгрузка сердца, наступающая после назначения ингибиторов АПФ в первые 1–2 дня лечения, может сопровождаться еще большим, хотя и временным, снижением СИ и выраженной артериальной гипотензией.
Ухудшение функции почек у некоторых больных ХСН (около 1,5%) на фоне лечения ингибиторами АПФ связано со свойством этих препаратов снижать уровень фильтрационного давления в клубочках вследствие значительного уменьшения тонуса выносящих артериол клубочков. Этот эффект усугубляется в связи с тем, что большинство ингибиторов АПФ выводится из организма исключительно почками. Это свойство ингибиторов АПФ используется при лечении больных сахарным диабетом и диабетической нефропатией, у которых изначально внутриклубочковое фильтрационное давление повышено. Однако в других случаях, когда скорость клубочковой фильтрации снижена менее 30 мл/ч, на фоне приема ингибиторов АПФ может увеличиваться протеинурия и азотемия. Особенно значительные нарушения функции почек, вплоть до развития тяжелой почечной недостаточности, возможны при выраженных стенозах почечных артерий, у которых по понятным причинам уровень исходного фильтрационного давления и скорость фильтрации очень низкие. Риск ухудшения функции почек возрастает также у лиц старше 70 лет, у пациентов с низкими значениями ФВ и СИ и при одновременном приеме диуретиков.
Следует подчеркнуть, что начальные стадии ХПН с уровнем креатинина не выше 265 мкмоль/л и систолическим давлением больше 90 мм рт. ст. не являются абсолютным противопоказанием для лечения ингибиторами АПФ. Ангионевротический отек является редким, но наиболее грозным осложнением лечения ингибиторами АПФ. Он возникает в результате аллергической реакции, в основе которой лежит высокая концентрация брадикинина, сопровождающая лечение данными препаратами (см. выше). При развитии отека языка, гортани, глотки следует немедленно ввести адреналин и прекратить прием ингибиторов АПФ. Гиперкалиемия может развиться при применении любых ингибиторов АПФ, вызывающих, как известно, задержку ионов К+ в организме. Это следует учитывать при выборе диуретической терапии, если она применяется в комбинации с ингибиторами АПФ. Прием ингибиторов АПФ нельзя сочетать с применением калийсберегающих диуретиков (триампур, верошпирон) или препаратов калия. Риск развития гиперкалиемии возрастает у больных ХСН старческого возраста в связи со снижением у них функции почек, а также при сахарном диабете, гиперальдостеронизме и применении НПВС. Сухой кашель является самым частым побочным эффектом лечения ингибиторами АПФ. Он появляется обычно через несколько недель от начала лечения. Кашель при приеме этих препаратов обусловлен высоким уровнем брадикинина, субстанции Р и простагландинов, которые, воздействуя, в частности, на кининовые рецепторы, богато представленные в легких, вызывают кашлевой рефлекс. Нередко упорный сухой кашель является причиной отмены ингибиторов АПФ. Применение ингибиторов АПФ При лечении больных ХСН ингибиторами АПФ следует придерживаться некоторых общих принципов, рекомендованных Европейским обществом кардиологов (1997). 1. Отменить диуретики, как минимум, за 24 ч до применения ингибитора АПФ. 2. В течение 2–3-х часов после первого приема ингибиторов АПФ необходимо врачебное наблюдение (контроль АД, риск возникновения ангионевротического отека гортани и др.). 3. Лечение ингибиторами АПФ следует начинать с минимальной дозы препарата. 4. На начальном этапе лечения или при увеличении дозы препарата через 3–5 дней следует контролировать функцию почек (креатинин сыворотки крови, относительная плотность мочи, диурез и др. показатели) и содержание электролитов крови (К+, Nа+). В дальнейшем контроль проводится каждые 3 и 6 мес. 5. Прием ингибиторов АПФ нельзя сочетать с применением калийсберегающих диуретиков, препаратов калия и НПВС. Следует учитывать также рекомендации, приведенные выше. В табл. 2.11. представлены ориентировочные начальные и поддерживающие дозы наиболее часто используемых в России ингибиторов АПФ. Таблица 2.11 Начальная и поддерживающая дозы ингибиторов АПФ при лечении больных с хронической сердечной недостаточностью
Противопоказания Применение ингибиторов АПФ противопоказано при следующих состояниях. 1. Беременность. 2. Индивидуальная непереносимость препарата. 3. Двусторонний или выраженный односторонний стеноз почечных артерий. 4. Выраженная исходная артериальная гипотензия (САД ниже 85–90 мм рт. ст.). 5. Выраженное снижение функции почек с азотемией. 6. Аортальный стеноз, митральный стеноз, ГКМП (обструктивный вариант).
Диуретики Диуретики — это ЛС, которые оказывают избирательное действие на почки, вследствие чего угнетается реабсорбция Nа+ и/или воды в канальцах и усиливается диурез. Диуретики издавна применяются для лечения больных ХСН. Их эффективность при сердечной декомпенсации связана главным образом с уменьшением ОЦК, снижением ОПСС и притока крови к сердцу и, следовательно, величины пред- и постнагрузки. Таким образом, под влиянием диуретиков происходит преимущественно гемодинамическая разгрузка сердца. Диуретики следует рассматривать как симптоматическое средство, которое целесообразно использовать только при наличии клинических признаков избыточной задержки жидкости в организме или для профилактики отечного синдрома после его устранения. К сожалению, большинство мочегонных препаратов, несмотря на клиническую эффективность и незбежность их применения у многих больных ХСН с застоем крови в легких и отечным синдромом, оказывают значительное влияние на активность нейрогуморальных систем, ответственных за прогрессирование ХСН (см. выше). Речь идет о рефлекторном увеличении под действием диуретиков активности ренина, повышении уровня ангиотензина II, концентрации альдостерона и катехоламинов. Такая рефлекторная реакция связана главным образом со снижением под влиянием диуретиков ОЦК. Поэтому диуретические ЛС, по меньшей мере, не следует применять у больных ХСН в качестве монотерапии; во всех случаях их целесообразно сочетать с ингибиторами АПФ, b-адреноблокаторами или сердечными гликозидами. Механизм действия В зависимости от локализации и механизма действия различают 4 группы диуретиков (рис. 2.39). 1. Диуретики, действующие на проксимальные извитые канальцы нефрона (ингибиторы карбоангидразы и осмотические диуретики). 2. Петлевые диуретики (фуросемид, буметанид, этакриновая кислота). 3. Диуретики, действующие преимущественно в области дистальных извитых канальцев (тиазидные и нетиазидные производные сульфаниламидов). 4. Диуретики, действующие в области собирательных трубок:
Для лучшего понимания механизмов действия различных диуретических средств необходимо вспомнить, как осуществляется реабсорбция Nа+, К+, Сl– и воды в почечных канальцах. Около 70% профильтровавшихся в клубочках ионов Na+, K+, Сl–, фосфатов, мочевины, бикарбонатов, глюкозы, аминокислот и других веществ реабсорбируются в проксимальных извитых почечных канальцах. Здесь же всасывается осмотически эквивалентное количество воды, поэтому канальцевая жидкость в этом отделе сохраняет изоосмию по отношению к плазме, т.е. моча не концентрируется и не разводится. Это так называемая облигатная (обязательная) реабсорбция воды и осмотически активных веществ, которая не зависит от потребностей организма (рис. 2.40, а). В нисходящем тонком сегменте петли Генле, проницаемом только для воды, под действием вертикального концентрационного градиента, существующего в ткани нормально функционирующей почки, происходит пассивная реабсорбция воды из просвета канальца в интерстициальную ткань почек. В восходящем тонком сегменте петли Генле, также проницаемом только для воды, канальцевая жидкость движется по направлению к наружной зоне мозгового вещества, где концентрация осмотически активных веществ ниже, чем у поворота петли. Поэтому вода здесь вновь частично поступает из интерстициальной ткани почки в просвет канальца (рис. 2.40, б). Восходящий толстый отдел петли Генле непроницаем для воды и проницаем для Na+. Здесь продолжается реабсорбция Na+, но уже без эквивалентного количества воды, как в проксимальном канальце. Поэтому концентрация канальцевой жидкости снижается, происходит ее разведение (рис. 2.40, в). Наконец, в дистальных извитых канальцах и собирательных трубках происходит факультативная реабсорбция Na+, воды и мочевины, интенсивность которой прямо зависит от потребностей организма: при этом всасывание воды и мочевины регулируется антидиуретическим гормоном (АДГ), а Na+ — альдостероном (рис. 2.40, в).
На рис. 2.41 схематически показана динамика реабсорбции Nа+ и воды в различных сегментах нефрона: проксимальных и дистальных канальцах, петле Генле и собирательных трубках. Максимальная реабсорбция приходится на проксимальные канальцы (облигатная реабсорбция) и петлю Генле (восхоящий толстый сегмент), минимальная — на собирательные трубки и дистальные извитые канальцы (факультативная реабсорбция). Большинство диуретиков угнетают активную реабсорбцию Nа+, Сl–, бикарбонатов, Са2+, что влечет за собой уменьшение пассивной реабсорбции воды и увеличение диуреза. 1. Осмотические диуретики. Действие осмотических диуретиков (маннитола, мочевины, 40% раствора глюкозы, альбумина и др.) основано на повышении концентрации осмотически активных веществ в плазме крови и в канальцевой жидкости. В результате снижается интенсивность обязательной реабсорбции осмотически активных веществ в проксимальных отделах канальцев и, соответственно, увеличивается количество и скорость движения канальцевой жидкости в петле Генле и в дистальных отделах канальцев. Это, в свою очередь, препятствует образованию осмотического градиента и ведет к снижению факультативной реабсорбции воды в дистальных канальцах и собирательных трубках. Такое состояние называется осмотическим диурезом.
Ингибиторы карбоангидразы. Диакарб, относящийся к этой группе диуретиков, угнетает действие фермента карбоангидразы. Последняя, как известно, обеспечивает в проксимальных извитых канальцах почек реабсорбцию натрия бикарбоната (NаHСО3) в обмен на выделение в просвет канальца ионов Н+ (рис. 2.42). В основе этого процесса лежит активируемая карбоангидразой реакция: СО2 + Н2О = = Н2СО3; образующаяся углекислота (Н2СО3) диссоциирует на ионы Н+ и HСО3–. Ионы Н+ выделяются в просвет канальцев, а на их место из канальцевой жидкости поступает эквивалентное количество ионов натрия (Nа+). В результате организм освобождается от водородных ионов и в то же время восполняет запасы натрия бикарбоната (NaHCO3), который реабсорбируется в интерстициальную ткань почки и попадает в кровь. Аналогичным образом происходит обмен ионов Н+ на ионы Nа+ с участием двухосновного фосфата и аммиака (подробнее см. последующие главы руководства). Прием диакарба угнетает эту реакцию: ионы Nа+ выводятся из организма, а ионы Н+ накапливаются в интерстициальной ткани, что, кстати, может способствовать возникновению метаболического ацидоза. Диакарб относится к слабым диуретикам. Его действие усиливается при метаболическом алкалозе, но значительно снижается при его отсутствии. Поэтому диакарб редко применяют при ХСН и только с целью быстрой коррекции метаболического алкалоза, вызванного, например, избыточным назначением петлевых или тиазидных мочегонных (см. ниже).
Петлевые диуретики. К этой группе диуретиков относятся:
Петлевые диуретики — наиболее эффективные мочегонные средства, которые подавляют активную реабсорбцию Сl– и Nа+ в толстом восходящем сегменте петли Генле (рис. 2.43). Именно здесь реабсорбируется около 25–30% профильтровавшихся ионов Nа+. Одновременно происходит значительная потеря ионов К+ с мочой. Петлевые диуретики широко используют как при острой, так и при хронической СН. Они эффективны даже при значительном снижении скорости клубочковой фильтрации (менее 30 мл/мин). Помимо мощного диуретического действия, петлевые мочегонные средства при внутривенном введении оказывают отчетливый и быстрый венодилатирующий эффект и снижают преднагрузку еще до наступления диуретического действия. Это свойство петлевых диуретиков ипользуется при лечении больных с отеком легких.
В этих случаях фуросемид вводят внутривенно медленно (со скоростью не более 4–6 мг в мин). Начальная доза составляет от 20 мг до 60 мг; при необходимости доза может быть увеличена до 160–500 мг в сутки. Повторные внутривенные инъекции возможны каждые 4–6 ч. При ХСН фуросемид, этакриновую кислоты (урегит) или буметанид обычно применяют внутрь один раз в сутки (утром). Натрийуретическое и диуретическое действие обычно начинается через 30–60 мин после приема препарата и достигает максимума через 1–2 ч. Длительность действия составляет около 6 ч. В зависимости от тяжести отечного синдрома и выраженности диуретического эффекта суточные дозы петлевых диуретиков могут колебаться в широких пределах. Обычно фуросемид используют в дозе 40–80 мг в сутки, этакриновую кислоту — 50–100 мг в сутки и буметанид — 0,5–2,0 мг в сутки. 4. Тиазиды и тиазидоподобные диуретики. Мочегонные этой группы являются производными сульфаниламидов и воздействуют на дистальные отделы канальцев, ингибируя фосфодиэстеразу и усиливая выделение с мочой Nа+, К+, Сl–, гидрокарбонатов, фосфатов и магния. Наиболее распространенными представителями этой группы мочегонных средств являются гидрохлортиазид, индапамид и клопамид. Эффективность тиазидовых и тиазидоподобных диуретиков существенно меньше, чем петлевых диуретиков. Эффект мочегонных препаратов этой группы значительно уменьшается при снижении скорости клубочковой фильтрации меньше 40 мл/мин и прекращается при значениях меньше 30 мл/мин. Большинство диуретиков этой группы обладают гипотензивным эффектом. Лечение больных с начальной и умеренной ХСН и слабо выраженным отечным синдромом начинают с назначения гидрохлортиазида в дозе 25–100 мг в сутки один раз (утром натощак). Максимальный эффект достигается через 1 ч после приема, длительность действия — 12 ч. При необходимости суточная доза может быть увеличена до 200 мг в сутки и распределена на 1–2 приема. При этом значительно возрастает риск возникновения побочных эффектов (гипокалиемии, артериальной гипотензии). Противопоказания:
5. Калийсберегающие диуретики. Эти мочегонные средства (спиронолактон, амилорид и триамтерен) угнетают реабсорбцию Nа+ и секрецию К+ в собирательных трубках, в связи с чем на фоне увеличения диуреза не развивается гипокалиемии (рис. 2.44). Спиронолактон (верошпирон) обладает уникальной способностью ингибировать альдостерон. Калийсберегающие диуретики обладают слабым мочегонным действием. Обычно их назначают в сочетании с петлевыми и тиазидовыми диуретиками с целью снижения риска возникновения гипокалиемии. Спиронолактон (верошпирон) применяют для профилактики и лечения гипокалиемии, развившейся при лечении петлевыми и тиазидовыми диуретиками, а также в комплексной терапии гиперальдостеронизма, в том числе у больных ХСН. Спиронолактон назначают в дозе 75–100 мг в сутки в течение 2–8 недель. Слабо выраженный мочегонный эффект начинает проявляться только через 48–72 ч после приема препарата, хотя уже через сутки уровень калия сыворотки начинает возрастать. В последние годы спиронолактон пытаются использовать в качестве средства, предупреждающего развитие интерстициального фиброза миокарда и ремоделирования сосудов, обусловленного повышенным содержанием альдостерона у больных ХСН. При этом используют длительный прием сравнительно низких доз препарата (75 мг в сутки).
Триамтерен применяют в дозе 50–100 мг (в 2 приема) в качестве калийсберегающего средства и 200–300 мг в сутки — с целью получить слабый мочегонный эффект. При приеме триамтерена диуретический эффект начинается через 2–4 ч и продолжается 7–12 ч. В клинической практике нередко используют комбинированный препарат — триампур композитум, в состав которого входят 25 мг триамтерена и 12,5 мг гидрохлортиазида. Амилорид применяют в суточной дозе 5–20 мг в сутки, начало действия — через 2–3 ч после приема. Его длительность достигает 12–24 ч. Калийсберегающие диуретики противопоказаны при:
В табл. 2.12. суммированы некоторые сведения о фармакодинамике диуретиков. Выбор диуретиков и общая тактика лечения Индивидуальный выбор диуретиков при ХСН определяется многими факторами:
Таблица 2.12 Суточные дозы и время действия диуретиков при лечении больных ХСН
Примечания: * — диакарб принимают по 250 мг 1 раз в сутки в течение 2–5 дней, затем — перерыв 2–3 дня; ** — при сочетании с другими диуретиками дозу уменьшают в 2 раза; *** — начальную дозу триамтерена (150–200 мг/сутки) принимают за 2 приема в течение первой половины дня. Начальные стадии ХСН (ФК I), как правило, не требуют лечения диуретиками. При умеренной ХСН (ФК II, иногда — ФК III) и сохраненной функции почек (скорость фильтрации более 30 мл/мин) целесообразно назначать тиазидовые или тиазидоподобные диуретики, особенно при сочетании ХСН и АГ. Прогрессирование ХСН (ФК III–IV) и отечного синдрома, как правило, требует применения более мощных петлевых диуретиков (фуросемида, этакриновой кислоты, буметанида). При назначении диуретиков больным с выраженным отечным синдромом нередко вначале необходимо создать так называемый форсированный диурез, когда количество выделяемой мочи существенно (на 600–800 мл в сутки) превышает объем потребляемой жидкости. При этом часть мочегонных препаратов целесообразно вводить внутривенно. Такое лечение требует ежедневного измерения диуреза, исследования электролитов крови, а также определения массы тела (МТ). Последняя на фоне оптимально подобранных доз диуретиков должна снижаться на 500–700 г в сутки. После достижения желаемого эффекта переходят на поддерживающую терапию. В этот период следует подобрать такую дозу диуретика, чтобы количество выделенной за сутки мочи было по крайней мере не меньше количества выпитой жидкости, а МТ оставалась стабильной.
Следует помнить, что при лечении мочегонными средствами как в фазе форсированного диуреза, так и во время поддерживающей терапии, всегда полезной оказывается комбинация диуретиков с различным механизмом и локализацией действия. Это позволяет расширить зону блокады реабсорбции Nа+ в канальцах почек и одновременно повысить эффективность каждого из диуретиков. Например, назначение петлевых диуретиков, блокирующих реабсорбцию натрия в восходящем толстом сегменте петли Генле, приводит к увеличению концентрации ионов Nа+ в содержимом дистальных извитых канальцев (рис. 2.45.б). Такая “загрузка” ионами Nа+ (т.е. субстратом для действия диуретиков) сопровождается повышением эффективности тиазидовых мочегонных, блокирующих реабсорбцию на уровне дистальных извитых канальцев. В свою очередь, применение петлевых и тиазидовых мочегонных сопровождается “загрузкой” ионами Nа+ собирательных трубочек, где действуют антагонисты альдостерона. В результате повышается эффективность и этих диуретиков (рис. 2.45, в). Иными словами, назначение любого мочегонного препарата, действующего на более проксимальные участки нефрона, усиливает эффективность диуретиков, “работающих” на более дистальных его участках. Это позволяет существенно уменьшить суточные дозы каждого из мочегонных и снизить, таким образом, риск возникновения побочных эффектов. В клинике наиболее часто используют комбинацию фуросемида с гидрохлортиазидом или фуросемида, гидрохлортиазида и спиронолактона (верошпирона).
Следует помнить, что при применении петлевых, тиазидовых и калийсберегающих диуретиков достаточно быстро (через 1,5–2 недели лечения) развивается более или менее выраженный метаболический алкалоз, что снижает действие тиазидовых и петлевых диуретиков. В этих случаях целесообразно один раз в 2 недели на 3–4 дня дополнительно назначать прием ингибитора карбоангидразы — ацетазоламида (диакарба), который “подкисляет” мочу и восстанавливает эффективность действия петлевых и тиазидовых диуретиков. Длительное лечение мочегонными средствами больных ХСН должно сочетаться с назначением ингибиторов АПФ, которые не только нивелируют побочные эффекты диуретиков (гипокалиемии, рефлекторной активации РААС и др.), но и потенцируют и усиливают эффекты друг друга. Следует помнить, что во многих случаях назначение ингибиторов АПФ сравнительно быстро приводит к уменьшению или исчезновению клинических проявлений отечного синдрома. Побочные эффекты Лечение диуретиками всегда сопряжено с риском возникновения серьезных побочных эффектов этих препаратов, многие из которых приводят к заметному уменьшению эффективности терапии больных ХСН, нарастанию симптомов сердечной недостаточности и (при отсутствии соответствующего лечения) — к развитию ряда тяжелых осложнений (артериальная гипотензия, нарушения сердечного ритма, внезапная сердечная смерть). Основными побочными эффектами, развивающимися при лечении больных ХСН диуретиками, являются: 1. Артериальная (в том числе ортостатическая) гипотензия. 2. Электролитные нарушения:
3. Нарушения кислотно-щелочного состояния (равновесия):
4. Снижение функции почек. 5. Метаболические нарушения:
Гипокалиемия — это снижение содержания калия в плазме крови ниже 3,4 ммоль/л. Гипокалиемия чаще развивается при применении тиазидовых и петлевых диуретиков. Клинические проявления гипокалиемии не всегда характерны. Может появляться мышечная слабость, апатия, одышка, склонность к брадикардии или тахикардии, нарушениям сердечного ритма и т.п. На ЭКГ выявляются характерные изменения конечной части желудочкового комплекса: горизонтальное смещение сегмента RS–T ниже изолинии, уменьшение амплитуды зубца Т или формирование двухфазного (–+) или отрицательного зубца Т, а также удлинение электрической систолы желудочков — интервала Q–T (рис. 2.46).
Лечение гипокалиемии, развившейся на фоне применения диуретиков, включает несколько принципиальных моментов. 1. Отмена (по крайней мере, временная) петлевых и тиазидовых диуретиков и других препаратов, способствующих развитию гипокалиемии (сердечные гликозиды и др.). 2. Назначение калиевой диеты (см. выше), что в большинстве случаев позволяет скорректировать нарушения содержания К+, если оно находилось в пределах 3,2–3,4 ммоль/л. 3. Назначение препаратов калия, которые следует использовать при исходной концентрации К+ ниже 3,2 ммоль/л:
Гипомагниемия диагностируется при снижении содержания магния в сыворотке крови ниже 0,7 ммоль/л. Гипомагниемия чаще развивается при лечении петлевыми и тиазидовыми мочегонными. В клинической картине преобладают судороги отдельных мышц, ларингоспазм, бронхоспазм, тахикардия, экстрасистолия, парестезии, заторможенность, галлюцинации. Гипомагниемия обычно сочетается с гипокалиемией. Лечение гипомагниемии включает следующие мероприятия. 1. Отмена (временная) петлевых и тиазидовых диуретиков, сердечных гликозидов и др. 2. Назначение магниевой диеты (см. выше). 3. Назначение панангина или аспаркама по 2 табл. 4 раза в день. 4. В тяжелых случаях — внутривенное капельное введение (медленно в течение 3 ч) 6 г магния сульфата в 1 л 5% раствора глюкозы (контроль за АД и дыханием!). 5. Внутримышечное введение 10 мл 25% раствора магния сульфата 2–4 раза в сутки (контроль АД!). 6. Дополнительное назначение калийсберегающих диуретиков. Гипокальциемия диагностируется при снижении концентрации кальция в сыворотке крови ниже 2,1 ммоль/л. Чаще она развивается при применении петлевых диуретиков. Наиболее ярким клиническим проявлением гипокальциемии являются спонтанные сокращения мышц — судороги, возникающие вследствие резкого повышения возбудимости мышечных и нервных клеток. При тяжелой гипокальциемии может наступить смерть от остановки дыхания. На ЭКГ при гипокальциемии обнаруживают удлинение электрической систолы желудочков (интервала Q–T), а также снижение амплитуды зубца Т и некоторое укорочение интервала P–Q(R) (см. рис. 2.46). Лечение: 1. Отмена петлевых диуретиков. 2. Назначение кальциевой диеты: молочные продукты, салаты, капуста и др. 3. Назначение внутрь препаратов кальция. 4. В тяжелых случаях внутривенное введение препаратов кальция. Гиперкалиемия развивается при применении калийсберегающих диуретиков, особенно на фоне заболеваний, сопровождающихся склонностью к гиперкалиемии (ХПН). Гиперкалиемия диагностируется при повышении содержания К+ в сыворотке крови выше 5,3 ммоль/л. Клинические проявления. Основное физиологическое действие калия — это обеспечение электрического потенциала клетки. Калий поддерживает также осмотический и кислотно-основной гомеостаз в клетке, участвует в синтезе белка, гликогена, АТФ, КФ, фосфорилировании глюкозы и других биохимических процессах. Повышение содержания калия в плазме крови до 6 ммоль/л обычно не сопровождается клиническими симптомами. На ЭКГ при умеренной гиперкалиемии можно обнаружить высокие, узкие заостренные положительные зубцы Т и укорочение электрической систолы желудочков — интервала Q–T (см. рис. 2.46). Более выраженная гиперкалиемия (6,0–7,3 ммоль/л) сопровождается повышением возбудимости клеток: развиваются парестезии, парезы, мышечные параличи, нарушения сердечного ритма (брадикардия или тахикардия), замедление атриовентрикулярной и внутрижелудочковой проводимости. При повышении концентрации калия в плазме до 7,5 ммоль/л и выше клеточный потенциал покоя становится равным потенциалу действия, вследствие чего клетки полностью теряют возбудимость. В этих условиях может развиться остановка сердца. Лечение гиперкалиемии включает следующие мероприятия. 1. Отмена калийсберегающих диуретиков, а также ингибиторов АПФ или уменьшение их дозировок. 2. Внутривенное введение 20 мл 10% раствора натрия хлорида или 40 мл 40% раствора глюкозы. 3. Лечение заболеваний, сопровождающихся задержкой К+ в организме (ХПН). Гипонатриемия — это снижение уровня Nа+ в плазме крови ниже 135 ммоль/л. Абсолютная гипонатриемия (гипонатриемия “истощения”) развивается при применении больших доз мочегонных препаратов, особенно петлевых диуретиков. В результате происходит уменьшение ОЦК и притока крови к сердцу. Развивающаяся гиповолемия сопровождается чрезмерным снижением давления наполнения, сердечного выброса (СИ) и клубочковой фильтрации. Клинические проявления. У больных с гипонатриемией появляется выраженная общая слабость, сонливость, мышечные судороги, олигурия. При физикальном исследовании определяется снижение тургора кожи, артериальная гипотензия, тахикардия, артериальный пульс малого наполнения и напряжения. Вследствие уменьшения притока крови к сердцу и величины ЦВД исчезает имевшееся ранее набухание шейных вен. Содержание Nа+ в плазме — на уровне нижней границы нормы или меньше 135 ммоль/л. Отмечается повышение гематокрита, азотемия, хотя относительная плотность мочи при этом повышена. Лечение: 1. Временно отменить диуретики. 2. Временно увеличить поступление соли с пищей. 3. В тяжелых случаях — внутривенные капельные инфузии 10% раствора натрия хлорида. Абсолютную гипонатриемию (“истощения”) следует отличать от относительной гипонатриемии (гипонатриемии “разведения”). В этих случаях избыточный диурез отсутствует, сохраняются все признаки задержки воды в организме, что объясняется характерной для многих больных ХСН гиперсекрецией АДГ, а также высоким содержанием ангиотензина II. Больные жалуются на общую слабость, жажду. Сохраняются массивные отеки, набухание шейных вен, снижается содержание Nа+ в плазме крови и уменьшается относительная плотность мочи. Лечение: 1. Резкое ограничение приема жидкости (не более 750–800 мл в сутки). 2. Применение петлевых диуретиков, желательно в сочетании с приемом ингибиторов АПФ. Клиническая картина и методы коррекции метаболического алкалоза и ацидоза, развивающихся, в частности, при длительном приеме диуретиков или сердечных гликозидов, подробно описаны в последующих главах руководства. В табл. 2.13. представлены основные побочные эффекты, развивающиеся при лечении диуретиками. Таблица 2.13 Основные побочные эффекты при лечении диуретиками различных классов
Примечание: + наличие побочного эффекта; – его отсутствие Противопоказания Основные противопоказания к использованию диуретиков различных классов представлены в табл. 2.14. Сердечные гликозиды Сердечные гликозиды — это лекарственные средства, получаемые из некоторых растений (наперстянка, ландыш и др.) и обладающие сходной химической структурой, главной отличительной чертой которых является положительный инотропный эффект — увеличение сократимости миокарда. Сердечные гликозиды успешно используются для лечения больных ХСН более 200 лет. В большинстве случаев сердечные гликозиды существенно улучшают качество жизни больных ХСН: уменьшают выраженность клинических проявлений сердечной декомпенсации, снижают число госпитализаций в связи с обострениями ХСН, повышают толерантность больных к физической нагрузке и т.п. Тем не менее, в отличие от ингибиторов АПФ и b-адреноблокаторов, они практически не влияют на прогноз заболевания (летальность и выживаемость больных). В последние годы сущестьвенно изменились представления о механизмах действия и основных принципах применения сердечных гликозидов, а также о месте гликозидотерапии в комплексном лечении больных ХСН. Если раньше, около 15–20 лет назад, сердечные гликозиды считались основным (если не единственным) средством лечения почти всех больных ХСН, причем их эффекты связывались исключительно с положительным инотропным действием этих препаратов, то в настоящее время отношение к использованию сердечных гликозидов при ХСН стало более осторожным и дифференцированным. Таблица 2.14 Основные противопоказания к назначению диуретиков различных классов
Например, у больных ХСН с мерцательной аритмией сердечные гликозиды продолжают оставаться средством первого выбора, тогда как у пациентов с ИБС, постинфарктным кардиосклерозом и сохраненным синусовым ритмом следует особо учитывать возможные отрицательные эффекты сердечных гликозидов: увеличение потребности миокарда в кислороде и гипоксию сердечной мышцы, возникновение серьезных нарушений ритма и проводимости, гликозидную интоксикацию и т.д. Наконец, существует значительная группа больных ХСН с преимущественно диастолической дисфункцией ЛЖ, у которых применение сердечных гликозидов противопоказано. Механизмы действия Эффективность сердечных гликозидов при ХСН объясняется наличием нескольких различных механизмов действия, каждый из которых может иметь решающее значение в разных клинических ситуациях:
1. Положительное инотропное действие сердечных гликозидов связано с угнетением К+-Nа+-зависимой АТФ-азы кардиомиоцитов. Как известно, К+-Nа+-насос обеспечивает высокие градиенты концентрации ионов Nа+ и К+ по обе стороны клеточной мембраны (сарколеммы): внутри клетки создается высокая концентрация ионов К+, а вне клетки — ионов Nа+. Низкое содержание внутриклеточного Nа+, создаваемое К+-Nа+-насосом, приводит к перемещению в клетку по электрохимическому градиенту ионов Nа+, обменивающихся на ионы Са2+, которые выходят из клетки против градиента концентрации (рис. 2.47, а).
Таким образом, источником энергии для выведения Са2+ из кардиомиоцита является электрохимический градиент Nа+, создаваемый работой К+-Nа+-насоса. Чем эффективнее “работает” К+-Nа+-насос, тем больше ионов Са2+ удаляется из клетки согласно Nа+-Са2+-обменному механизму. Сердечные гликозиды прежде всего угнетают деятельность К+-Nа+-насоса, в связи с чем внутри клетки возрастает концентрация Nа+. В результате снижается интенсивность Nа+-Са2+-обменного механизма, и часть ионов Са2+ остается в цитоплазме кардиомиоцита (рис. 2.47, б). Поскольку уровень инотропизма определяется главным образом внутриклеточной концентрацией ионов Са2+, сократимость миокарда при воздействии сердечных гликозидов возрастает. 2. Отрицательное хронотропное действие сердечных гликозидов характеризуется уменьшением ЧСС за счет снижения автоматизма СА-узла. Этот эффект связывают с прямыми нейромодуляторными свойствами сердечных гликозидов, способных блокировать образование периферических симпатических импульсов и усиливать вагусные влияния. 3. Отрицательное дромотропное действие сердечных гликозидов заключается в замедлении проведения электрических импульсов в АВ-соединении при сохранении проводимости в ножках и ветвях пучка Гиса. Этот эффект связывают с увеличением продолжительности эффективного рефрактерного периода АВ-узла, возникающим в результате уменьшения активности САС и повышения тонуса парасимпатической нервной системы. Отрицательный дромотропный эффект сердечных гликозидов лучше всего проявляется у больных с тахисистолической формой фибрилляции предсердий, а также при пароксизмах наджелудочковой тахикардии или тахиаритмии. В этих случаях увеличение длительности эффективного рефрактерного периода АВ-узла способствует тому, что далеко не все суправентрикулярные импульсы проводятся к желудочкам. В результате уменьшается ЧСС, удлиняется диастола, снижается внутримиокардиальное напряжение и улучшается внутрисердечная и системная гемодинамика. В то же время следует учитывать, что у больных с исходным нарушением АВ-проводимости сердечные гликозиды могут вызывать возникновение или усугубление АВ-блокад, вплоть до развития полной АВ-блокады. При синдроме WPW сердечные гликозиды, замедляя АВ-проводимость, могут способствовать проведению импульсов из предсердия в желудочки по дополнительным аномальным проводящим путям и провоцируют возникновение пароксизмальной тахикардии.
Показания Применение сердечных гликозидов у больных ХСН показано в следующих клинических ситуациях (Б.А. Сидоренко и В.Ю. Мареев). 1. У больных ХСН ФК II–IV (по NYHA) с тахисистолической формой фибрилляции предсердий и признаками систолической дисфункции ЛЖ (ФВ менее 40%) (абсолютные показания). В этих случаях клинические эффекты сердечных гликозидов обусловлены преимущественно отрицательным дромотропным и хронотропным действием гликозидов, т.е. замедлением АВ-проводимости и уменьшением ЧСС за счет усиления тонуса парасимпатической нервной системы, тогда как положительное инотропное действие выражено в слабой степени. 2. У больных ХСН ФК II–IV (по NYHA) с сохраненным синусовым ритмом, признаками систолической дисфункции ЛЖ (ФВ менее 40%) и наличием протодиастолического ритма галопа и/или дилатации левого желудочка. В этих случаях отрицательные хронотропный и дромотропный эффекты сердечных гликозидов выражены в меньшей степени, чем при фибрилляции предсердий. Преобладает их положительное инотропное действие, которое сопровождается не только повышением сократимости миокарда и ФВ ЛЖ, но и значительным увеличением потребности миокарда в кислороде и возможным ухудшением коронарной перфузии ЛЖ, что следует учитывать при назначении сердечных гликозидов больным ИБС (на фоне синусового ритма). 3. У больных с пароксизмальной наджелудочковой тахиаритмией (фибрилляция и трепетание предсердий, пароксизмальная наджелудочковая тахикардия), независимо от наличия или отсутствия у них признаков ХСН (внутривенные инъекции или инфузии сердечных гликозидов).
Противопоказания Применение сердечных гликозидов абсолютно противопоказано в нескольких клинических ситуациях:
Вместе с тем существует целый ряд клинических ситуаций, при которых прием сердечных гликозидов требует особой осторожности в связи с высоким риском развития побочных реакций (относительные противопоказания) или нецелесообразен из-за отсутствия заметного клинического эффекта. Перечень подобных клинических ситуаций представлен в табл. 2.15. Кроме того, следует помнить, что у больных с сопутствующей почечной недостаточностью применение сердечных гликозидов, хотя и возможно, но требует снижения дозы препарата в связи с нарушением экскреции гликозидов и повышением риска гликозидной интоксикации. У больных с гипотиреозом возрастает чувствительность миокарда к действию сердечных гликозидов, быстрее происходит насыщение препаратами и в связи с этим повышен риск возникновения гликозидной интоксикации. Методика лечения В основе современной концепции применения сердечных гликозидов у больных ХСН лежит требование безопасности лечения и снижения риска гликозидной интоксикации и аритмий. Поэтому первый и основной принцип длительного лечения больных ХСН сердечными гликозидами — это применение малых доз препарата (например, дигоксина в дозе до 0,25 мг в сутки). Доказано, что более высокие дозировки сердечных гликозидов значительно увеличивают риск развития наджелудочковых и желудочковых, в том числе жизнеопасных, аритмий и гликозидной интоксикации. То же относится к тактике подбора доз на начальном этапе лечения. Таблица 2.15 Клинические ситуации, при которых применение сердечных гликозидов (СГ) противопоказано или нецелесоообразно
Еще недавно такая тактика предусматривала несколько вариантов достижения так называемой средней насыщающей (полной) дозы сердечных гликозидов, т.е. такой дозы, при которой создается максимальная концентрация препарата в крови и достигается максимальное инотропное действие гликозида, не сопровождающееся признаками гликозидной интоксикации. В дальнейшем предлагалось переходить на поддерживающие дозы гликозидов. В настоящее время в клинике практически не применяется методика быстрого насыщения сердечными гликозидами, когда средняя насыщающая доза препарата (например, для внутривенно вводимого дигоксина — 1,4 мг) вводится в течение первых суток лечения (дробно). Такая методика чрезвычайно опасна из-за частого возникновения признаков гликозидной интоксикации и нарушений ритма и проводимости. Методика умеренно быстрого насыщения также используется достаточно редко и только при тяжелых обострениях систолической ХСН. Она заключается в том, что средняя насыщающая доза дигоксина вводится в течение 3-х суток, к концу которых обычно наступает терапевтический эффект. Например, чтобы в течение 3-х суток достичь средней насыщающей дозы дигоксина (1,4 мг), в первые сутки препарат вводят внутривенно в дозе 0,75 мг, разделенной на 2 приема (например, 0,5 мг и 0,25 мг). Учитывая, что суточная экскреция дигоксина составляет 33%, то количество препарата, оставшегося в организме к концу первых суток, составит: 0,75 мг ґ 0,67 = 0,5 мг. На вторые сутки внутривенно вновь вводят 0,75 мг дигоксина. Тогда количество препарата в организме больного достигнет: 0,5 мг + 0,75 мг = 1,25 мг. К концу 2-х суток количество дигоксина в организме составит 1,25 ґ 0,67 = 0,84 мг. На 3-й день внутривенно вводят 0,55 мг дигоксина, что вместе с оставшимися после 2-х суток 0,84 мг препарата составит 1,4 мг дигоксина. Это количество соответствует средней насыщающей дозе дигоксина для внутривенного введения. В последующем, чтобы поддерживать именно такое содержание гликозида в крови, требуется ежедневное введение поддерживающей дозы не более 0,46 мг дигоксина в сутки. Однако в настоящее время убедительно доказано, что уже при достижении так называемой оптимальной насыщающей концентрации гликозидов в крови (около 2,0 мг/мл) и сохранении ее в течение длительного времени с помощью приема поддерживающих доз препарата, смертность больных ХСН возрастает примерно в 2 раза. Поэтому в настоящее время в клиниках не стремятся достичь рекомендуемых в справочной литературе средних насыщающих доз сердечных гликозидов, а с первого дня лечения назначают поддерживающие дозы препарата, ориентируясь при этом на минимальные их значения (методика медленного насыщения). Для дигоксина, назначаемого внутрь, поддерживающая доза составляет 0,25 мг (1 таблетка) или (редко) — 0,5 мг (2 таблетки). При ежедневном приеме 0,25 мг дигоксина насыщающая доза (0,75 мг) достигается на 11-е сутки лечения (рис. 2.48). Этого обычно бывает вполне достаточно для получения удовлетворительного терапевтического эффекта.
При необходимости внутривенного введения сердечных гликозидов, например, у больных с тяжелой сердечной декомпенсацией и выраженным снижением систолической функции ЛЖ или у пациентов с наджелудочковыми нарушениями ритма (фибрилляция предсердий, пароксизмальная наджелудочковая тахикардия) назначают:
Внутривенно сердечные гликозиды вводят очень медленно (в течение 7–10 мин) из-за возможного внезапного спазма коронарных сосудов.
Современная тенденция к использованию минимальных доз сердечных гликозидов требует соблюдения второго принципа лечения больных ХСН — обязательного сочетания инотропных препаратов с лечением ингибиторами АПФ, диуретиками и, при необходимости, b-адреноблокаторами (см. ниже). Такое комплексное лечение позволяет снизить дозы каждого из препаратов и значительно уменьшить риск возникновения побочных эффектов. Наконец, третий принцип лечения сердечными гликозидами — это тщательный анализ клинической картины заболевания и данных лабораторных и инструментальных методов исследования, позволяющий учитывать все показания и противопоказания к назначению этих препаратов. Побочные эффекты. Гликозидная интоксикация Факторы, способствующие возникновению гликозидной интоксикации. Применение сердечных гликозидов у больных ХСН во многом ограничено высоким риском возникновения побочных эффектов. Токсическое действие сердечных гликозидов наблюдается у 4–23% больных ХСН и зависит, прежде всего, от суточной дозы препарата, точнее от концентрации сердечных гликозидов в крови. На рис. 2.49 показана зависимость между концентрацией дигоксина в крови, его клиническим эффектом и развитием гликозидной интоксикации. На рисунке видно, что токсичность препарата резко возрастает при концентрациях дигоксина в крови выше 2,0 нг/мл. Оптимальной концентрацией препарата, при которой клинический эффект достаточно выражен, а токсическое действие почти не проявляется, следует считать 1,0–1,2 нг/мл, что ориентировочно соответствует приему дигоксина в дозе 0,25 мг в сутки. В то же время следует помнить, что признаки гликозидной интоксикации могут появиться при терапевтических концентрациях препарата в крови и приеме низких суточных доз препарата. Это связано с повышенной индивидуальной чувствительностью к сердечным гликозидам, наиболее частой причиной которой является гипокалиемия.
Клинические проявления гликозидной интоксикации включают следующие диспептические, неврологические и кардиальные расстройства. 1. Диспептические расстройства. Снижение аппетита (анорексия), тошнота, рвота, изредка диарея — относятся к числу наиболее ранних проявлений интоксикации гликозидами. Их возникновение, как правило, не связано с “раздражением” гликозидами слизистой оболочки желудка или кишечника, а имеет преимущественно центральное происхождение (стимуляция сердечными гликозидами продолговатого мозга). 2. Неврологические расстройства заключаются в появлении быстрой утомляемости, головокружений, выраженной сонливости или, наоборот, бессонницы, ночных кошмаров, беспокойства и, наконец, спутанного сознания, психоза и делирия. Характерны нарушения зрения, в частности, появление вокруг предметов ореолов желтого или желто-зеленоватого цветов (ксантоксия), особенно при взгляде на источник света, снижение остроты зрения, восприятие предметов в уменьшенном или увеличенном виде. 3. Кардиальные расстройства — это наиболее тяжелые и опасные проявления гликозидной интоксикации. В половине случаев они могут предшествовать диспептическим и неврологическим нарушениям. Чаще всего встречаются следующие нарушения ритма и проводимости:
Чаще всего из перечисленных нарушений ритма и проводимости встречаются непароксизмальная наджелудочковая тахикардия и желудочковые аритмии (около 70% больных с гликозидной интоксикацией). Механизмы возникновения, диагностические критерии и лечение этих и других аритмий подробно описаны в главе 3. Следует помнить, что в некоторых случаях гликозидная интоксикация поначалу может проявляться только усугублением признаков сердечной недостаточности, снижением массы тела, гинекомастией и неврологическими расстройствами. Изменения ЭКГ при лечении сердечными гликозидами достаточно характерны. Помимо перечисленных нарушений ритма и проводимости, которые возникают на фоне гликозидной интоксикации, при применении гликозидов нередко можно обнаружить корытообразное смещение сегмента RS–Т ниже изолинии с формированием сглаженного, двухфазного (–+) или отрицательного зубца Т, а также некоторое укорочение интервала Q–Т (рис. 2.50).
Лечение гликозидной интоксикации всегда начинается с отмены сердечных гликозидов. В легких случаях иногда этого бывает достаточно для купирования минимальных клинических проявлений интоксикации: единичных ЖЭ, АВ-блокады I степени, легких диспептических расстройств и т.п. При наличии гипокалиемии назначаются препараты калия:
Следует помнить, что при наличии АВ-блокады II степени препараты калия не применяются (риск возникновения АВ-блокады III степени). Для лечения аритмий применяют:
Для лечения АВ-блокад используют:
В тяжелых случаях гликозидной интоксикации для связывания сердечных гликозидов, циркулирующих в крови, применяют специфические фрагменты антител к дигоксину — Fab fragments. Через 20–40 мин после внутривенного введения препарата у половины больных удается полностью купировать проявления гликозидной интоксикации. b-адреноблокаторы b-адреноблокаторы — это ЛС, обладающие свойствами конкурентно связываться с b1- и b2-адренорецепторами и блокировать их взаимодействие с норадреналином и адреналином, а также с другими (в том числе искусственными) стимуляторами b-рецепторов. Напомним, что в сердце преобладают b1–адренорецепторы, стимуляция которых, как известно, сопровождается положительным инотропным, хронотропным и дромотропным эффектами (см. табл. 1.2). Блокаторы b-адренорецепторов препятствуют взаимодействию катехоламинов с соответствующими рецепторами клеток, устраняя, таким образом, активацию мембранной аденилатциклазы и внутриклеточного цАМФ. Это сопровождается отрицательным инотропным, хронотропным, дромотропным и батмотропным действием. Происходит угнетение автоматизма СА-узла, уменьшение ЧСС и замедление проведения электрического импульса по проводящей системе сердца. Одновременно уменьшается вероятность возникновения эктопических очагов в предсердиях, АВ-соединении и в меньшей степени в желудочках. Под действием b-адреноблокаторов происходит снижение АД у пациентов с АГ. Эти и некоторые другие свойства b-адреноблокаторов широко используются при лечении больных АГ, ИБС, аритмиями и ХСН.
Все b-адреноблокаторы могут быть разделены на несколько подгрупп в зависимости от наличия или отсутствия у них 4-х основных свойств b-адреноблокаторов:
1. b1-кардиоселективность — это способность избирательно блокировать b1-адренорецепторы, не оказывая влияния на функцию b2-адренорецепторов (табл. 2.16). Неселективные b-адреноблокаторы (пропранолол, надолол и др.) препятствуют взаимодействию с адреналином и норадреналином как b1-, так и b2-адренорецепторов. Нередко они обладают высокой клинической эффективностью, например, при лечении больных АГ или ИБС (см. ниже). Однако блокада обоих типов b-адренорецепторов (b1 и b2) ведет к потере важных фармакодинамических свойств, которыми обладают нормально функционирующие b2-адренорецепторы, а также к относительному преобладанию эффектов a-адренорецепторов (например, сужение периферических сосудов). Напомним, что к числу таких свойств b2-адренорецепторов относятся:
В связи с этим при лечении неселективными b-адреноблокаторами нередко могут выявляться нежелательные побочные эффекты: бронхоспазм (отсутствие расслабления гладкой мускулатуры бронхов), ухудшение периферического кровообращения, в том числе синдром Рейно, похолодание конечностей (отсутствие расширения периферических сосудов), быстрая утомляемость и слабость в скелетных мышцах, коронароспазм, нарушения углеводного обмена (недостаточная секреция инсулина и угнетение гликогенолиза в печени и скелетных мышцах), спастические сокращения матки во время беременности и т.п. Эти и некоторые другие нежелательные реакции возникают в результате блокирования b2-адренорецепторов, а также относительного преобладания эффектов a-рецепторов. Кардиоселективные b1-адреноблокаторы во многом лишены описанных побочных эффектов в связи с отсутствием у них свойств блокировать b2-адренорецепторы. Эти препараты можно, хотя и с известной осторожностью, применять у больных с сопутствующими обструктивными заболеваниями легких, сахарным диабетом, нарушениями периферического кровообращения, а также во время беременности. Кардиоселективные b1-адреноблокаторы, в отличие от неселективных, не вызывают сужения сосудов скелетных мышц и реже вызывают мышечную слабость и повышенную утомляемость. Следует все же отметить, что b1-кардиоселективность — свойство весьма относительное. При применении малых доз b-адреноблокаторов относительная b1-кардиоселективность сохраняется, тогда как при использовании высоких доз этих препаратов их селективность может уменьшаться или исчезать совсем. 2. Внутренняя симпатомиметическая активность (ВСА) — это способность некоторых b-адреноблокаторов не только блокировать взаимодействие b-адренорецепторов с норадреналином и адреналином, но и частично стимулировать b-адренорецепторы. Препараты с ВСА не вызывают столь резкого уменьшения ЧСС и сократимости миокарда в покое, и их отрицательные хронотропный и инотропный эффекты проявляются почти исключительно при физической и эмоциональной нагрузке. b-адреноблокаторы с ВСА реже, чем препараты без ВСА, влияют на липидный и углеводный обмен. Общее количество побочных реакций при применении b-адреноблокаторов с ВСА также меньше, чем при лечении b-адреноблокаторами без ВСА, однако клиническая эффективность этих препаратов по понятным причинам также оказывается ниже, чем b-адреноблокаторов без ВСА. Таким образом, b-адреноблокаторы с ВСА целесообразно использовать в тех случаях, когда не требуется значительного снижения ЧСС, АД и сократительной способности миокарда (по крайней мере, в покое). В табл. 2.16. представлена рабочая классификация b-адреноблокаторов в зависимости от наличия кардиоселективности и внутренней симпатомиметической активности препаратов. Таблица 2.16 Рабочая классификация b-адреноблокаторов
Вазодилатирующие свойства b-адреноблокаторов. Некоторые современные b-адреноблокаторы обладают вазодилатирующими свойствами. Этот эффект достигается с помощью нескольких механизмов:
b-адреноблокаторы с вазодилатирующими свойствами целесообразно использовать у больных АГ с высокими цифрами АД и у пациентов с исходно высоким тонусом гладкой мускулатуры. 4. Продолжительность действия. Различают липофильные и гидрофильные b-адреноблокаторы, которые отличаются по своим фармакодинамическим свойствам, а также выраженности некоторых побочных эффектов. Липофильные (жирорастворимые) b-адреноблокаторы (пропранолол, метопролол, окспренолол, тимолол, карведилол и др.) почти полностью всасываются в желудочно-кишечном тракте, хорошо проникают через гематоэнцефалический барьер, что объясняет частоту побочных реакций со стороны ЦНС (слабость, сонливость, депрессия, кошмарные сновидения, галлюцинации). Липофильные b-адреноблокаторы хорошо метаболизируются в печени и в основном выделяются с желчью. Они имеют сравнительно короткий период полувыведения (около 3–5 ч) и назначаются в связи с этим не реже 2–3 раз в сутки. При ухудшении функции печени нарушается выведение препарата из организма, что требует снижения суточной дозы препарата и тщательного контроля за функциональным состоянием печени и концентрацией b-адреноблокаторов в крови. Гидрофильные (водорастворимые) b-адреноблокаторы (атенолол, надолол, соталол) сравнительно хуже всасываются в желудочно-кишечном тракте и незначительно метаболизируюся в печени. Они экскретируются почками и выделяются с мочой в виде метаболитов или в неизмененном виде. При снижении функции почек нарушается экскреция b-адреноблокаторов с мочой, что также требует снижения суточной дозы препарата. Гидрофильные b-адреноблокаторы не проникают через гематоэнцефалический барьер и поэтому реже, чем липофильные препараты, вызывают побочные реакции со стороны ЦНС. Период полувыведения гидрофильных b-адреноблокаторов чаще всего достигает 6–12 ч или больше, что дает возможность принимать препараты 1–2 раза в сутки. Гидрофильные b-адреноблокаторы целесообразно назначать больным с поражением печени, а также пациентам с психическими нарушениями.
Применение b-адреноблокаторов при ХСН В патогенезе СН важнейшая роль принадлежит, как известно, чрезмерной активации САС и повышению уровня катехоламинов в крови, оказывающих неблагоприятное влияние на сердечно-сосудистую систему. Напомним, что хроническая гиперактивация САС сопровождается:
Интересно, что избыточный уровень норадреналина обусловливает значительную перестройку рецепторного аппарата миокарда. Если у здорового человека в сердечной мышце существенно преобладают b1-адренорецепторы (до 80–85%), возбуждение которых закономерно сопровождается увеличением сократимости миокарда, то при ХСН число b1-рецепторов значительно уменьшается (они связаны с молекулой норадреналина), почти достигая уровня b2-адренорецепторов. Поэтому даже на фоне избытка норадреналина в крови сократительная функция миокарда не увеличивается, а снижается (down regulation). Все эти неблагоприятные воздействия катехоламинов способствуют падению сократимости и быстрому прогрессированию СН. В связи с этим в последние годы большое значение в комплексной терапии ХСН придают рациональному применению b-адреноблокаторов. Доказано, что длительное применение у больных ХСН кардиоселективных b-адреноблокаторов метопролола и бисопролола снижает число обострений ХСН, общую смертность, а также частоту внезапной сердечной смерти на 34–49%. Особенно хорошо зарекомендовали себя b-адреноблокаторы при ХСН, развившейся на фоне ИБС, АГ, ГКМП (см. ниже). Следует добавить, что еще недавно вопрос о целесообразности и правомочности назначения b-адреноблокаторов при ХСН дискутировался. Считалось, что эти ЛС в связи с наличием у них отрицательного инотропного действия вообще противопоказаны при СН. Однако в последние годы было убедительно показано, что отрицательный инотропный эффект b-адреноблокаторов у больных ХСН выражен в малой степени и лишь на начальном этапе лечения. Длительное применение оптимально подобранных доз b-адреноблокаторов сопровождается возрастанием насосной функции сердца и увеличением сердечного выброса, что является следствием широкого спектра положительных влияний b-адреноблокаторов на сердце.
Показания Согласно рекомендациям Американской ассоциации кардиологов (1999), использование b-адреноблокаторов показано всем больным ХСН с систолической дисфункцией (ФВ меньше 40%), относящимся к ФК II–III по NYHA, при отсутствии у них противопоказаний к приему препаратов и при условии стабилизации клинических симптомов ХСН. Особенно эффективны b-адреноблокаторы у больных ХСН, развившейся на фоне АГ, ГКМП и ИБС, что связано с влиянием препаратов на уровень системного АД, замедлением сердечного ритма, улучшением диастолической функции ЛЖ, а также с антиангинальным действием b-адреноблокаторов. Противопоказания Применение b-адреноблокаторов противопоказано при следующих заболеваниях и синдромах:
Следует также соблюдать осторожность при назначении b-адреноблокаторов больным с сахарным диабетом, ХПН, при нарушении функции печени и портальной гипертензии, а также у пациентов с нарушением периферического кровообращения — перемежающейся хромотой и синдромом Рейно (кроме карведилола). Методика лечения Для лечения больных ХСН в настоящее время рекомендован длительный прием одного из трех блокаторов b-адренорецепторов (метопролол, бисопролол и карведилол), для которых на большом клиническом материале доказан отчетливый положительный эффект терапии, в том числе достоверное снижение смертности больных ХСН. Метопролол и бисопролол являются кардиоселективными b1-блокаторами без внутренней симпатомиметической активности, а карведилол — неселективным b1,2-адреноблокатором, обладающим к тому же свойствами вазодилататоров (за счет блокады сосудистых a-адренорецепторов). Выбор одного из этих b-адреноблокаторов определяется в основном конкретной клинической ситуацией.
Для лечения больных, естественно, могут быть использованы и другие препараты данного класса, преимущественно не обладающие внутренней симпатомиметической активностью: соталол, пропранолол и др. Побочные эффекты Лечение больных ХСН b-адреноблокаторами во многих случаях представляет достаточно сложную проблему, главным образом, из-за риска возникновения различных побочных эффектов. К числу наиболее значимых из них относятся:
Избежать этих побочных эффектов позволяет строгое соблюдение следующих основных принципов лечения больных ХСН b-адреноблокаторами. 1. b-адреноблокаторы назначаются в соответствии с показаниями и противопоказаниями, описанными выше. 2. У больных ХСН b-адреноблокаторы назначаются только дополнительно к ингибиторам АПФ и диуретикам (иногда вместе с сердечными гликозидами), причем больные должны находиться на заранее подобранной стабильной дозе этих препаратов при уровне АД не ниже 100 мм рт. ст. 3. Стартовая доза препаратов должна быть очень низкой (не выше 20% от средней терапевтической):
4. Увеличение дозы b-адреноблокаторов осуществляется очень медленно: примерно 1 раз в 2 недели доза может быть увеличена в 2 раза. 5. Период “титрования” дозы b-адреноблокаторов может продолжаться 6–8 недель, причем оптимальными терапевтическими дозами, к которым следует стремиться, хотя это и не всегда возможно у больных ХСН, считают следующие:
6. Больной должен быть предупрежден, что в первые 2–3 недели лечения возможно ухудшение самочувствия, даже прогрессирование симптомов ХСН и небольшая задержка жидкости. После “прохождения” начального периода в большинстве случаев наступает улучшение.
Другие лекарственные средства Описанные выше ингибиторы АПФ, диуретики, сердечные гликозиды и блокаторы b-адренорецепторов относятся к так называемой базисной терапии больных ХСН. Помимо этих классов ЛС, при необходимости могут назначаться следующие медикаментозные препараты:
Подробное описание механизмов действия и способа применения этих ЛС приведено в следующих главах. Подбор лекарственной терапии у больных с систолической ХСН Оптимальный выбор ЛС и их комбинаций для лечения систолической ХСН определяется тяжестью сердечной недостаточности (ФК по NYHA), а также наличием или отсутствием тех или иных клинических проявлений СН:
Большое значение имеет также характер и тяжесть основного заболевания, на фоне которого развилась СН, а также наличие некоторых осложнений основного заболевания и ХСН (аритмий, склонности к гиперкоагуляции, внутрисердечных тромбов, электролитных нарушений и т.д.). Существует несколько ориентировочных схем выбора лекарственной терапии у больных ХСН (Ю.Н. Беленков). Так, у больных с начальными стадиями СН (ФК I–II по NYHA) и сохраненным синусовым ритмом (рис. 2.51, а) на первом этапе подбора лекарственной терапии назначается один из ингибиторов АПФ. На втором этапе к ингибитору АПФ может добавляться диуретик (при наличии у больного отечного синдрома) или b-адреноблокатор (при наличии синусовой тахикардии). Если оказывается, что у больного, несмотря на умеренные клинические проявления СН, имеется значительная систолическая дисфункция (ФВ меньше 30%) или выявляется артериальная гипотензия, на третьем этапе лечения возможно назначение сердечных гликозидов. Кроме того, по показаниям к такому лечению могут добавляться альдактон (верошпирон), антиаритмические препараты и антикоагулянты, а также нитраты, аспирин и т.п.
Сходные подходы к лечению существует для больных с начальными стадиями ХСН (ФК I–II по NYHA), но наличием постоянной формы мерцательной аритмии (рис. 2.51, б). Однако в этих случаях уже на первом этапе подбора терапии целесообразно назначить не только один из ингибиторов АПФ, но и дигоксин. По показаниям на втором и третьем этапах лечения могут добавляться диуретики, b-адреноблокаторы, антиаритмические препараты, альдактон, нитраты и др. Особое значение у больных ХСН с мерцательной аритмией приобретает применение антикоагулянтов в связи с повышенным риском тромбоэмболических осложнений. У больных с выраженными клиническими проявлениями ХСН (ФК III–IV), сохраненным синусовым ритмом (рис. 2.52, а) на первом этапе подбора терапии целесообразно назначить ингибитор АПФ и диуретик. На втором этапе в зависимости от выраженности застоя крови, тахикардии и снижения ФВ к этой терапии обычно добавляется альдактон, b-адреноблокатор или сердечный гликозид. В дальнейшем возможно “подключение” к этой терапии других препаратов. Наконец, у пациентов с выраженной ХСН (ФК III–IV) и постоянной формой мерцательной аритмии (рис. 2.52, б) в большинстве случаев уже на первом этапе лечения приходится назначать как минимум три базисных препарата: ингибитор АПФ, диуретик и сердечный гликозид, а в дальнейшем (по показаниям) — b-адреноблокаторы, антикоагулянты, антиаритмические и другие препараты. Естественно, эти ориентировочные схемы могут быть изменены в зависимости от индивидуальных особенностей течения заболевания.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Диастолическая ХСН — это сердечная недостаточность с нормальной или незначительно сниженной сократительной функцией ЛЖ, но с выраженным нарушением его диастолического расслабления и наполнения, которая сопровождается ростом конечно-диастолического давления в желудочке, застоем крови в малом круге кровообращения и другими признаками СН. Таким образом, существует 3 основных критерия выделения диастолической ХСН как одной из особых форм сердечной декомпенсации (рекомендации рабочей группы Европейского общества кардиологов, 1998). 1. Наличие клинических признаков ХСН (одышка, утомляемость, влажные хрипы в легких, отеки и др.). 2. Нормальная или незначительно сниженная сократительная способность миокарда (ФВ ЛЖ больше 45–50%). 3. Наличие объективных признаков, свидетельствующих о нарушенных расслаблении и наполнении ЛЖ и/или признаках повышенной жесткости ЛЖ. Выделение диастолической ХСН имеет важное практическое значение, поскольку эта форма СН встречается у 20–30% больных с клиническими признаками сердечной декомпенсации, причем имеются принципиальные отличия в тактике лечения таких больных. Однако следует иметь в виду два важных в практическом отношении обстоятельства: 1. Прогрессирование диастолической ХСН со временем приводит к столь резкому снижению наполнения ЛЖ, что начинает уменьшаться величина СИ и ФВ, т.е. появляются признаки систолической дисфункции ЛЖ. 2. Практически у всех пациентов с ХСН, у которых процесс декомпенсации с самого начала носит характер систолической ХСН и сопровождается отчетливым снижением ФВ и СИ, также можно выявить более или менее выраженные признаки диастолической дисфункции ЛЖ, которая существенно усугубляет гемодинамические расстройства. Таким образом, четкое деление ХСН на два патофизиологических варианта — систолическую и диастолическую — справедливо преимущественно на ранних стадиях формирования ХСН (С.Н. Терещенко с соавт., 2000). Далеко зашедший процесс сердечной декомпенсации — это, как правило, сочетание расстройств диастолической и систолической функций ЛЖ. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В основе возникновения диастолической дисфункции ЛЖ лежат 2 причины:
Диастолическая форма ХСН чаще всего развивается при заболеваниях, для которых характерны: 1. Выраженная гипертрофия миокарда желудочков. 2. Выраженный кардиофиброз. 3. Длительная хроническая ишемия сердечной мышцы. 4. Значительное увеличение постнагрузки. 5. Поражения перикарда.
Следует отметить, что у больных митральным стенозом, несмотря на нарушение наполнения ЛЖ, речь не идет о диастолической форме СН, поскольку эти нарушения возникают не вследствие повреждения миокарда желудочка, а из-за механического препятствия току крови на уровне АВ-отверстия. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В результате замедления активного расслабления ЛЖ и снижения его податливости в диастолу нормальное давление наполнения желудочка (меньше 12 мм рт. ст.) уже не может обеспечить его достаточного заполнения кровью. Кривая объем–давление смещается вверх и влево (рис. 2.53), свидетельствуя о том, что для получения того же конечно-диастолического объема необходимо большее давление наполнения, чем в норме. Поэтому первым закономерным следствием диастолической дисфункции ЛЖ является повышение КДД в желудочке, что способствует сохранению нормальной величины КДО и сердечного выброса. Вторым следствием диастолической дисфункции ЛЖ являются различные варианты перераспределения во время диастолы диастолического потока крови из предсердия в желудочек, которые подробно описаны в разделе 2.1.
Как известно, поступление крови из предсердия в желудочки осуществляется в две фазы (см. рис. 1.25–1.27):
Ранние стадии нарушения диастолической функции ЛЖ характеризуются умеренным уменьшением скорости изоволюмического расслабления и объема раннего наполнения. В результате такой структурной перестройки диастолы происходит выраженная перегрузка ЛП, увеличение его объема и давления в нем. На более поздних стадиях развивается “рестриктивный” тип диастолической дисфункции (подробнее — см. ниже). Перегрузка ЛП способствует раннему возникновению наджелудочковых нарушений сердечного ритма, в частности, развитию фибрилляции и трепетания предсердий. Наконец, третьим следствием диастолической дисфункции является рост давления в венозном русле малого круга кровообращения и застой крови в легких. Следует заметить, что в отличие от систолической ХСН, для которой на самых ранних стадиях заболевания характерно расширение ЛЖ, для диастолической ХСН дилатация ЛЖ не характерна, до тех пор пока к диастолической дисфункции не присоединится нарушение насосной функции сердца.
Так же как и при систолической ХСН, диастолическая дисфункция ЛЖ, рост КДД в желудочке и давления в малом круге кровообращения так или иначе способствуют активации нейрогормональных систем организма — САС, РААС и АДГ-вазопрессина. Это способствует задержке Nа+ и воды в организме, развитию отечного синдрома и склонности к вазоконстрикторным эффектам. Поздние стадии диастолической ХСН характеризуются значительным ростом КДД ЛЖ, неэффективностью систолы ЛП и критическим снижением наполнения ЛЖ. Это сопровождается падением сердечного выброса, еще большим снижением толерантности к физической нагрузке и застоем крови в легких. В связи с высоким давлением в легочной артерии развивается гипертрофия и дилатация ПЖ и со временем присоединяются признаки правожелудочковой СН. Следует, правда, отметить, что для диастолической ХСН больше характерно преобладание левожелудочковой недостаточности. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Клиническая картина диастолической ХСН характеризуется симптомами застойной сердечной недостаточности (преимущественно левожелудочковой) на фоне нормальной или почти нормальной систолической функции ЛЖ и признаков нарушения его расслабления, обнаруживаемых при эхокардиографическом исследовании в допплеровском режиме. Следует помнить, что диастолическая ХСН чаще встречается у больных пожилого и старческого возраста. У женщин диастолическая форма ХСН развивается гораздо чаще, чем у мужчин. Пациенты, страдающие АГ, ИБС, аортальным стенозом, ГКМП, сахарным диабетом, имеют наиболее высокий риск возникновения диастолической ХСН. Большинство пациентов с диастолической ХСН имеют симптомы левожелудочковой недостаточности, застоя крови в малом круге кровообращения и легочной АГ, тогда как признаки правожелудочковой недостаточности менее характерны. Чаще всего больные жалуются на:
При физикальном исследовании можно обнаружить:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Использование современных инструментальных методов исследования у больных с диастолической ХСН позволяет:
С этой целью обычно используют наиболее простые и неинвазивные методы исследования (ЭКГ, рентгенографию органов грудной клетки, ЭхоКГ и др.). Эхокардиография Методика эхокардиографической оценки систолической функции ЛЖ была описана выше. Следует помнить, что для диагностики диастолической ХСН на первом этапе важно убедиться в отсутствии значимых изменений систолической функции ЛЖ.
Следует заметить, что нередко при наличии диастолической дисфункции ФВ не только остается нормальной, но может быть повышена (более 60%), что указывает на наличие гиперкинетического типа кровообращения у части больных с диастолической ХСН. Кроме того, более чем у 70% больных диастолической ХСН обнаруживают эхокардиографические и электрокардиографические признаки выраженной гипертрофии ЛЖ (подробнее — см. главу 7). Диагностика диастолической дисфункции ЛЖ основана на оценке характера трансмитрального диастолического потока крови, определяемого с помощью эхокардиографии в импульсном допплеровском режиме. Исследование проводят из верхушечной позиции четырехкамерного сердца, причем ультразвуковой луч направлен строго параллельно потоку крови (рис. 2.55, а). Для оценки диастолической функции ЛЖ определяют (рис. 2.55, б): 1. Максимальную скорость раннего пика диастолического наполнения (Vmax Peak Е). 2. Максимальную скорость трансмитрального кровотока во время систолы левого предсердия (Vmax Peak А).
3. Отношение максимальных скоростей раннего и позднего наполнения (Е/А). 4. Время изоволюмического расслабления ЛЖ — IVRT (измеряется при одновременной регистрации аортального и трансмитрального кровотока в постоянно-волновом режиме из апикального доступа). 5. Время замедления раннего диастолического наполнения (DT). В норме диастолический поток крови через митральный клапан при регистрации в допплер-режиме имеет двухволновую форму (рис. 2.56). После открытия митрального клапана скорость потока крови через левое атриовентрикулярное отверстие быстро увеличивается до максимальной и затем так же быстро уменьшается почти до нулевой линии. Этот ранний диастолический пик (Peak Е) соответствует фазе быстрого наполнения ЛЖ и в норме составляет около 0,62 м/с (табл. 2.17). Время изоволюмического расслабления ЛЖ (IVRT), представляющее собой интервал между окончанием потока в выходном тракте ЛЖ и началом потока через митральный клапан, является хорошим показателем скорости начальной релаксации желудочка. В норме IVRT ЛЖ составляет не более 70–75 мс, а время замедления раннего диастолического наполнения (DТ) — 200 мс (рис. 2.56 и табл. 2.17).
В конце диастолы во время сокращения ЛП скорость потока крови снова увеличивается, образуя второй пик (Peak А), и затем возвращается к нулевой линии, когда митральный клапан закрывается. При нормальной диастолической функции на допплерограмме преобладает пик раннего диастолического наполнения (Peak Е), который в 1,5–1,7 раза выше пика позднего наполнения желудочка (Peak A). Таблица 2.17 Нормальные значения некоторых показателей диастолической функции ЛЖ
Начальные стадии нарушения диастолической функции ЛЖ, не сопровождающиеся увеличением КДД в желудочке и давления в ЛП, характеризуются снижением скорости изоволюмического расслабления и объема раннего диастолического наполнения. При этом объем ЛП непосредственно перед началом его сокращения, т.е. в конце диастолы, заметно увеличивается. Результатом этого по закону Старлинга является более сильное сокращение ЛП и увеличение фракции предсердного наполнения (пика А). Иными словами, на начальной стадии развития диастолической дисфункции замедление релаксации ЛЖ приводит к перераспределению диастолического наполнения в пользу предсердного компонента и значительная часть диастолического кровотока осуществляется во время активной систолы ЛП. На допплерограммах трансмитрального кровотока выявляется снижение амплитуды пика Е и увеличение высоты пика А (рис. 2.57). Отношение Е/А уменьшается до 1,0 и ниже. Одновременно определяется увеличение времени изоволюмического расслабления ЛЖ (IVRT) больше 90–100 мс и времени замедления раннего диастолического наполнения (DТ) — больше 220 мс.
Такой тип диастолической дисфункции ЛЖ получил название типа “замедленной релаксации”. Наиболее частыми факторами, ведущими к формированию данного типа диастолической дисфункции ЛЖ, являются хроническая или транзиторная ишемия миокарда у больных ИБС, кардиосклероз любого генеза (в том числе постинфарктный), гипертрофия миокарда, поражения перикарда, блокады ножек пучка Гиса и др. Дальнейшее прогрессирование нарушений внутрисердечной гемодинамики приводит к росту давления в ЛП и увеличению предсердно-желудочкового градиента давления во время фазы быстрого наполнения. Это сопровождается значительным ускорением раннего диастолического наполнения желудочка (Peak Е) при одновременном уменьшении скорости кровотока во время систолы предсердия (Peak А). Рост конечно-диастолического давления в ЛЖ способствует еще большему ограничению кровотока во время предсердной систолы. Происходит своеобразная патологическая “псевдонормализация” диастолического наполнения ЛЖ с увеличением значений максимальной скорости раннего диастолического наполнения (Peak Е) и уменьшением скорости предсердного наполнения (Peak А). В результате отношение Е/А увеличивается до 1,6–1,8 и более (рис. 2.58). Эти изменения сопровождаются укорочением фазы изоволюмического расслабления (IVRT) меньше 80 мс и времени замедления раннего диастолического наполнения (DT) меньше 150 мс.
Такой, “рестриктивный” тип диастолической дисфункции, как правило, наблюдается при застойной СН, свидетельствуя о значительном повышении давления наполнения ЛЖ. Нередко описанные признаки диастолической дисфункции ЛЖ предшествуют нарушениям его систолической функции, причем “рестриктивный” тип является прогностически менее благоприятным. Следует помнить, что адекватная оценка диастолической функции ЛЖ описанным методом возможна только у пациентов с ЧСС менее 90 в мин, а также при отсутствии у них митрального стеноза, аортальной и митральной недостаточности. Рентгенография органов грудной клетки Рентгенография органов грудной клетки дает возможность выявить отсутствие выраженной кардиомегалии и оценить состояние малого круга кровообращения. В большинстве случаев выявляются признаки венозного полнокровия легких, иногда в сочетании с признаками легочной артериальной гипертензии (см. выше). Катетеризация сердца При проведении катетеризации сердца у больных ИБС, направляемых на хирургическую реваскуляризацию, или у пациентов с ГКМП, проходящих обследование перед операцией трансплантации сердца, можно выявить повышение давления заклинивания легочной артерии (или давления наполнения ЛЖ) больше 16–18 мм рт. ст.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Лечение больных диастолической ХСН представляет собой еще более сложную задачу, чем терапия пациентов с систолической ХСН. К сожалению, до сих пор не существует общепринятых схем и алгоритмов лечения диастолической ХСН, хотя имеются сообщения о возможности некоторых классов ЛС оказывать положительное влияние на процессы активного расслабления миокарда желудочков, характер их диастолического наполнения, степень гипертрофии сердечной мышцы и другие факторы, имеющие значение в патогенезе гемодинамических расстройств у больных диастолической ХСН. Согласно рекомендациям Европейского общества кардиологов (1997), можно выделить несколько основных принципов медикаментозной терапии больных с диастолической ХСН. 1. Восстановление синусового ритма у больных с наджелудочковой тахиаритмией (фибрилляцией или трепетанием предсердий) приводит к существенному улучшению диастолического наполнения желудочков за счет восстановления нормальной физиологической последовательности сокращения предсердий и желудочков. Способы коррекции наджелудочковых тахиаритмий подробно обсуждаются в главе 3. 2. Уменьшение ЧСС, так же, как и при систолической ХСН, способствует снижению постнагрузки, внутримиокардиального напряжения и потребности миокарда в кислороде. Кроме того, увеличение продолжительности диастолы также сопровождается улучшением наполнения желудочков. С целью коррекции ЧСС используются препараты, оказывающие влияние на автоматизм СА-узла и скорость АВ-проведения: b-адреноблокаторы (атенолол, метопролол, карведилол и др.) и блокаторы медленных кальциевых каналов (антагонисты кальция) — верапамил и дилтиазем. 3. С целью уменьшения застоя крови в малом круге кровобращения целесообразно осторожное применение диуретиков (см. выше), уменьшающих ОЦК и давление в легочной артерии. Следует, однако, помнить о том, что очень быстрое и значительное уменьшение давления наполнения ЛЖ в условиях его повышенной диастолической жесткости и нарушения расслабления может привести к еще более значительным расстройствам диастолического наполнения желудочков и критическому падению сердечного выброса. 4. Влияние на диастолическое наполнение желудочков. Еще более сложной, но патогенетически оправданной, задачей лечения больных диастолической ХСН является прямое или опосредованное воздействие на факторы, определяющие диастолическое наполнение желудочков и степень диастолической дисфункции, а именно:
С этой целью могут использоваться следующие группы ЛС. а) Блокаторы медленных кальциевых каналов (антагонисты кальция) — верапамил и дилтиазем — в индивидуально подобранных дозах (подробнее см. главу 7). Антагонисты кальция способны улучшать активное расслабление миокарда и диастолическое наполнение желудочков, уменьшать массу миокарда и улучшать, таким образом, пассивные эластические свойства сердечной мышцы. Кроме того, верапамил и дилтиазем уменьшают ЧСС и снижают АД. Таким образом, блокаторы медленных кальциевых каналов могут оказаться особенно полезными при лечении больных АГ и ГКМП. В то же время следует учитывать, что продолжительная терапия антагонистами кальция больных, у которых к диастолическим расстройствам ЛЖ присоединились нарушения его систолической функции, может сопровождаться увеличением риска сердечно-сосудистых осложнений, в том числе внезапной сердечной смерти (короткодействующие препараты группы нифедипина). б) b-адреноблокаторы в некоторых клинических ситуациях могут оказаться средством выбора в лечении больных диастолической ХСН. Положительный эффект длительного приема b-адреноблокаторов связан с уменьшением степени гипертрофии миокарда ЛЖ и снижением жесткости сердечной мышцы. Имеет значение также урежение ЧСС, увеличение продолжительности диастолы, нормализация повышенного АД, антиаритмическое действие b-блокаторов и др. В то же время следует учитывать, что b-адреноблокаторы, угнетая активность САС, могут несколько ухудшать процесс активного расслабления миокарда. Кроме того, наличие отрицательного инотропного эффекта ограничивает применение этих препаратов у больных с тяжелой сердечной декомпенсацией (ФК III–IV по NYHA). b-адреноблокаторы целесообразно использовать у больных АГ или ИБС, особенно в сиуациях, когда имеется тахикардия или тахиаритмия. в) Ингибиторы АПФ обладают, очевидно, наибольшей эффективностью при лечении больных диастолической ХСН. Это объясняется:
г) Блокаторы рецепторов ангиотензина II (лосартан, валсартан, кандесартан и др.) по некоторым, пока неуточненным, данным оказывают более выраженное влияние на локальные тканевые РАС, гипертрофию миокарда и его эластические свойства, чем традиционные ингибиторы АПФ. Кроме того, эти препараты угнетают пролиферацию гладкомышечных клеток и фибробластов, что также сопровождается улучшением эластических свойств сердечной мышцы. д) Наконец, свойством уменьшать гипертрофию миокарда и замедлять формирование коллагена в сердечной мышце обладают антиальдостероновые препараты, относящиеся к группе калийсберегающих диуретиков — спиронолактон (альдактон, верошпирон). е) Нитраты показаны при лечении больных ИБС. Не обладая прямым влиянием на диастолическое расслабление, процессы формирования гипертрофии и кардиофиброза, нитраты снижают потребность миокарда в кислороде, уменьшают ишемию сердечной мышцы и тем самым косвенно могут влиять на эластичность миокарда желудочков. 5. Сердечные гликозиды противопоказаны при лечении больных с диастолической ХСН преимущественно в связи с тем, что угнетая клеточную К+-Nа+-АТФ-азу и Nа+-Са2+-обменный механизм в кардиомиоцитах (см. выше), сердечные гликозиды способствуют “перегрузке” сердечного волокна ионами Са2+ и тем самым оказывают неблагоприятное действие на процесс расслабления сердечной мышцы. Применение сердечных гликозидов допустимо лишь в случаях, когда к диастолической дисфункции ЛЖ присоединяются нарушения его систолической функции, уменьшение СИ и ФВ.
Клиническая картина, методы диагностики и лечение хронической изолированной правожелудочковой недостаточности, а также острой сердечной недостаточности, подробно описаны в последующих главах руководства. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||