
- •Введение
- •Общие правила техники безопасности и работы в химической лаборатории
- •Лабораторное оборудование и техника выполнения экспериментов
- •Лабораторная работа №1 Классы неорганических соединений
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №2 Концентрация растворов
- •Теоретическая часть
- •Экспериментальная часть
- •2% Соответствует разности 0,0153 г/см3
- •Контрольные вопросы
- •Лабораторная работа №3 Тепловой эффект химических реакций
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №4 Химическое равновесие
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №5 Кинетика химических реакций
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №6 Свойства водных растворов электролитов
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №7 Гидролиз солей
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №8 Определение жесткости воды и методы ее умягчения
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №9 Окислительно-восстановительные реакции
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №10 Основы электрохимии
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №11 Электролиз
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа №12 Коррозия
- •Теоретическая часть
- •Экспериментальная часть
- •Контрольные вопросы
- •Список рекомендуемой литературы
Экспериментальная часть
Опыт 1. Генетический ряд металла.
Осуществить превращения, иллюстрирующие генетический ряд металла – меди:
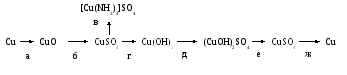
В каждом опыте приведите уравнение химической реакции, назовите исходные вещества и продукты реакции, а также укажите, к каким классам соединений они относятся.
а) возьмите около 0,1 г порошка меди, перенесите в фарфоровую чашку и прокалите на пламени горелки при перемешивании. Температура прокаливания не должна быть выше 500оС, в противном случае наряду с оксидом меди (II) будет образовываться оксид меди (I). Для данного опыта можно использовать муфельную печь. Что наблюдается при прокаливании металлической меди?
б) перенесите полученный порошок оксида меди (II) в пробирку и прилейте около 10 мл 1М раствора серной кислоты. Нагрейте пробирку в пламени горелки. Опишите наблюдаемые изменения. Укажите тип полученной соли. Раствор разделите на две части.
в) В одну пробирку с раствором, полученным в опыте б, прилейте концентрированный раствор аммиака. Опишите наблюдаемые изменения. К какому типу солей относится продукт реакции.
г) В другую пробирку с раствором, полученном в опыте б, прилейте 2 мл раствора гидроксида натрия. Какие изменения происходят в пробирке? Почему добавление основания в данном опыте привело к выпадению осадка, в отличие от опыта в.
д) Пробирку с осадком, полученным в опыте г осторожно прогрейте на пламени горелки. Что произошло при нагревании? Укажите тип полученной соли.
е) К осадку, полученному в опыте д, прилейте избыток раствора серной кислоты до его растворения. Почему произошло растворение осадка?
ж) В пробирку с раствором, полученном в опыте е, внесите гранулу цинка. Опишите свои наблюдения. Налейте в пробирку раствор нитрата свинца и внесите немного порошка металлической меди. Какие изменения происходят? Сделайте вывод об условиях протекания реакции замещения.
Опыт 2. Генетический ряд неметалла.
Осуществить превращения, иллюстрирующие генетический ряд неметалла – углерода:
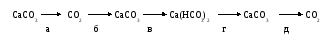
В каждом опыте приведите уравнение химической реакции, назовите исходные вещества и продукты реакции, а также укажите, к каким классам соединений они относятся.
а) Поместите в средний шар аппарата Киппа несколько кусочков мрамора. Налейте в пробирку дистиллированной воды и несколько капель метилового оранжевого. Пропустите полученный газ через воду. Что наблюдаете? Почему изменилась окраска раствора? Сделайте вывод о характере полученного в аппарате Киппа оксида.
б) Налейте в пробирку 10 мл известковой воды и несколько капель фенолфталеина. Полученный в аппарате Киппа газ пропустите через известковую воду. Опишите свои наблюдения. В чем причина изменения окраски раствора? К какому виду солей относится один из продуктов реакции?
в) Через полученную в опыте б смесь вновь пропустите газ из аппарата Киппа. Что наблюдаете в ходе реакции? К какому виду солей относится продукт реакции.
г) К полученному в опыте в раствору добавьте 2-3 мл известковой воды. Опишите свои наблюдения.
д) Осадок, полученный в опыте г, отфильтруйте и поместите в ложку для прокаливания. Прокалите осадок на пламени горелки в течение 5 минут и перенесите в пробирку. Добавьте 5 мл воды и несколько капель фенолфталеина. Опишите свои наблюдения. Объясните появление окраски. Сделайте вывод о характере полученного при разложении карбоната кальция оксиде.
Опыт 3. Химические свойства гидроксида алюминия.
В пробирку налейте 2-3 мл раствора соли алюминия и прибавьте примерно такой же объем раствора 1М NH4OH. Содержимое пробирки распределите в две пробирки. В одну из пробирок при взбалтывании прилейте по каплям избыток 10% раствора соляной кислоты. Во вторую пробирку прилейте избыток 10% раствора гидроксида натрия.
Какие изменения наблюдаете при добавлении раствора гидроксида аммония, а затем – растворов гидроксида натрия и соляной кислоты. Составьте уравнения реакций. Сделайте вывод о характере гидроксида алюминия. Объясните целесообразность использования в данном опыте гидроксида аммония для получения Al(OH)3.
