
- •Исправленный перечень знаний, умений и навыков (целевые установки, учебные достижения)
- •Тема 1. Атомно-молекулярное учение и стехиометрия
- •Тема 2. Классификация, свойства и номенклатура неорганических соединений
- •Тема 3. Окислительно-восстановительные реакции
- •Тема 4. Строение атома, периодический закон и Периодическая система д.И. Менделеева
- •Тема 5. Химическая связь и строение вещества
- •Тема 6. Основы химической термодинамики
- •Тема 7. Химическое равновесие
- •Тема 8. Основы химической кинетики
- •Тема 9. Способы выражения концентрации растворов
- •Тема 10. Образование и свойства растворов неэлектролитов и электролитов
- •Тема 11. Реакции в растворах электролитов
- •Тема 12. Электрохимические процессы
- •Задания банка-600,
- •Тема 1. Атомно-молекулярное учение и стехиометрия
- •Тема 2. Классификация и номенклатура неорганических соединений
- •1) Mg(oh)no3 2) Al(hso4)3 3) (nh4)2so4 4) TiOCl2
- •1) AlОнso4 2) (CuOh)2co3 3) кнso3 4) Cа(hco3)2 5) nh4Cl
- •1) Hi 2) h2SeO3 3) h2s 4) hClO4 5) h3po3 6) hcn
- •1) Koh 2) Al(oh)3 3) Cr(oh)3 4) Mg(oh)2 5) hClO4
- •1) NaOh 2) ZnO 3) hno3 4) SiO2 5) BaO 6) Zn(oh)2
- •1) Na3po4 2) kBr 3) kno3 4) Na2so4 5) NaCl
- •1) CaCo3 2) NaNo3 3) nh4Cl 4) h2SiO3
- •Тема 3. Окислительно-восстановительные реакции
- •Тема 4. Строение атомов, периодический закон и периодическая система д.И. Менделеева
- •1) Главное 2) орбитальное 3) магнитное 4) спиновое
- •1) Главное 2) орбитальное 3) магнитное 4) спиновое
- •Тема 5. Химическая связь и строение вещества
- •1) Хлорид калия 2) кислород 3) азот 4) аргон
- •1) Сероводород 2) углекислый газ 3) аммиак 4) хлороводород
- •1) Алмаз 2) сахар 3) поваренная соль 4) йод 5) железо
- •1) Кремний 2) йод 3) поваренная соль 4) железо
- •Тема 6. Основы химической термодинамики
- •Тема 7. Химическое равновесие
- •Тема 8. Основы химической кинетики
- •Тема 9. Способы выражения концентрации растворов
- •Тема 10. Образование и свойства растворов неэлектролитов и электролитов
- •Тема 11. Реакции в растворах электролитов
- •1) NaOh 2) NaNo3 3) NiCl2 4) ch3cook
- •1) KCl 2) Na3po4 3) ZnCl2 4) CuSo4 5) Na2SiO3
- •1) Cr2(so4)3 2) Na2so4 3) NaNo3 4) AlCl3 5) NaNo2
- •1) Na2SiO3 2) Na2so4 3) ZnSo4 4) FeCl3
- •1) Na2SiO3 2) Na2so4 3) ZnSo4 4) FeCl3 5) kno3
- •Тема 12. Электрохимические процессы
- •1) Na2so4 2) CuCl2 3) kno3 4) NiBr2
- •1) Cr 2) Fe 3) Ni 4) CrCl3 5) h2so4 6) NiSo4
- •Задания для рубежных контролей Методика формирования наборов заданий для рубежных контролей
- •Заключение
- •Литература
- •Оглавление
Тема 7. Химическое равновесие
1. Для обратимой реакции
2Ca(к) + CO2(г) D 2CaO(к) + C(к)
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
правильное выражение закона действующих масс |
2 |
|
факторы, влияющие на константу равновесия (1 – концентрация веществ, 2 – катализатор, 3 – давление, 4 – температура) |
34 |
2. Для обратимой реакции
2NO(г) + O2(г) D 2NO2(г)
приведены математические выражения закона действующих масс
1)
![]() 2)
2)
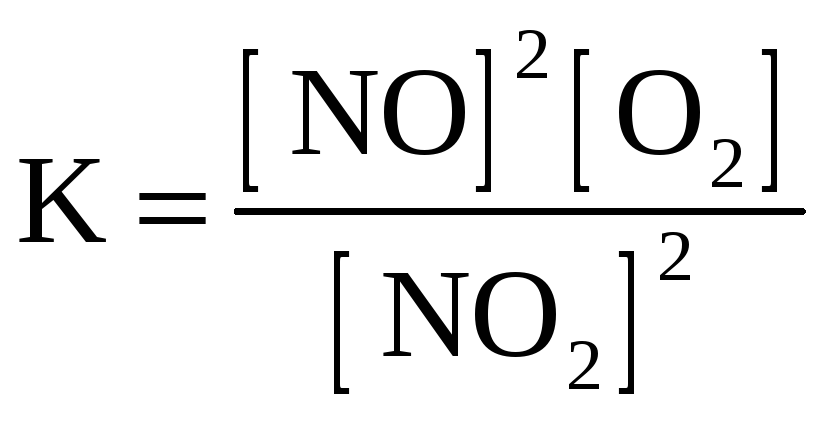 3)
3)
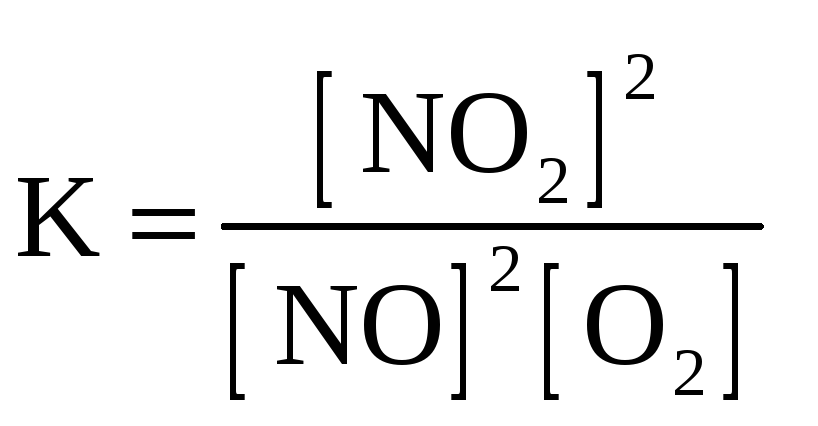 4)
4)
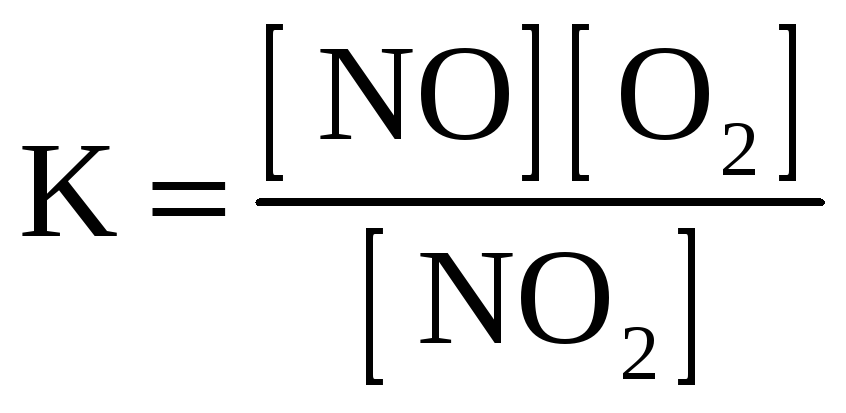 .
.
Исходные концентрации оксида азота (II) и кислорода 0,02 и 0,01 моль/л соответственно, а равновесная концентрация оксида азота (IV) равна 0,015 моль/л. Определите
|
номер правильного выражения константы равновесия |
3 |
|
равновесную концентрацию кислорода |
0,0025 |
3. Для обратимой реакции
H2(г) + I2(г) D 2HI(г)
приведены математические выражения закона действующих масс
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Исходные концентрации водорода и йода равны 0,03 и 0,05 моль/л соответственно, равновесная концентрация йодоводорода 0,02 моль/л. Определите
|
номер правильного выражения константы равновесия |
4 |
|
равновесную концентрацию газообразного йода |
0,04 |
4. В обратимой реакции
2Pb(к) + О2(г) D 2PbO(к)
исходная концентрация O2 равна 5 моль/л; к моменту установления равновесия прореагировало 75 % этого вещества. Вычислите
|
равновесную концентрацию кислорода (моль/л) |
1,25 |
|
константу равновесия |
0,8 |
5. В обратимой реакции
Ni(к) + 4CO(г) D Ni(CO)4(г)
исходная концентрация оксида углерода (II) равна 10 моль/л; к моменту установления равновесия прореагировало 80 % СО. Вычислите
|
равновесную концентрацию СО (моль/л) |
2 |
|
константу равновесия |
0,125 |
6. В состоянии равновесия обратимой реакции
N2(г) + 3H2(г) D 2NH3(г)
концентрации азота, водорода и аммиака равны 3,2; 9,5 и 4 моль/л, соответственно. Вычислите
|
константу равновесия реакции |
0,0058 |
|
исходную концентрацию водорода (моль/л) |
15,5 |
7. В обратимой реакции
CO(г) + H2O(г) D СO2(г) + H2(г)
исходные концентрации оксида углерода (II) и паров воды одинаковы и равны 0,03 моль/л, равновесная концентрация CO2 равна 0,01 моль/л. Вычислите
|
константу равновесия |
0,25 |
|
равновесную концентрацию СО (моль/л) |
0,02 |
8. В обратимой реакции
N2(г) + O2(г) D 2NO(г)
равновесные концентрации газов равны (моль/л): [N2] = 0,03; [O2] = 0,06; [NO] = 0,02. Вычислите
|
константу равновесия реакции |
0,22 |
|
исходную концентрацию азота (моль/л) |
0,04 |
9. При синтезе аммиака
N2(г)+3H2(г) D 2NH3(г)
равновесие установилось при концентрациях веществ (моль/л): [N2] = 2,5; [Н2] = 1,8; [NH3] = 3,6.
Вычислите
|
константу равновесия реакции |
0,89 |
|
исходную концентрацию азота (моль/л) |
4,3 |
10. В обратимой реакции
2SO2(г) + O2(г) D 2SO3(г)
равновесие установилось при следующих концентрациях веществ (моль/л): [O2] = 0,3; [SO2] = 0,7; [SO3] = 0,5. Вычислите
|
константу равновесия реакции |
1,7 |
|
исходную концентрацию кислорода (моль/л) |
0,55 |
11. В обратимой реакции
PCl5(г) D PCl3(г) + Cl2(г)
равновесные концентрации равны (моль/л): [PCl5] = 0,06; [PCl3] = 0,12; [Cl2] = 0,12. Определите
|
константу равновесия реакции |
0,24 |
|
изменение константы равновесия при повышении давления (1 - увеличивается, 2 - уменьшается, 3 - не изменяется) |
2 |
12. В обратимой реакции
2NO(г) + Cl2(г) D 2NOCl(г), ∆H° = –75,4 кДж
исходные концентрации NO и Cl2 равны 0,5 и 0,2 моль/л. К моменту наступления равновесия прореагировало 20 % NO. Определите
|
константу равновесия |
0,417 |
|
факторы, приводящие к смещению равновесия вправо (1 - повышение температуры, 2 - повышение давления, 3 - повышение концентрации хлора, 4 - повышение концентрации NОCl) |
23 |
13. В обратимой реакции
H2(г) + I2(г) D 2HI(г)
исходные концентрации водорода и йода равны 0,02 моль/л, равновесная концентрация йодоводорода равна 0,03 моль/л. Определите
|
константу равновесия реакции |
36 |
|
направление смещения равновесия при введении катализатора (1 – вправо, 2 – влево, 3 – не смещается) |
3 |
14. В обратимой реакции
2SO2(г) + O2(г) D 2SO3(г)
исходная концентрация оксида серы (IV) равна 0,04 моль/л, исходная концентрация кислорода равна 0,02 моль/л, а равновесная концентрация оксида серы (VI) равна 0,03 моль/л. Определите
|
константу равновесия реакции |
1800 |
|
направление смещения равновесия при введении катализатора (1 – вправо, 2 – влево, 3 – не смещается) |
3 |
15. В обратимой реакции
NO2(г) + NO(г) D N2O3(г); ∆H° = –40,4 кДж
исходные концентрации NO2 и NO равны 0,5 и 0,2 моль/л. К моменту наступления равновесия прореагировало 20 % NO. Определите
|
константу равновесия |
0,54 |
|
направление смещения равновесия при увеличении давления (1 – вправо, 2 – влево, 3 – не смещается) |
1 |
16. Для обратимой реакции
PCl5(г) D PCl3(г) + Cl2(г); ∆H° = 92,6 кДж
укажите
|
условия смещения равновесия в сторону прямой реакции (1 - повышение температуры, понижение давления; 2 - повышение температуры и давления; 3 – понижение температуры и давления; 4 – понижение температуры, повышение давления) |
1 |
|
факторы, от которых зависит константа равновесия (1 – концентрация веществ, 2 – присутствие катализатора, 3 – давление, 4 – температура) |
34 |
17. В обратимой реакции
NO2(г) + NO(г) D N2O3(г); ∆H° = –40,4 кДж
равновесные концентрации [NO2] = 0,2 моль/л, [NO] = 0,5 моль/л, [N2O3] = 0,3 моль/л. Определите
|
константу равновесия |
3 |
|
направление смещения равновесия при увеличении концентрации продукта реакции (1 – вправо, 2 – влево, 3 – не смещается) |
2 |
18. В обратимой реакции
СO(г) + Cl2(г) D СOCl2(г)
равновесные концентрации [Сl2] = 0,02 моль/л, [CO] = 0,06 моль/л, [COCl2] = 0,03 моль/л. Определите
|
константу равновесия |
25 |
|
направление смещения равновесия при увеличении концентрации хлора (1 – вправо, 2 – влево, 3 – не смещается) |
1 |
19. Приведено уравнение обратимой реакции
2H2O(г) + C(графит) D CO2(г) + 2H2(г); ∆H0 > 0
и математические выражения закона действующих масс для этой реакции:
1)
![]() 2)
2)
![]() 3)
3)
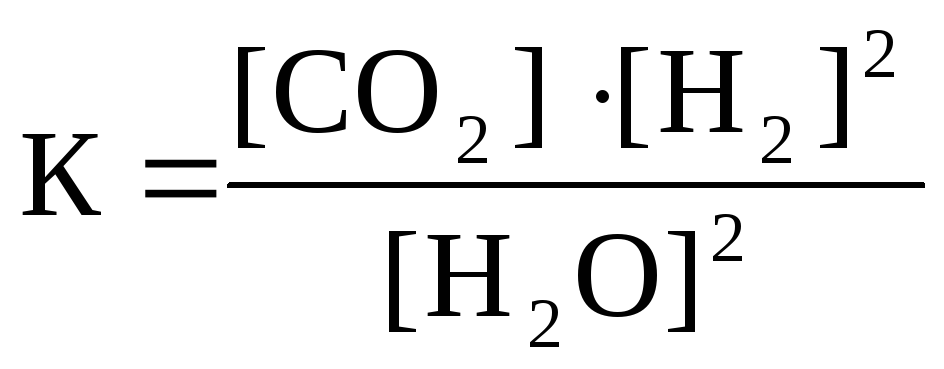 4)
4)
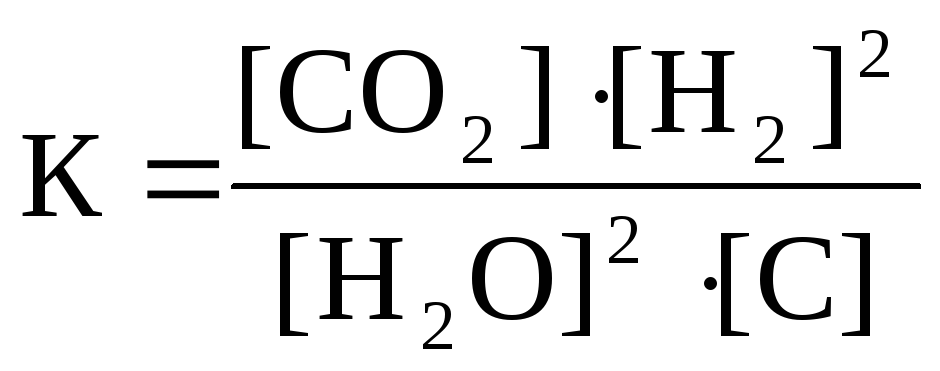 .
.
Укажите
|
номер правильного выражения закона действующих масс |
3 |
|
направление смещения равновесия при повышении температуры (1 - вправо, 2 - влево, 3 - не смещается) |
1 |
20. Приведено уравнение обратимой реакции
C(графит) + 2H2(г) D CH4(г); ∆H° = –74 кДж
и математические выражения закона действующих масс для этой реакции
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения закона действующих масс |
2 |
|
факторы, приводящие к смещению равновесия вправо (1 - повышение температуры, 2 - повышение давления, 3 - увеличение концентрации водорода, 4 - понижение давления) |
23 |
21. Приведено уравнение обратимой реакции
C(графит) + СO2(г) D 2CO(г); ∆H° = 172 кДж
и математические выражения закона действующих масс для этой реакции
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения закона действующих масс |
2 |
|
условия смещения равновесия в сторону прямой реакции (1 - повышение температуры, понижение давления; 2 - повышение температуры, повышение давления; 3 - понижение температуры, понижение давления; 4 - понижение температуры, повышение давления) |
1 |
22. Для обратимой реакции
C(графит) + СO2(г) D 2CO(г); ∆H° = –172 кДж
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения закона действующих масс |
2 |
|
факторы, приводящие к смещению равновесия влево (1 - повышение температуры, 2 - повышение давления, 3 - увеличение концентрации СО2, 4 - уменьшение концентрации СО) |
12 |
23. Для обратимой реакции
MgCO3(к) D MgO(к) + CO2(г), ∆H° = 118 кДж
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения закона действующих масс |
3 |
|
условия смещения равновесия в сторону прямой реакции (1 - повышение температуры, понижение давления, 2 - повышение температуры и давления, 3 - понижение температуры и давления, 4 - понижение температуры, повышение давления) |
1 |
24. Для обратимой реакции
N2(г) + O2(г) D 2NO(г), ∆H° = 180 кДж
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения закона действующих масс |
3 |
|
условия смещения равновесия в сторону прямой реакции (1 - повысить температуру, 2 - повысить концентрацию О2, 3 - понизить температуру, 4 - понизить концентрацию N2) |
12 |
25. Для обратимой реакции
C(графит) + СO2(г) D 2CO(г); ∆H° = -172 кДж
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения закона действующих масс |
2 |
|
условия смещения равновесия вправо (1 – увеличение давления, 2 – уменьшение давления, 3 – введение катализатора, 4 – понижение температуры) |
24 |
26. Для обратимой реакции
SO2(г) + 2СО(г) D 2СО2(г) + S(к); ∆H° = –269,1 кДж
приведены математические выражения закона действующих масс:
1)
![]()
![]() 2)
2)
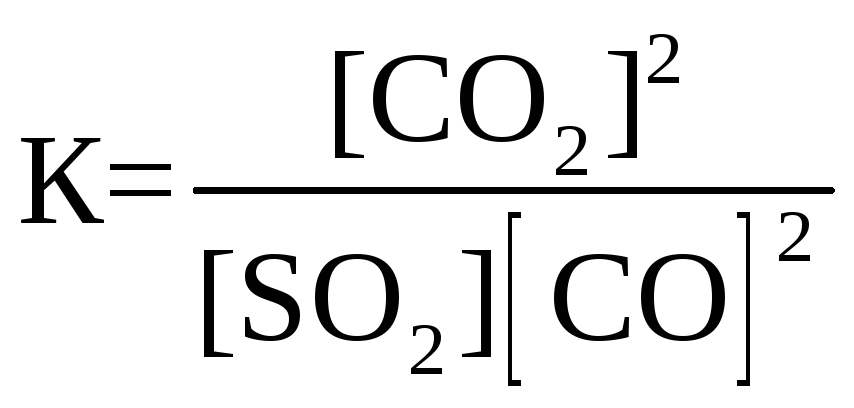 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения константы равновесия |
2 |
|
условия смещения равновесия в сторону продуктов (1 – повышение температуры, 2 – повышение давления, 3 – понижение температуры, 4 – понижение давления) |
23 |
27. Для обратимой реакции
SO2(г) + 2H2S(г) D 2Н2О(г) + 3S(к); ∆H° = –144,7 кДж
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
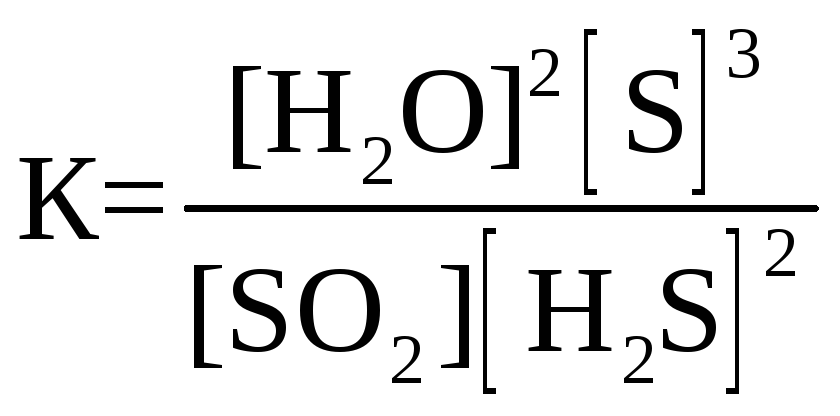 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения константы равновесия |
1 |
|
условия смещения равновесия в сторону продуктов (1 – повышение температуры, 2 – повышение давления, 3 – понижение температуры, 4 – понижение давления) |
23 |
28. Для обратимой реакции
СO2(г) + Мg(к) D MgO(к) + С(графит); ∆H° = –208,3 кДж
приведены математические выражения закона действующих масс:
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения константы равновесия |
1 |
|
направление смещения равновесия при увеличении температуры (1 – вправо; 2 – влево; 3 – не смещается) |
2 |
29. Для обратимой реакции
СaO(к) + 3С(графит) D СО(г) + СaC2(к); ∆H° = –462,2кДж
приведены математические выражения закона действующих масс:
1)
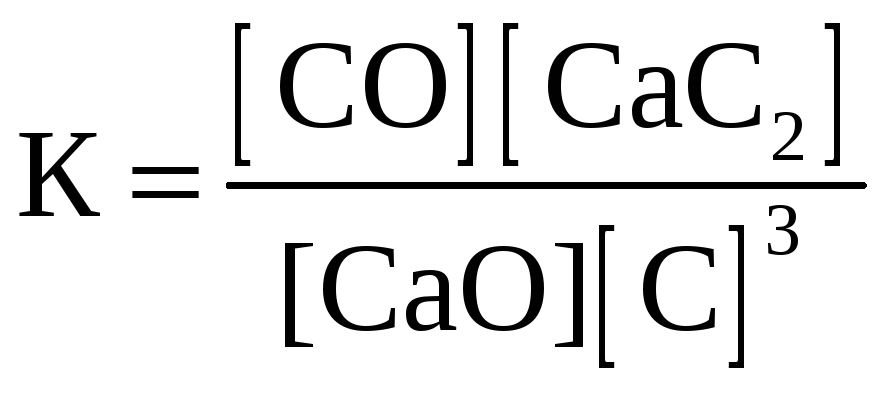 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения константы равновесия |
4 |
|
условия смещения равновесия в сторону реагентов (1 – повышение температуры, 2 – повышение давления, 3 – понижение температуры, 4 – понижение давления) |
14 |
30. Для обратимых реакций
1) H2(г) + I2(г) D 2HI(г) 2) CO(г) + Cl2(г) D COCl2(г)
3) C(графит) + СO2(г) D 2CO(г) 4) N2(г) + 3H2(г) D 2NH3(г)
приведены математические выражения закона действующих масс
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер выражения константы равновесия гетерогенной реакции |
2 |
|
равновесие какой реакции не смещается при изменении давления |
1 |
31. Для обратимой реакции
2NО(г) + O2(г) D N2O4(ж); ∆H° = –199 кДж
приведены математические выражения закона действующих масс
1)
![]() 2)
2)
![]() 3)
3)
![]() 4)
4)
![]() .
.
Укажите
|
номер правильного выражения константы равновесия |
2 |
|
условия смещения равновесия в сторону прямой реакции (1 – повышение температуры, понижение давления; 2 – повышение температуры, повышение давления; 3 – понижение температуры, понижение давления; 4 – понижение температуры, повышение давления) |
4 |
32. Для обратимой реакции
C(графит) + 2Н2(г) D CН4(г)
укажите
|
формулу вещества, которое не входит в выражение константы равновесия |
C |
|
направление смещения равновесия при увеличении давления (1 – вправо, 2 – влево, 3 – не смещается) |
1 |
33. Для обратимой реакции
2NH3(г) + SO3(г) + H2O(г) D (NH4)2SO4(к)
укажите
|
формулу вещества, которое не входит в выражение константы равновесия |
(NH4)2SO4 |
|
направление смещения равновесия при увеличении давления (1 – вправо, 2 – влево, 3 – не смещается) |
1 |
34. Для обратимой реакции
2Н2S(г) + SO2(г) D 3S(к) + 2Н2О(г)
укажите
|
формулу вещества, которое не входит в выражение константы равновесия |
S |
|
направление смещения равновесия при увеличении давления (1 – вправо, 2 – влево, 3 – не смещается) |
1 |
35. Для обратимой реакции
2Н2О(г) + С(графит) D СО2(г) + 2Н2(г); ∆H° > 0
укажите
|
формулу вещества, которое не входит в выражение константы равновесия |
C |
|
смещение равновесия при одновременном повышении температуры и понижении давления (1 – влево, 2 – вправо, 3 – не смещается) |
2 |
36. Для обратимой реакции
СаСO3(к) D СаО(к) + CO2(г); ∆H° = 177,5 кДж
укажите направление смещения равновесия (1 - влево, 2 – вправо, 3 - не смещается)
|
при повышении температуры |
2 |
|
при увеличении давления |
1 |
37. Для обратимой реакции
CO2(г) + Н2(г) D CО(г) + Н2О(г); ∆H° = 41,2 кДж
укажите направление смещения равновесия (1 – вправо, 2 – влево, 3 – не смещается)
|
при понижении температуры |
2 |
|
при увеличении давления |
3 |
38. Укажите реакции
1) 2CO(г) + O2(г) D 2CO2(г); ∆H° = –566 кДж
2) N2(г) + O2(г) D 2NO(г); ∆H° = 180 кДж
3) N2(г) + 3H2(г) D 2NH3(г); ∆H° = –92 кДж
4) 4HCl(г) + O2 D 2Cl2(г) + 2H2O(г); ∆H° = –116 кДж
равновесие которых смещается влево
|
при понижении температуры |
2 |
|
при понижении давления |
134 |
39. Укажите, равновесие каких реакций
1) N2(г) + 3H2(г) D 2NH3(г); ∆Н° = –92 кДж
2) N2(г) + O2(г) D 2NO(г); ∆Н° = 180 кДж
3) H2(г) + Cl2(г) D 2HCl(г); ∆Н° = –183 кДж
4) C2H2(г) D 2C(графит) + H2(г); ∆Н° = –227 кДж
|
смещается вправо при одновременном повышении давления и понижении температуры |
1 |
|
не смещается при изменении давления |
234 |
40. Для обратимой реакции
2SO2(г) + О2(г) D 2SO3(г); ∆H° = –198 кДж
укажите направление смещения равновесия (1 – вправо; 2 – влево; 3 – не смещается) при увеличении
|
температуры |
2 |
|
давления |
1 |
41. Для обратимой реакции
FeO(к) + CО(г) D Fe(к) + CO2(г); ∆H° = –18,2 кДж
укажите направление смещения равновесия (1 – вправо; 2 – влево; 3 – не смещается) при повышении
|
температуры |
2 |
|
давления |
3 |
42. Укажите реакции
1) FeO(к) + CО(г) D Fe(к) + CO2(г); ∆H° = –18,2 кДж
2) SO2(г) + Cl2(г) D SO2Cl2(г); ∆H° = –17,7 кДж
3) 3O2(г) D 2O3(г) ; ∆H° = 248,6кДж
4) CaCO3(к) D CaO(к) + CO2(г); ∆H° = 571,4кДж
равновесие которых смещается в сторону образования продуктов при повышении
|
температуры |
34 |
|
давления |
23 |
43. Для обратимой реакции
Fe3O4(к) + 4CO(г) D 3Fe(к) + 4CO2(г); ∆Нº = – 14 кДж
укажите направление смещения равновесия (1 – влево, 2 – вправо, 3 - не смещается)
|
при понижении температуры |
2 |
|
при уменьшении давления |
3 |
44. Укажите реакции
1) NH3(г) + HCl(г) D NH4Cl(к); ∆H°<.0
2) N2(г) + O2(г) D 2NO(г); ∆H°>0
3) СO(г) + H2O(г) D СO2(г) + H2(г); ∆H°<0
4) 2NO(г) + O2(г) D 2NO2(г); ∆H°<0
равновесие которых смещается в сторону продуктов при повышении
|
температуры |
2 |
|
давления |
14 |
45. Укажите реакции
1) CH4(г) + 2O2(г) D CO2(г) + 2H2O(г); ∆H° < 0
2) CaCO3(к) D CaO(к) + CO2(г); ∆H° > 0
3) 2Fe(к) + 3CO2(г) D Fe2O3(к) + 3С(к); ∆H° > 0
4) 2FeCl2(к) + Cl2(г) D 2FeCl3(к); ∆H° < 0
равновесие которых смещается в сторону реагентов при повышении
|
температуры |
23 |
|
давления |
34 |
46. Укажите, равновесие каких реакций
1) 4NO2(г) + O2(г) + 2H2O(ж) D 4HNO3(ж); ∆Н°= –256 кДж
2) 2H2(г) + O2(г) D 2H2O(г); ∆Н° = –483,6 кДж
3) N2(г) + O2(г) D 2NO(г); ∆H° = 180 кДж
4) I2(к) + H2S(г) D 2HI(г) + S(к); ∆Н° = 30 кДж
смещается в сторону реагентов
|
при повышении температуры |
12 |
|
при уменьшении давления |
12 |
47. Укажите, равновесие каких реакций
1) 2H2(г) + O2(г) D 2H2O(г); ∆Н° = –484 кДж
2) N2(г) + O2(г) D 2NO(г); ∆H° = 180 кДж
3) I2(к) + H2S(г) D 2HI(г) + S(к); ∆Н° = 30 кДж
4) СО(г) + Н2О(г) D СО2(г) + Н2(г); ∆Н° = -43 кДж
|
не зависит от изменения давления |
24 |
|
смещается в сторону реагентов при повышении температуры |
23 |
48. Для обратимой реакции
4HCl(г) + O2(г) D 2Cl2(г) + 2H2O(г), ∆H° = –116 кДж
укажите направление смещения равновесия (1 – вправо; 2 – влево; 3 – не смещается) при повышении
|
температуры |
2 |
|
концентрации хлороводорода |
1 |
49. Для обратимой реакции
2CO(г) + O2(г) D 2CO2(г), ∆H° < 0
укажите направление смещения равновесия (1 – вправо; 2 – влево; 3 – не смещается) при повышении
|
температуры |
2 |
|
концентрации кислорода |
1 |
50. Укажите, равновесие каких реакций
1) 2CO(г) + O2(г) D 2CO2(г); ∆H° = –566 кДж
2) N2(г) + O2(г) D 2NO(г); ∆H° = 180 кДж
3) N2(г) + 3H2(г) D 2NH3(г); ∆H° = –92,4 кДж
4) 4HCl(г) + O2(г) D 2Cl2(г) + 2H2O(г); ∆H° = –116,4 кДж
смещается в сторону образования продуктов
|
при повышении температуры |
2 |
|
при увеличении давления |
134 |
