
- •§ 1.1. Микро- и макросистемы. Основной постулат равновесных систем
- •§ 1.2. Система с постоянной энергией. Каноническое распределение
- •§ 1.3. Условие равновесия системы. Аддитивность энтропии
- •§ 1.4. Первое начало термодинамики. Формула Клазиуса
- •1.5. Энтропия системы по Больцману
- •§ 1.6. Системы с переменным числом частиц. Большое каноническое распределение
- •§ 1.7. Равновесие систем с переменным числом частиц
- •§ 1.8. Основное термодинамическое тождество
- •§ 2.1. Распределения Ферми-Дирака и Бозе-Эйнштейна
- •§ 2.2. Статистика идеального электронного газа
- •§ 2.3. Равновесное электромагнитное излучение. Идеальный фотонный газ
- •§ 2.4. Абсолютно черное тело
- •§ 2.5. Энергия твердых тел. Идеальный фононный газ
- •§ 2.6. Каноническое распределение в классическом приближении. Распределение Максвелла и Больцмана
- •§ 2.7. Свойства распределения Максвелла
- •§ 2.8. Идеальный одноатомный газ. Энергия и уравнения состояния
- •§ 2.9. Теорема о равномерном распределении. Многоатомный идеальный газ
- •§ 2.10. Условие применимости классического приближения и вырождения идеального газа
- •§ 2.11. Теплоемкость газов и твердых тел
§ 2.11. Теплоемкость газов и твердых тел
Если система в результате процессов получает некоторое количество тепла σQ, то теплоемкость равна
с = σQ/dT
dT – изменение температуры системы при этом процессе
Очевидно, что теплоемкость системы зависит от процесса. В газах обычно различают теплоемкость при постоянном объеме cV и при постоянном давлении cp. Из первого начала термодинамики
d<E> = σQ + σA
σQ = d<E> - σA
Тогда для идеального газа σA = - pdV
cV = σQ/ dT = d<E>/dT
<E> = (3/2)NkT
cV = (3/2)Nk
Если газ многоатомный, то

Вычислим cp при постоянном давлении
cp = σQ/dT = d<E>/dT - σA/dT
σA = - pdV
pV = NkT
cp = cV + Nk
Рассмотрим теплоемкость твердых тел. Твердое тело можно представить, как некоторый замкнутый объем, в котором находится электронный и фононный газ. Фононный газ описывает поведение кристаллической решетки. Теплоемкость твердого тела будет равна сумме теплоемкостей фононного и электронного газа. Рассмотрим теплоемкость твердого тела. Как было показано в § 2.5, энергия фононного газа зависит от температуры.
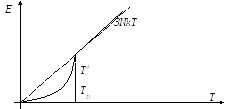
T >> Tb → <E> = 3NkT → cV = 3Nk
T << Tb → <E> = σT4 → cb = 4 σT3

Рассмотрим теплоемкость электронного газа
<E> = ∫Ef<E>dE
f(E) = g(E)<Ne> = c0(E)1/2/(e(E-μ)/kT + 1)
cV = ∂<E>/∂T = ∫E∂fdE/∂T
<N> = ∫fdE
∂N/∂T = ∫∂fdE/∂T = 0
cV = ∫(E – EF)∂f/∂T = ∫(E – EF) g(E) [e(E-μ)/kT(E-μ)/(e(E-μ)/kT + 1)2kT2]dE
Рассмотрим функцию
e(E-μ)/kT/(e(E-μ)/kT + 1)2= <Ne>(1 - <Ne>) = (e(E-μ)/kT + 1 )-1[1 - (e(E-μ)/kT + 1 )-1]
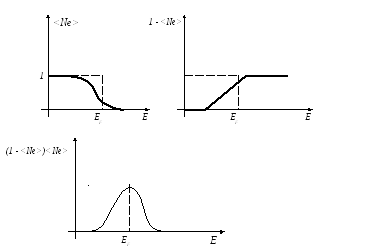
Если рассмотреть случай низких температур, то полученное выражение будет отлично от нуля лишь в очень узкой области значений энергии вблизи EF. Поэтому значения энергий в подынтегральном выражении должны быть близки к EF, а химический потенциал при низких температурах μ ≈ EF.
cV = g(EF)(1/KT2)∫[(E - EF)2 e(E-μ)/kT/(e(E-μ)/kT + 1)2]dE = αT
α = const
Таким образом, при низких температурах, когда T << TF, cV = αT
При высоких температурах, T >> TF, можно пользоваться классическим приближением и рассматривать электроны, как одноатомный идеальный газ, средняя энергия которого <E> = 3NkT/2, cV = 3Nk/2.
