
Положение р-металлов в периодической системе
р-Металлы находятся в главных подгруппах III – VI групп, конфигурации их внешних энергетических уровней: ns2np1, ns2np2, ns2np3, ns2np4.
В главных подгруппах при переходе сверху вниз устанавливается низшая степень окисления. Поэтому для таллия устойчивой будет степень окисления +1, для свинца +2, висмута +3, а для полония +2. Наиболее технически важные p-металлы это алюминий, олово и свинец.
Алюминий является самым распространенным элементом среди металлов. Занимает третье место по распространенности, уступая только кислороду и кремнию. На его долю приходится 8,8% от массы земной коры. Находится в природе исключительно в виде соединений.
Получают алюминий электролизом расплавленной смеси глинозема Al2O3 и криолита Na3[AlF6].
Физические и химические свойства. Алюминий - серебристо-белый, легкий (=2,7 г/см3), пластичный металл, легко вытягивается в проволоку, прокатываются в тонкие листы (tпл.= 660C), обладает высокой тепло- и электропроводностью.
Алюминий относится к числу химически активных металлов (стандартный электродный потенциал его равен -1,66В) и уже при комнатной температуре взаимодействует с хлором и бромом, а при нагревании с йодом большинством неметаллов:
2Al + 3Cl2 = 2AlCl3 (хлорид алюминия)
2Al + N2 −8000→ 2AlN (нитрид алюминия)
2Al + 3S −10000→ Al2S3 (сульфид алюминия)
4Al + C −20000→ Al4C3 (карбид алюминия)
2А1 + 6Н2О = 2А1(ОН)3 + ЗН2
Алюминий – амфотерный металл, способный растворяться в кислотах щелочах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
При взаимодействии с кислородом воздуха алюминий покрывается тонкой пленкой Al2O3, защищающей его от коррозии, поэтому он устойчив в атмосфере. Вследствие образования пленки (пассивирования) алюминий устойчив в концентрированных растворах азотной и серной кислот.
Олово и свинец расположены в IVA группе и имеют на внешнем уровне 4 электрона ns2np2. Для олова наиболее устойчива степень окисления +4, менее устойчива +2. Поэтому соединения Sn(П) являются энергичными восстановителями. Для свинца наиболее устойчива степень окисления +2, и менее характерна +4, вследствие чего соединения Pb(IV) являются окислителями.
Физические и химические свойства. Олово серебристо-белый мягкий металл, легко прокатывается в тонкие листы. Свинец – голубовато-белый тяжелый металл, очень мягкий и режется ножом. Олово и свинец - легкоплавкие металлы (tпл.= 2320 и 3270С соответственно). При комнатной температуре на воздухе олово не окисляется, а свинец покрывается защитной оксидной пленкой, вода практически не действует на эти металлы. Олово очень медленно растворяется в разбавленных HCl и H2SO4 с образованием Sn2+ и выделением водорода, а свинец в этих кислотах почти не растворяется, так как покрывается нерастворимыми продуктами окисления PbCl2 и PbSO4. В концентрированной HCl эти металлы растворяются с образованием хлорокомплексов:
М + 4HCl (конц.) = Н2[MCl4] + H2
Концентрированная H2SO4 окисляет олово в Sn(SO4)2, а свинец в Pb(HSO4)2; Н2SO4 при этом восстанавливается в SO2. Разбавленной HNO3 олово и свинец окисляются в нитраты М(NO3)2, восстанавливая HNO3 в NO. Концентрированная HNO3 переводит олово в оловянную кислоту H2SnO3, а свинец – в соль Pb(NO3)2, HNO3 восстанавливается до NO2.
Sn + 4HNO3 = H2SnO3↓ + 4NO2 + H2O
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 + 2H2O
При нагревании олово и свинец растворяются в водных растворах щелочей:
М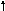 + 2NaOH + 2H2O
= Na2[M(OH)4]
+ H2
+ 2NaOH + 2H2O
= Na2[M(OH)4]
+ H2
Так как для олова наиболее устойчивыми являются соединения со степенью окисления +4, то соединения Sn (II) являются восстановителями. Например,
3SnCl2 + 2Bi(NO3)3 + 18KOH = 2Bi + 3K2SnO3 + 6KCl + 6KNO3 + 9H2O
Для свинца, наоборот, наиболее типичны соединения со степенью окисления +2. Вследствие этого соединения Pb (IV) проявляют себя как окислители:
5PbO2 + 2MnSO4 + 6HNO3 = 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 +2H2O
Большинство солей олова хорошо растворимо в воде. Соли свинца, за исключением Pb(NO3)2 и Pb(CH3CОО)2, мало растворимы в воде. Из нерастворимых солей наиболее характерны PbI2 – золотистого цвета, PbSO4 – белого цвета, PbCrO4 – жёлтого цвета.
Лекция № 16. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИИ d-МЕТАЛЛОВ
Положение d-металлов в периодической системе
К d-электронному семейству относятся металлические элементы, в атомах которых формируется d-орбитали предвнешнего энергетического уровня. Эти элементы находятся в больших периодах, побочных подгруппах. Они располагаются между s- и p-элементами и называются переходными.
В отличие от s- и p-элементов, валентные электроны которых находятся на внешнем энергетическом уровне, у d-элементов валентные электроны располагаются на ns- и (n-1)d-орбиталях. Постоянную степень окисления (+3) имеют элементы подгруппы скандия (Sc, Y, Lа). Остальные d-элементы переменновалентны.
В побочных же подгруппах с возрастанием порядкового номера элемента повышается устойчивость соединений в высшей степени окисления. Так соединения хрома (VI), марганца (VII) – сильные окислители, а для соединений молибдена (VI), вольфрама (VI), технеция (VII), рения (VII) окислительные свойства не характерны.
Распространенность d-металлов в земной коре
Самым распространенным элементом среди d-металлов является железо. Его содержание в земной коре составляет 4% (масс), и это определяет его четвертое место после кислорода, кремния и алюминия. Элементами средней распространенности являются почти все d-металлы четвертого периода: Ti, V, Сr, Мn, Со, Ni, Cu, Zn. К редким элементам относятся: Sc, Y, La, Zr, Нf, Мо, W, Ru, Оs, Rh, Ir, Рd, Pt, Ag, Аu, Нg. Редким и рассеянным является рений. Этот металл не имеет собственных месторождений и обычно сопутствует рудам молибдена, меди, платины. К рассеянным элементам принадлежат V, Nb, Та, Сd. В земной коре не встречается технеций.
Основными формами нахождения в природе d-металлов III, IV, V, VI, VII побочных подгрупп являются кислородные соединения. Металлы VIII, I и II побочных подгрупп встречаются главным образом в виде сульфидов или в самородном состоянии. Самородными металлами являются платиновые металлы, медь, серебро, золото, ртуть. Железо, медь и цинк образуют также и кислородные соединения.
Получение d-металлов
В настоящее время d-металлы получают из руд. После обогащения руды для восстановления металлов используют пирометаллургию, гидрометаллургию и электролиз. Пирометаллургическим путем получают цинк, ртуть, молибден, титан, хром, ванадий, марганец, железо.
Гидрометаллургические процессы применяют для вытеснения металла из водного раствора более активным металлом. Этот способ используют для извлечения серебра, золота, меди, кадмия:
CuSO4 + Zn → Cu + ZnSO4.
Электролизом расплавов фторидов и хлоридов получают активные d-металлы (Sc, Y, La). При электролизе расплавов К2NbF7 и К2ТаF7 получают соответственно ниобий и тантал. Электролизом водных растворов солей получают марганец, медь, цинк, кадмий.
Физические свойства d-металлов
Все d-металлы обладают электро- и теплопроводностью. Максимальную электро- и теплопроводность имеют серебро, медь и золото.
К легким d-металлам относятся Sc, Y, Тi, плотность которых равна соответственно 3,02; 4,47; 4,51 г/см3. Остальные металлы тяжелые. Максимальную плотность имеет осмий (ρ=22,6 г/см3). В подгруппах сверху вниз плотность увеличивается, самые тяжелые металлы в шестом периоде.
Температура плавления металлов имеет периодическую зависимость от порядкового номера элемента. В каждом периоде температура плавления вначале увеличивается, а затем падает. Максимальную температуру плавления имеют металлы шестой побочной подгруппы: Сr, Мо, W. Легкоплавкими металлами являются металлы подгруппы цинка. Минимальную температуру плавления имеет ртуть (tпл=-39°С), поэтому ртуть при обычных условиях жидкая. Максимальная температура плавления у вольфрама – 3380ºС.
Химические свойства d-металлов.
Отношение к кислороду. При взаимодействии с кислородом d-элементы образуют тугоплавкие, не растворимые в воде оксиды. Исключение составляют СrО3, Мn2O7, Tc2O7, Re2O7, RuO4 и OsO4, которые, растворяясь в воде, образуют кислоты:
CrO3 + H2O → H2CrO4
Re2O7 + H2O → 2HReO4
Оксиды и гидроксиды d-элементов в низших степенях окисления проявляют, главным образом, основные свойства (MnO, Mn(OH)2, FeO, Fe(OH)2), а высших степенях окисления – кислотные (MoO3, H2MoO4, Mn2O7, HMnO4). Амфотерные свойства проявляют оксиды и гидроксиды d-металлов в промежуточных степенях окисления (Сr2O3, Cr(OH)3, V2O3, V(OH)3). В подгруппах сверху вниз кислотный характер оксидов уменьшается, а основной – усиливается. Например, в ряду СrО3 – МоО3 – WO3 кислотные свойства ослабляются. В ряду ZnO – CdO – HgO амфотерным является оксид цинка, а СdO, HgO – основные оксиды.
Отношение к воде, кислотам и щелочам. Подавляющее большинство d-металлов с водой не реагируют, т.к. имеют положительное значение стандартного электродного потенциала. С водой и с разбавленными кислотами взаимодействуют металлы, имеющие отрицательное значение стандартного электродного потенциала. Это прежде всего элементы подгруппы скандия, которые в периодах располагаются сразу после щелочноземельных металлов. Иттрий и лантан медленно реагируют с водой:
2Y + 6H2O → 2Y(OH)3 +3H2.
Скандий с водой не реагирует из-за образования малорастворимой оксид- гидроксидной пленки. С водяным паром при высокой температуре взаимодействуют Fe, Co, Ni и Ti:
3Fe + 4H2O ↔ Fe3O4 + 4H2
Ti + 2H2O → TiO2 + 2H2.
В соляной и разбавленной серной кислотах растворяются с выделением водорода металлы подгруппы скандия, кадмий и все металлы четвертого периода за исключением меди:
2Sc + 6HCl → 2ScCl3 + 3H2
2Ti + 3H2SO4 → Ti2(SO4)3 + 3H2
Fe + H2SO4 → FeSO4 + H2
Zn + H2SO4 → ZnSO4 +H2.
Плавиковая кислота способна перевести Ti, Zr, Hf и V в водорастворимые комплексные кислоты:
2Ti + 12HF → 2H3[TiF6] + 3H2
Zr + 6HF → H2[ZrF6] + 2H2
2V + 12HF → 2H3[VF6] + 2H2.
В азотной кислоте растворяются Сu, Ag, Hg, Pd и металлы подгруппы марганца. В связи с тем, что в побочных подгруппах сверху устанавливается устойчивое состояние, в котором элемент имеет высшую степень окисления, растворение в разбавленной азотной кислоте проходит с образованием устойчивых соединений Мn(II), Tc(VII) и Re(VII):
3Mn + 8HNO3 → 3Mn(NO3)2 + 2NO + 4H2O
3Re + 7HNO3 → 3HReO4 + 7NO + 2H2O.
В холодных концентрированных азотной и серной кислотах пассивируются за счет пленок Mn, Tc, Re, Ti, Zr, Hf, Ta, Nb, Fe, Сr, Mo, W.
Металлы, которые не растворяются в кислотах-окислителях, растворяются в различных смесях кислот, например:
3Ta + 5HNO3 + 21F → 3H2[TaF7] + 5NO + 10H2O
Mo + 8HF + 2HNO3 → H2[MoF8] + 2NO + 4H2O
3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O.
Известно, что амфотерные металлы реагируют с водными растворами щелочей. Среди d-металлов типичным амфотерным элементом является цинк, поэтому он растворяется в водном растворе щелочи по уравнению реакции:
Zn + 2H2O + 2NaOH → Na2[Zn(OH)4 + H2.
Остальные d-металлы с водными растворами щелочей не взаимодействуют, но в присутствии окислителей (О2, KNO3, КСlO3) некоторые из них вступают в реакции с расплавами щелочей:
Mo + 3NaNO3 + 2NaOH → Na2MoO4 + 3NaNO2 + H2O
Окислительно- восстановительные свойства d-металлов
Все d-металлы, за исключением элементов подгруппы скандия, имеют переменную степень. Поэтому соединения таких металлов выступают как в роли типичных окислителей и восстановителей, так и проявляют окислительно-восстановительную двойственность. Восстановительная активность элементов в одной и той же степени окисления в пределах каждого периода снижается: так, если Ti2+ – энергичный восстановитель, Zn2+ восстановителем не является 2TiO + 3H2SO4 → Ti2(SO4)3 + H2 + 2H2O
ZnO + H2SO4 → ZnSO4 + H2O.
Наоборот, при максимальной степени окисления окислительная активность растет. Например, соединения титана (IV) и ванадия (V) – слабые окислители, а соединения хрома (VI) и марганца (VII) – сильные окислители:
TiO2 + 2HCl → TiOCl2 + H2O
V2O5 + 6HCl → 2VOCl3 + 3H2O
4CrO3 + C2H5OH → 2Cr2O3 + 2CO2 + 3H2O
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Изменение окислительно-восстановительных свойств происходит с увеличением степени окисления у одного и того же d-элемента. Например, для соединений марганца (II) восстановительные свойства не характерны:
MnO + H2SO4 → MnSO4 +H2O.
Соединения марганца (IV) проявляют окислительно-восстановительную двойственность:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
MnO2 + Br2 + 4KOH → K2MnO4 + 2KBr + 2H2O.
Соединения же марганца (VII) – сильные окислители:
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
Все d – элементы образуют комплексные соединения. Комплексными соединениями называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию, как в кристаллах, так и в растворах.
В молекуле комплексного соединения один атом или ион, обычно положительно заряженный, занимает центральное место и называется комплексообразователем. В непосредственной близости к нему расположены или координированы противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом. Чаще всего координационное число равно 6, 4 и 2. В формулах комплексных соединений внутреннюю сферу обозначают квадратными скобками. Все остальные ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу.
Все d – элементы являются прекрасными комплексообразователями. Склонность к комплексообразованию объясняется наличием у атомов и ионов d-элементов свободных атомных орбиталей внешнего и предвнешнего энергетического уровня. Они могут образовывать нейтральные, катионные и анионные комплексы, например: [Mn(CO)5], [Cu(NH3)4]SO4, K3[Fe(CN)6].
Лекция № 17. ОБЩАЯ ХАРАКТЕРИСТИКА НЕМЕТАЛЛОВ
Положение неметаллов в периодической системе. К неметаллам относятся 22 элемента. В периодической системе неметаллы расположены в главных подгруппах I, III – VIII групп. Все они (за исключением водорода и гелия) относятся к р-элементам.
Распространенность неметаллов в земной коре. Неметаллов немного, но они являются основными составляющими окружающего мира: основными составными частями воздуха являются кислород, азот, углекислый газ; земная кора на ¾ состоит из кислорода и кремния; в состав живых существ входят кислород (70%), углерод (18%), водород (11%), а также азот, фосфор, хлор, сера кремний.
Физические свойства. Неметаллы не имеют характерного блеска и различно окрашены. Не проводят электрический ток и тепло, у них отсутствует ковкость, тягучесть и т.д. Эти свойства обусловлены отсутствием в неметаллах делокализованных электронов (электронного газа).
Общие химические свойства неметаллов. У неметаллов, кроме водорода гелия, на внешнем уровне содержится от 3 до 7 электронов и потому они склонны принимать электроны до полного заполнения внешних орбиталей, проявляя окислительные свойства. Самым сильным окислителем является фтор. Практически фтор разрушает все обычные материалы (стекло, сталь, керамику), он непосредственно взаимодействует со всеми простыми веществами, кроме кислорода, азота и углерода (в виде алмаза). Кроме F2 сильными окислителями являются O2, Cl2, Br2. Окислительная способность в ряду F2 > O2 > Cl2 > Br2 убывает. Только окислителем является один фтор, а остальные неметаллы, проявляя главным образом окислительные свойства, могут быть и восстановителями.
Преимущественно восстановительные свойства проявляют H2,B, C, Si, P. Примерно одинаковыми свойствами окислителей и восстановителей обладают N2, S, Se. Для них характерны реакции диспропорционирования:
3S + 6KOH = 2K2S + K2SO3 + 3H2O
Все неметаллы, кроме галогенов, непосредственно взаимодействуют с кислородом, образуя кислотные оксиды. Кислотным оксидам соответствуют кислоты. При переходе слева направо в периоде уменьшается, сила кислот увеличивается. При переходе сверху вниз в группе сила кислот уменьшается.
Если взять один и тот же кислотообразующий элемент, например Cl2, то с увеличением степени окисления Cl2, сила кислот и устойчивость увеличивается, а окислительная способность уменьшается.
Все неметаллы, кроме кислорода, с водородом образуют газообразные гидриды, причем галогены, O2, S, Se, Te, N2, C могут соединяться с водородом непосредственно, для остальных неметаллов гидриды получают косвенным путем: Mg2Si + 2H2SO4 = SiH4 + 2MgSO4
В гидридах степень окисления неметаллов имеет отрицательное значение, поэтому все они являются восстановителями. При переходе сверху вниз в подгруппе устойчивость соединений с отрицательной степенью окисления уменьшается, а восстановительная способность увеличивается. Например, HI- менее устойчивое соединение и более сильный восстановитель, чем HCl-1.
В водных растворах гидриды могут быть сильными кислотами (HCl, HBr, HI), кислотами средней силы (HF), слабыми кислотами(H2S, H2Se, H2Te), а раствор NH3 представляет собой слабое основание NH4OH. Гидриды PH3, AsH3, CH4 по отношению к воде безразличны, а SiH4, B2H6 водой разлагаются: SiH4 + H2O + 2KOH = K2SiO3 + 4H2
B2H6 + 6H2O = 2H3BO3 + 6H2
