
Факторы, влияющие на смещение равновесия
1. Давление (характерно для газов). Увеличение давления смещает равновесие в сторону реакции, идущей с уменьшением числа молекул газа, т.е. в сторону понижения давления. Например, в реакции 2SO2 + O2 ↔ 2SO3 в левой части уравнения 3 молекулы газа, а в правой – 2, поэтому при повышении давления равновесие смещается вправо.
2. Температура. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции, понижение – в сторону экзотермической реакции. Например, в равновесной системе N2 + 3H2 ↔ 2NH3, ∆H0 = - 92 кДж повышение температуры приводит к смещению равновесия в сторону обратной (эндотермической) реакции, понижение – в сторону прямой (экзотермической) реакции.
3. Концентрация. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Уменьшение концентрации исходных веществ и увеличение концентрации продуктов реакции смещает равновесие в сторону обратной реакции. Например, в реакции 2NO + O2 ↔ 2NO2 увеличение концентрации NO и O2 или уменьшении концентрации NO2 приводит к смещению равновесия в сторону прямой реакции. Увеличение концентрации NO2 – в сторону обратной реакции.
Фазовые равновесия
Равновесие
процесса перехода вещества из одной
фазы в другую без изменения химического
состава называется
фазовым
равновесием.
Например: Твердое вещество
![]() Жидкость
Жидкость
![]()
Жидкость
![]() Пар
Пар
![]()
Для фазового равновесия также соблюдается принцип Ле Шателье. Соответственно при повышении температуры равновесие смещается в сторону эндотермического процесса, например, плавления или испарения. С увеличением давления равновесие сдвигается в сторону процессов, при которых газ или пар превращается в жидкое или твердое состояние.
К наиболее общим законам гетерогенного равновесия относится правило фаз, согласно которому число степеней свободы С, фаз Ф, независимых компонентов К и внешних условий n, влияющих на равновесие, связано соотношением
С + Ф = К + n
Фаза – это часть системы, однородная во всех ее точках по химическому составу и свойствам и отделенная от всех других фаз системы поверхностью раздела. Компонент – это химически однородная составная часть вещества, которая может быть выведена из системы. В случае фазового равновесия число независимых компонентов равно общему числу компонентов, при протекании химических реакций - общему числу компонентов за вычетом числа химических реакций, связывающих эти компоненты. Число степеней свободы – это число внешних условий, которые можно менять в определенных пределах без изменения числа и вида фаз.
Лекция № 8. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
Раствор – это гомогенная система, состоящая из двух и более компонентов, относительные количества которых могут изменяться в широких пределах. Вещество, взятое в избытке и служащее средой, в которой идет растворение, называется растворителем. Вещество, которое растворяется, называется растворяемым веществом.
Растворимость .Способность одного вещества растворяться в другом называется растворимостью. Количественной характеристикой растворимости является коэффициент растворимости, который выражается массой безводного вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора.
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления (для газов):
1. Природа растворяемого вещества.
Кристаллические вещества подразделяются на хорошо растворимые (более 1,0 г на 100 г воды); малорастворимые (0,1 г - 1,0 г на 100 г воды); практически нерастворимые (менее 0,1 г на 100 г воды). Если газ химически взаимодействуют с водой, его растворимость велика (HCl, NH3, CO2), если не взаимодействует – растворимость незначительна (O2, H2).
2. Природа растворителя
При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества хорошо растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества – наоборот.
3.Температура
Если ∆Нрастворения < 0, то при увеличении температуры равновесие смещается влево и растворимость твердого вещества в воде уменьшается. Если ∆Нраств > 0, то при увеличении температуры равновесие смещается вправо и растворимость увеличивается.
Растворимость газов в воде – процесс экзотермический, поэтому с повышением температуры растворимость газов уменьшается, а с понижением – увеличивается.
4. Давление
С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Способы выражения состава растворов. Важной характеристикой любого раствора является его состав, который определяется количеством растворенного вещества и растворителя. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называется концентрацией.
Молярная концентрация вещества или молярность (сВ или М) – отношение количества растворенного вещества к объему раствора:
![]() ,
моль/л,
,
моль/л,
где mB – масса вещества, г; МВ –молярная масса вещества, г/моль; V – объем раствора, л.
Молярная
концентрация эквивалентов вещества
или нормальность
(![]() (В)
или н.) – отношение количества эквивалентов
растворенного вещества к объему раствора:
(В)
или н.) – отношение количества эквивалентов
растворенного вещества к объему раствора:
![]()
![]() ,
моль/л,
,
моль/л,
где mB – масса вещества, г; Мэ(В) – молярная масса эквивалентов вещества, г/моль; V – объем раствора, л.
Моляльная концентрация вещества или моляльность (сm(В)) – отношение количества растворенного вещества к массе растворителя:
![]() ,
моль/кг,
,
моль/кг,
где mB – масса растворенного вещества, г; mS – масса растворителя, г; МВ – молярная масса растворенного вещества, г/моль.
Массовая доля вещества (ω) – отношение массы растворенного вещества к массе раствора. Массовую долю выражают в долях или процентах:
![]()
![]() ,
,
где mB – масса растворенного вещества, г; m – масса раствора, г.
Молярная (мольная) доля вещества (хВ) – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, содержащихся в растворе:
![]() ,
,
где хB – молярная доля растворенного вещества, nB – количество растворенного вещества; nS – количество растворителя.
![]() ,
,
где хS – молярная доля растворителя, nB и nS – количества растворенного вещества и растворителя.
Общие свойства растворов. Разбавленные растворы проявляют ряд общих свойств: осмотическое давление, температуры замерзания и кипения. Эти свойства рассматривают при допущении, что молекулы растворенного вещества и растворителя не взаимодействуют друг с другом (растворы неэлектролитов).
Односторонняя диффузия молекул растворителя через полупроницаемую перегородку называется осмосом. Сила, обусловливающая осмос, называется осмотическим давлением. Величина осмотического давления зависит от концентрации раствора и его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. Зависимость осмотического давления от температуры и концентрации раствора выражается законом Вант-Гоффа: π = cB RT,
где π – осмотическое давление раствора, кПа; сВ – его молярная концентрация, моль/л; R – универсальная газовая постоянная; T – абсолютная температура раствора.
При данной температуре давление насыщенного пара над жидкостью – величина постоянная. При растворении в жидкости какого-либо вещества давление насыщенного пара над жидкостью понижается. В разбавленных растворах неэлектролитов при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества (закон Рауля):
![]() ,
,
где р0 – давление насыщенного пара над чистым растворителем; р – давление пара над раствором; nB – количество растворенного вещества; nS – количество растворителя.
Любая жидкость закипает, когда давление ее пара становится равным атмосферному давлению. Так как, давление пара над раствором ниже давления пара над растворителем, то для того, чтобы раствор закипел, его надо нагреть до более высокой температуры, чем растворитель.
Замерзает раствор тогда, когда давление насыщенного пара его становится равным давлению насыщенного пара твердого растворителя, следовательно для замерзания раствора нужна более низкая температура, чем для растворителя.
Повышение температуры кипения (ΔТкип) и понижение температуры замерзания (∆Тзам) раствора прямо пропорционально моляльной концентрации растворенного вещества (следствие закона Рауля):
∆Тзам = КТ ∙ сm(B); ∆Ткип = ЭТ ∙ cm(B),
где ∆Тзам – понижение температуры замерзания; ∆Ткип – повышение температуры кипения; КТ – криоскопическая константа; ЭТ – эбулиоскопическая константа; cm(B) – моляльная концентрация раствора.
Лекция № 9. РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
При растворении электролитов в воде происходит их распад на ионы. Распад молекул вещества на ионы под действием полярных молекул растворителя называется электролитической диссоциацией. Ионы – это заряженные частицы. Бывают двух типов: положительно заряженные – катионы (Na+, Al3+, NH4+) и отрицательно заряженные – анионы (Cl‾, SO42‾, PO43‾). Под действием электрического тока катионы движутся к отрицательно заряженному электроду (катоду), анионы – к положительно заряженному электроду (аноду).
К электролитам относятся растворы кислот, солей и щелочей.
Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода: HCN= H++ CN-.
Основания – электролиты, диссоциирующие в растворах с образованием гидроксид- ионов: NH4OH= NH4+ + OH-.
Существуют электролиты, которые могут диссоциировать по типу кислоты и по типу основания, такие электролиты называются амфотерными, к ним относятся гидроксиды амфотерных элементов, а также гидроксиды металлов, находящихся в промежуточной степени окисления, например: Al(OH)3, Zn(OH)2, Cr(OH)3 и многие другие. Диссоциацию растворенной части амфотерного гидроксида по обоим типам можно представить следующей схемой: H+ + RO- = ROH = R+ + OH–. В насыщенном водном растворе амфотерного гидроксида ионы H+, RO-, R+, OH- находятся в состоянии равновесия, поэтому амфотерные гидроксиды взаимодействуют и с кислотами и с основаниями. При добавлении кислоты равновесие смещается в сторону диссоциации по типу основания, при добавлении основания – в сторону диссоциации по типу кислоты.
Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода и отрицательные, отличные от гидроксид-ионов.
Степень диссоциации.Для количественной характеристики процесса диссоциации введено понятие степень диссоциации. Степенью диссоциации (α) называется отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N). Выражается в долях единицы или в %.
α = n / N 0 < α < 1 (или 0 < α < 100%)
Степень диссоциации зависит от природы электролита, его концентрации и температуры. По своей природе все электролиты делятся на сильные и слабые. Степень диссоциации сильных электролитов α > 30%, слабых электролитов – α < 3%.
У сильных электролитов в растворе диссоциируют на ионы практически все молекулы, у слабых – лишь часть молекул. К сильным электролитам относятся почти все соли, основания щелочных и щелочноземельных металлов, а из важнейших кислот: HClO4, H2SO4, HNO3, HCl, HBr, HI, HMnO4. К слабым электролитам относятся почти все органические кислоты, (например, CH3COOH), неорганические соединения: H2CO3, H2SO3, H2SiO3, HCN, HNO2, HF, NH4OH, H2O.
Константа диссоциации. В растворах слабых электролитов процесс диссоциации протекает обратимо и к нему может быть применен закон действия масс. Так, для процесса диссоциации слабой уксусной кислоты CH3COOH ↔ CH3COO- + H+ константа равновесия процесса диссоциации имеет вид:
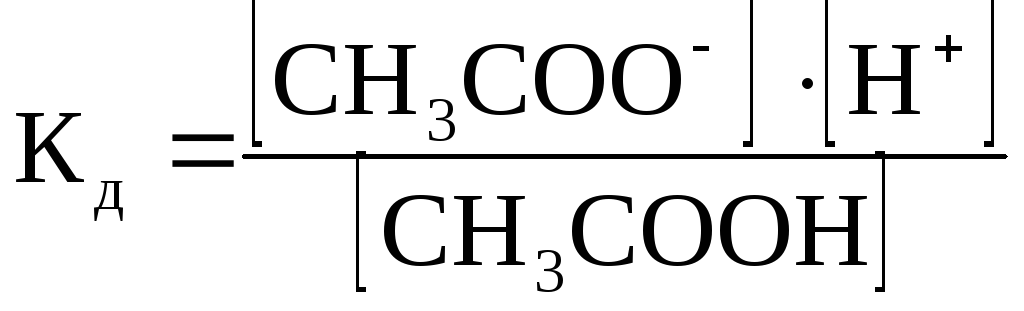
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации (Кд). Константа диссоциации указывает на прочность молекулы в данном растворе. Чем меньше Кд, тем слабее электролит и тем, следовательно, устойчивее его молекулы. Например, борная кислота Н3ВО3, Кд которой 5,8∙10-10, более слабый электролит, чем уксусная, Кд которой равна 1,8∙10-5.
Константа и степень диссоциации связаны соотношением (закон разбавления Оствальда):
![]() .
.
Если α значительно меньше единицы, то можно принять, что 1 – α ≈ 1. Тогда выражение закона разбавления упрощается:
К = α2
∙ сВ,
откуда α =
![]()
Последнее соотношение показывает, что при уменьшении концентрации электролита сВ (т.е. с разбавлением раствора) степень диссоциации α увеличивается.
Реакции в растворах электролитов протекают между ионами и идут необратимо, если в результате реакции образуются осадки, газы и слабые электролиты. Обычно такие реакции изображаются при помощи ионно-молекулярных уравнений. Осадки, газы и слабые электролиты пишутся в виде молекул, хорошо растворимые сильные электролиты – в виде ионов.
Рассмотрим типичные варианты реакций в растворах электролитов:
а) 3АgNO3 + FeCl3 = Fe(NO3)3 + 3AgCl – молекулярное уравнение
3Ag+ + 3NO3- + Fe3+ + 3NO3- + 3AgCl – полное ионное уравнение
Ag+ + Cl-= AgCl – сокращенное ионное уравнение
б) Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
2Na+ + CO32- + 2H+ + SO4- = 2Na+ + SO42- + H2O + CO2
2H+ + CO32- = H2O + CO2.
в) HCl + NaOH = NaCl + H2O
H+ + Cl- + Na+ + OH- = N a+ + Cl- + H2O
H+ + ОH- = H2O
При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части должна быть равна сумме электрических зарядов в правой части уравнения. Одинаковые ионы из обеих частей уравнения исключаются.
Лекция №10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений, называются окислительно-восстановительными.
Степень окисления (С.О.) – это заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Определение степени окисления проводят, используя следующие положения:
1. Степень окисления. элемента в простом веществе, например, в Zn, H2, Вг2, S, O2, равна нулю.
2. Cтепень окисления кислорода в соединениях обычно равна –2. Исключения составляют пероксиды H2+1O2–1, Na2+1O2–1 и О+2F2.
3. Степень окисления водорода в большинстве соединений равна +1, за исключением солеобразных гидридов, например, Na+1H-1.
4. Постоянную степень окисления имеют щелочные металлы (+1); щелочноземельные металлы, бериллий и магний (+2); фтор (–1).
5. Алгебраическая сумма степеней окисления элементов в нейтральной молекуле равна нулю, в сложном ионе – заряду иона.
В качестве примера рассчитаем степень окисления хрома в соединении К2Cr2O7. Сначала поставим степень окисления над теми элементами, для которых она известна. В нашем примере постоянную степень окисления имеют калий (+1) и кислород (-2). Степень окисления хрома обозначим через х. Далее составляем алгебраическое уравнение. Для этого индекс при каждом элементе умножаем на степень окисления этого элемента, все складываем и приравниваем правую часть нулю:
К2+1 Сr2х O7 –2 2∙(+1)+ 2x + 7 (–2) = 0 x = + 6
Таким образом, степень окисления хрома в К2Cr2O7 равна +6. Чтобы определить степень окисления элемента в анионе, например азота в анионе (NO2)‾, поступаем точно также, только правую часть приравниваем заряду иона, в нашем случае -1
(NхO2‾2)‾ x + 2 (–2) = –1 x = + 3
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Окисление – процесс отдачи электронов атомом, молекулой или ионом, сопровождающийся повышением степени окисления. Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления.
Окисление и восстановление – взаимосвязанные процессы, протекающие одновременно.
Типичные окислители и восстановители
Окислителями называются вещества (атомы, ионы или молекулы), которые в процессе реакции присоединяют электроны, восстановителями – вещества, отдающие электроны. Окислителями могут быть атомы галогенов и кислород, положительно заряженные ионы металлов (Fe3+, Au3+, Hg2+, Cu2+, Ag+), сложные ионы и молекулы, содержащие атомы металла в высшей степени окисления (KMnO4, K2Cr2O7, NaBiO3 и др.), атомы неметаллов в положительной степени окисления (HNO3, концентрированная H2SO4, HClO, HClO3, KClO3, NaBrO и др.).
Типичными восстановителями являются почти все металлы и многие неметаллы (углерод, водород) в свободном состоянии, отрицательно заряженные ионы неметаллов (S2-, I-, Br-, Cl- и др.), положительно заряженные ионы металлов в низшей степени окисления (Sn2+, Fe2+, Cr2+, Mn2+, Cu+ и др.).
Соединения, содержащие элементы в максимальной и минимальной степенях окисления, могут быть соответственно или только окислителями (KMnO4, K2Cr2O7, HNO3, H2SO4, PbO2), или только восстановителями (KI, Na2S, NH3). Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем. Например, нитрит калия KNO2, содержащий азот в степени окисления +3, пероксид водорода H2O2, содержащий кислород в степени окисления -1, в присутствии сильных окислителей проявляют восстановительные свойства, а при взаимодействии с активными восстановителями являются окислителями.
