
Периодические свойства элементов
Так как электронное строение атомов элементов изменяется периодически, то, соответственно, периодически изменяются и свойства элементов, определяемые их электронным строением, например радиусы атомов, энергия ионизации, сродство к электрону, электроотрицательность.
Радиусы атомов. Абсолютное значение радиусов атомов определить невозможно. Поэтому за радиус принимают теоретически рассчитанное расстояние от ядра до наиболее удаленного от него максимума электронной плотности или половину расстояния между центрами 2-х взаимодействующих атомов. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. В группах с увеличением порядкового номера элемента радиус атома увеличивается, так как увеличивается число энергетических уровней.
Энергия, необходимая для отрыва электрона от атома, называется энергией ионизации (Еи). В результате ионизации атом превращается в положительно заряженный ион Э0–е→Э+. Еи выражается в электрон-вольтах (эВ) и является мерой металлических свойств и восстановительной способности элемента. Чем меньше Еи, тем сильнее выражены металлические свойства и восстановительная способность элемента. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому энергия ионизации постепенно увеличивается, а металлические и восстановительные свойства ослабевают. В главных подгруппах с увеличением порядкового номера элемента радиус атома увеличивается, а энергия ионизации уменьшается. Металлические свойства и восстановительная активность s- и p-элементов увеличивается. В побочных подгруппах при увеличении порядкового номера Еи увеличивается, металлические свойства и восстановительная активность d-элементов понижается.
Энергия, выделяющаяся при присоединении электрона к атому с превращением его в отрицательный ион, называется сродством к электрону (Ее). Э+е→Э–. Ее выражается в электрон-вольтах и является мерой неметаллических свойств и окислительной способности элемента. Чем больше Ее, тем сильнее выражены неметаллические и окислительные свойства элемента. С увеличением порядкового номера элемента Ее по периодам возрастает, по группам уменьшается. Наибольшее сродство к электрону имеют фтор, кислород, хлор. Они же являются и самыми сильными окислителями.
Электроотрицательность (ЭО) характеризует способность атома в соединении оттягивать к себе общую электронную пару. В пределах периодов ЭО элементов увеличивается. Максимальной электроотрицательностью обладает фтор. В подгруппах ЭО уменьшается с ростом порядкового номера элемента.
Лекция 4. ХИМИЧЕСКАЯ СВЯЗЬ
Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, кристаллы. Образование химической связи сопровождается выигрышем энергии – энергия связанной системы меньше, чем суммарная энергия отдельных атомов. Энергия связи – это количество энергии, выделяющееся при образовании связи. Длина связи – это расстояние между ядрами двух связанных атомов. Валентный угол – угол между воображаемыми прямыми, проходящими через ядра атомов.
Химическая связь осуществляется валентными электронами. В зависимости от характера распределения электронной плотности в веществе различают четыре типа химических связей: ковалентную, ионную, металлическую и водородную.
Ковалентная связь. Связь, возникающая между атомами за счет образования общих электронных пар, называется ковалентной.
H• + •H → H : H → Н–Н
Различают полярную и неполярную ковалентную связь Неполярная ковалентная связь возникает между атомами с одинаковой электроотрицательностью (ЭО), например Н2, N2, О2, F2, С12, Br2, I2. Если молекула образована атомами с разной ЭО, то электронная пара будет смещена в сторону более электроотрицательного атома и ковалентная связь будет полярной. Например, полярными являются связи в молекулах НС1, НBr, HI, Н2О, NH3.
Следует различать
полярность молекулы и полярность связи.
Полярность связи зависит от значений
электроотрицательности связанных
атомов, а полярность молекулы зависит
и от полярности связи, и от геометрической
формы молекулы. Например, связи в молекуле
углекислого газа СО2
будут полярными, а молекула не будет
полярной, т.к. имеет линейное строение:
Оδ -=
Сδ+ =
Оδ-.![]()
Все симметричные молекулы, например CH4, BF3, BeCl2 неполярны.
Метод валентных связей. Метод описания химической связи, образование которой связано с общей электронной парой, называется методом валентных связей (МВС). Основные положения метода: 1) ковалентная связь образуется двумя электронами с противоположно направленными спинами; 2) образовавшаяся электронная пара локализована между двумя атомами, поэтому такая связь является двухэлектронной и двухцентровой; 3) ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей взаимодействующих атомов.
В зависимости от направления перекрывания АО различают s- и p-связи. s-связь образуется при перекрывании АО вдоль линии, соединяющей ядра атомов. Примерами такой связи является перекрывание двух s-АО в молекуле Н2, одной s-и одной p- АО в молекуле HCl, двух p-АО в молекуле Cl2.При перекрывании АО по обе стороны от линии соединения атомов образуется p-связь. p-связи располагаются в плоскости, перпендикулярной плоскости s-связи.p-связи налагаются на s-связи, вследствие чего образуются двойные и тройные связи. Количество связей, образующихся между атомами, называются кратностью связи. В молекуле H2 одинарная связь Н−Н, в молекуле СО2 двойная связь О=С=О, а в молекуле азота тройная связь:
N![]() +
+
![]() N
→ N
N
→ N![]()
![]() N
→ N
N
→ N
![]() N
N
Механизмы образования ковалентной связи:
1. Обменный – это механизм образования ковалентной связи за счет обобществления неспаренных электронов двух атомов.
H• + •H → H : H → Н–Н
2. Донорно-акцепторный – это механизм образования ковалентной связи за счет неподеленной электронной пары одного атома (донора) и свободной орбитали другого атома (акцептора).
Таким образом, атом может образовывать связи с другими атомами за счет обобществления неспаренных электронов, а также по донорно-акцепторному механизму. Свойство атомов элемента образовывать химическую связь, называется валентностью. Величина валентности определяется числом связей, образованных атомом. В ионе [NH4]+ азот четырехвалентен, водород – одновалентен.
Особенности ковалентной связи.Ковалентная связь характеризуется насыщаемостью, направленностью, поляризуемостью.
Насыщаемость – это способность атома участвовать в образовании ограниченного числа ковалентных связей. Вследствие насыщаемости молекулы имеют определенный состав. Например, HCl а не H2Cl; H2, а не H3. Присоединение третьего атома водорода к молекуле водорода вызовет его отталкивание, так как его спин будет параллелен одному из спинов в молекуле H2.
Направленность ковалентной связи обусловлена тем, что АО определенным образом ориентированы в пространстве, поэтому и перекрывание их осуществляется лишь по соответствующим направлениям. Благодаря направленности ковалентной связи молекула имеет определенную геометрическую структуру. Например, молекулы H2, HCl, Cl2, СО2 – линейные; H2О, H2S, H2Se, H2Te – угловые; молекулы NН3, РН3, SbH3 имеют форму пирамиды.
Поляризуемость – это способность связи становиться более полярной под действием внешнего электрического поля. С каждым атомом или молекулой связано электрическое поле, поэтому поляризация связи может происходить под действием других молекул. Например, при растворении HCl в воде под действием полярных молекул H2O электронная пара полностью перейдет к хлору и молекула HCl распадется на ионы: H : Cl → Н+ + Cl‾.
Гибридизация атомных орбиталей. Если в образовании химической связи принимают участие электроны разных энергетических подуровней, например s и p, то происходит гибридизация АО. Гибридизация – это изменение первоначальной формы и энергии АО и образование орбиталей новой, но уже одинаковой формы и энергии. Тип гибридизации центрального атома определяет геометрическую форму молекулы. Если центральный атом имеет на внешнем уровне один s- и один p- электрон, то у данного атома в процессе образования связи происходит sp-гибридизация АО, и образующаяся молекула будет иметь линейное строение (BeF2, MgCl2, HgCl2, CO2, C2H2). Если у атома, вступающего в химическую связь, на внешнем уровне один s и два p- электрона, то происходит sp2-гибридизация АО, и образующаяся молекула имеет форму треугольника (BCl3, COCl2, SO3).У атома, имеющего на внешнем уровне один s и три p электрона, при химическом взаимодействии происходит sp3-гибридизация АО и образующаяся молекула имеет форму тетраэдра (CH4, CCl4, SiH4).
Ионная связь. Связь, которая образуется за счет электростатического притяжения противоположно заряженных ионов, называется ионной. Такая связь возникает лишь при больших различиях в значениях элекроотрицательностей атомов. Например, между типичными металлами (ЩМ и ЩЗМ) и неметаллами (галогенами F2, Cl2, Br2, I2). Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов: атомной – (алмаз, графит, кварц SiO2); молекулярной – (H2O, I2, «сухой лед» CO2 и др.).
(…2s22p63s1) Na0 – 1e → Na+ (…2s22p6)
(… 3s23p5) Cl0 + 1e → Cl-1 (… 3s23p6).
Так как электрическое поле иона имеет сферический характер, то для ионной связи не характерна направленность. Ионной связи также не свойственна насыщаемость,так ион способен взаимодействовать со многими соседними ионами противоположного знака. Поэтому нет молекулы NaCl, а есть кристалл ионного соединения NaCl, в котором каждый ион одного знака окружен определенным числом ионов противоположного знака.
Водородная связь. Связь, которая возникает между атомом водорода одной молекулы и сильно электроотрицательным атомом другой или той же молекулы, называется водородной. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примерами веществ, в которых осуществляется водородная связь, являются
…Оδ-−Нδ+ … Оδ-−Нδ+… Hδ+−Fδ-… Hδ+−Fδ-…
| |
Hδ+ Hδ+
вода плавиковая кислота
Металлическая связь проявляется в твердом и жидком состоянии металла. Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому кристалл металла содержит атомы, положительно заряженные ионы и большое количество «полусвободных» электронов, которые легко подвижны, непрочно связаны с атомом и становятся одновременно общими для всех атомов (образуется так называемый «электронный газ»). Связь в металлах и сплавах, которую осуществляют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называется металлической. Наличием металлической связи обусловлены физические свойства металлов и сплавов: электропроводность, теплопроводность, твердость, пластичность.
Лекция № 5. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Химическая термодинамика изучает энергетические эффекты, сопровождающие химические реакции, направление и пределы самопроизвольного протекания реакций. Объектом изучения в химической термодинамике является система. Система – вещество или совокупность находящихся во взаимодействии веществ, мысленно или фактически обособленных от окружающей среды. Системы бывают: открытые (обмениваются с внешней средой и веществом и энергией), закрытые (обменивается с внешней средой энергией, но не обмениваются веществом), изолированные (не обмениваются с внешней средой ни веществом, ни энергией). Каждая система может быть охарактеризована термодинамическими параметрами (температура, давление, объем, концентрация). Совокупность термодинамических параметров определяет состояние системы. Кроме термодинамических параметров для характеристики состояния системы в термодинамике широко используются величины, называемые функциями состояния, значения которых зависят от состояния системы, но не от способа, которым это состояние достигается. К функциям состояния относятся внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G).
Внутренняя энергия. При химических реакциях в системе происходят глубокие качественные изменения – рвутся связи в исходных веществах и возникают новые связи в продуктах реакции. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Реакции, протекающие с выделением теплоты, называются экзотермическими, с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Выделение теплоты при химической реакции свидетельствует о том, что вещества еще до реакции в скрытой форме обладали определенной энергией, которая и освобождается в процессе реакции.
Энергия, скрытая в веществах и освобождающаяся при химических реакциях, называется внутренней энергией. Она складывается из кинетической потенциальной энергии частиц системы. При химической реакции происходит изменение внутренней энергии ∆U = U2 – U1, где U2 и U1 – внутренняя энергия системы в конечном и начальном состояниях.
Первое
начало термодинамики. Энтальпия. Если
закрытую систему, например газ в цилиндре
под поршнем, нагреть, то тепло
Q,
подведенное к системе, расходуется на
увеличение внутренней энергии (∆U) и
совершения работы против внешнего
давления (![]() ):
):
![]()
Приведенная формулировка представляет собой выражение первого начала термодинамики, а формула – его математическое выражение.
Если реакция протекает при постоянном объеме (∆V = 0, изохорный процесс), то работа расширения системы равна нулю и поглощенная системой теплота (тепловой эффект реакции) затрачивается на изменение внутренней энергии. Таким образом, при изохорном процессе тепловой эффект реакции равен изменению внутренней энергии системы. Qv = ∆U.
Большинство химических реакций протекает при постоянном давлении (∆Р = 0, изобарный процесс). В этом случае тепло, подведенное к системе, расходуется на увеличение внутренней энергии (газ нагреется) и на совершение работы против внешнего давления (поршень поднимется). Раскроем формулу
Q = ∆U + P∆V: Q = (U2 – U1) + P(V2 – V1); Q = (U2 + PV2) - (U1 + PV1).
(U + PV) обозначим через H. Н – энтальпия. Тогда
Qp
= H2
– H1
=
![]() H;
Qp
= ∆H
H;
Qp
= ∆H
Таким образом, тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы. При экзотермической реакции энтальпия системы уменьшается и ∆H < 0, а при эндотермической энтальпия системы увеличивается и ∆H > 0. Измеряется энтальпия в кДж.
Изменение энтальпии принято относить к тому случаю, когда все исходные вещества и продукты реакции находятся в стандартном состоянии. Стандартным состоянием вещества при данной температуре называется его агрегатное состояние в виде чистого вещества при давлении 101,325 кПа. Условия, при которых все участвующие в реакции вещества находятся в стандартном состоянии, называются стандартными условиями. Отнесенные к стандартным условиям изменения соответствующих величин называются стандартными изменениями и их обозначения снабжаются верхним индексом. Например, ∆H0 – стандартная энтальпия.
Стандартная энтальпия реакции образования 1 моль сложного вещества из простых веществ называется стандартной энтальпией образования. Обозначается ∆fН0, измеряется в кДж / моль, является справочной величиной. ∆fН0 простых веществ равна нулю.
Уравнения химических реакций, в которых указаны изменения энтальпии, называются термохимическими уравнениями. В термохимических уравнениях 1) указывается агрегатное состояние веществ (г), (ж), (к); 2) коэффициенты могут быть дробными:
Н2(г) + 1/2О2(г) = Н2О(ж), ΔН0 = - 285,8 кДж
Н2(г) + 1/2О2(г) = Н2О(г), ΔН0 = - 241,8 кДж
Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии ΔrН) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ.
ΔrН0 = Σ∆fН0 продуктов реакции – Σ∆fН0 исходных веществ
Второе начало термодинамики. Энтропия
Энтропия (S)– это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Энтропия системы возрастает с увеличением движения частиц при нагревании, испарении, растворении, плавлении, расширении газов, при ослаблении или разрыве связей между атомами, при увеличении числа молекул газообразных веществ при химических реакциях и т. д. Процессы, связанные с упорядоченностью системы (конденсация пара, кристаллизация, сжатие газа, уменьшение числа молекул газообразных веществ, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии.
Изменение энтропии системы в результате протекания химической реакции (∆rS) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ.
∆rS0 = ∑S0 продуктов реакции – ∑S0 исходных веществ,
где Sо – стандартная энтропия, Дж/моль К, (справочная величина),.
Понятие энтропии
лежит в основе второго
начала термодинамики:
в изолированных
системах самопроизвольно идут только
те процессы, которые сопровождаются
возрастанием энтропии
![]() S
> 0.
S
> 0.
. Химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии.
Энергия Гиббса.
В процессе химических реакций действуют две тенденции:
1.![]() Н
Н
![]() min
(энтальпийный фактор);
min
(энтальпийный фактор);
2.![]() S
S
![]() max
(энтропийный фактор).
max
(энтропийный фактор).
Оба эти фактора действуют во взаимно-противоположных направлениях и течение реакции определяется тем из них, который преобладает в данном конкретном случае. Изменение энтальпии и энтропии при химической реакции учитывает энергия Гиббса ∆G0(кДж): ∆G0 = ∆Н0 – Т∆S0, где Т – абсолютная температура, ∆S0. – стандартное изменение энтропии; ∆Н0 – стандартное изменение энтальпии.
Величина и знак
![]() G
определяют возможность самопроизвольного
протекания химической реакции и ее
направление. При постоянной температуре
и давлении реакция самопроизвольно
протекает в том направлении, которому
отвечает убыль энергии Гиббса.
G
определяют возможность самопроизвольного
протекания химической реакции и ее
направление. При постоянной температуре
и давлении реакция самопроизвольно
протекает в том направлении, которому
отвечает убыль энергии Гиббса.
![]() G
< 0 - реакция идет самопроизвольно в
прямом направлении;
G
< 0 - реакция идет самопроизвольно в
прямом направлении;
![]() G
> 0 - при данных условиях реакция в
прямом направлении не идет;
G
> 0 - при данных условиях реакция в
прямом направлении не идет;
![]() G
= 0 - реакция обратима (химическое
равновесие).
G
= 0 - реакция обратима (химическое
равновесие).
Изменение ∆rG не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ.
![]() rG0
= Σ∆fG0продуктов
реакции –
Σ∆fG0исходных
веществ,
rG0
= Σ∆fG0продуктов
реакции –
Σ∆fG0исходных
веществ,
где ∆fG0 – стандартная энергия Гиббса образования, кДж/моль; справочная величина. ∆fG0 простых веществ равна нулю.
Лекция № 6. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Химическая кинетика - раздел химии, изучающий скорость и механизм химических реакций. Скоростью химической реакции называют изменение количества реагирующего вещества за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной системы).Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Зависимость скорости химической реакции от природы реагирующих веществ обусловлена тем, что каждая реакция характеризуется определенным значением энергии активации. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Для того чтобы разрушить одну связь и образовать другую связь, необходимы определенные энергетические затраты. Энергия активации Еа – это та избыточная энергия, которой должны обладать молекулы для того чтобы их столкновение могло привести к образованию нового вещества. Если энергия активации очень мала (< 40 кДж/моль), то реакция идет с очень большой скоростью, если энергия активации очень велика (>120 кДж/моль), то скорость реакции неизмеримо мала.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс (ЗДМ): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
В общем случае для гомогенной реакции nA(г) + mB(г) = pAB(г)
зависимость скорости реакции от концентрации выражается уравнением:
![]() ,
,
где СА
и СВ
– концентрации реагирующих веществ, k
– константа скорости реакции. Для
конкретной реакции 2NO(г)
+ O2(г)
= 2NO2(г)
математическое выражение ЗДМ имеет
вид: υ
= k∙![]() ∙
∙
![]()
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов. Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций скорость реакции зависит только от концентрации газов или растворенных веществ, а концентрация твердой фазы в математическое выражение ЗДМ не входит. Например, скорость реакции горения углерода в кислороде пропорциональна только концентрации кислорода:
С(к)
+ О2(г)
= СО2(к)
, υ = k·![]()
Зависимость скорости реакции от температуры. При повышении температуры увеличивается скорость движения молекул, что приводит в свою очередь к увеличению числа столкновений между ними.. Повышение температуры увеличивает число активных молекул, и, следовательно, увеличивает скорость химической реакции.
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на каждые 10 °C скорость реакции возрастает в 2-4 раза.
![]() ,
,
где υ2 и υ1 – скорости реакций при температурах t2 и t1,
γ – температурный коэффициент скорости реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на 10 0С
Более строго зависимость скорости реакции от температуры описывается уравнением Аррениуса, которое связывает константу скорости реакции с энергией активации:
![]()
где А – это постоянный множитель, который равен числу столкновений молекул в единицу времени, умноженному на вероятность химического взаимодействия при столкновении.
Зависимость скорости реакции от катализатора. Вещества, увеличивающие скорость реакции, а сами остающиеся после нее химически неизменными, называются катализаторами. Изменение скорости реакции под действием катализаторов называется катализом. Различают катализ гомогенный и гетерогенный.
Если реагирующие вещества и катализатор находится в одном и том же агрегатном состоянии, то катализ гомогенный:
2SO2(г)
+ O2(г)
![]() 2SO3(г)
2SO3(г)
Если реагирующие вещества и катализатор находится в различных агрегатных состояниях, то катализ гетерогенный:
N2(г)
+ 3H2(г)
![]() 2NH3(г)
2NH3(г)
Действие катализатора заключается в том, что он уменьшает энергию активации, и при этом увеличивается скорость реакции.
Лекция № 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции делятся на необратимые и обратимые. Необратимые протекают только в прямом направлении (до полного израсходования одного из реагирующих веществ), обратимые протекают как в прямом, так и в обратном направлениях (при этом ни одно из реагирующих веществ не расходуется полностью). Рассмотрим следующую реакцию:
aA
+ bB
![]() dD
+ fF
dD
+ fF
Математическое выражение закона действия масс для скорости прямой υпр и обратной υобр реакций имеет вид:
υпр
=
![]() υобр
=
υобр
=
![]()
В момент смешивания веществ А и В скорость прямой реакции будет максимальной. Затем вещества А и В постепенно расходуются и скорость прямой реакции уменьшается. Получившиеся вещества D и F начнут реагировать друг с другом, и скорость обратной реакции будет непрерывно возрастать по мере увеличения концентрации веществ D и F. В определенный момент времени скорость прямой реакции станет равна скорости обратной реакции.
Состояние системы, при котором скорость прямой реакции (υ1) равна скорости обратной реакции (υ2), называется химическим равновесием. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными.
Закон действия
масс для
обратимых процессов:
в
состоянии
химического равновесия при неизменной
температуре отношение произведения
концентраций продуктов реакции к
произведению концентраций исходных
веществ есть величина постоянная.
Эта величина
называется константой
равновесия.
Равновесные концентрации принято
обозначать не символом «СА»,
а формулой вещества, помещенной в
квадратные скобки, например,
![]() ,
а константу равновесия, выражаемую
через концентрации – КС.
Для обратимой реакции aA+bB
,
а константу равновесия, выражаемую
через концентрации – КС.
Для обратимой реакции aA+bB
![]() dD
+ fF
математическое выражение закона
действия масс имеет вид:
dD
+ fF
математическое выражение закона
действия масс имеет вид:
![]() .
.
Для конкретной гомогенной реакции:
2СО(г)
+ О2(г)
↔ 2СО2(г)
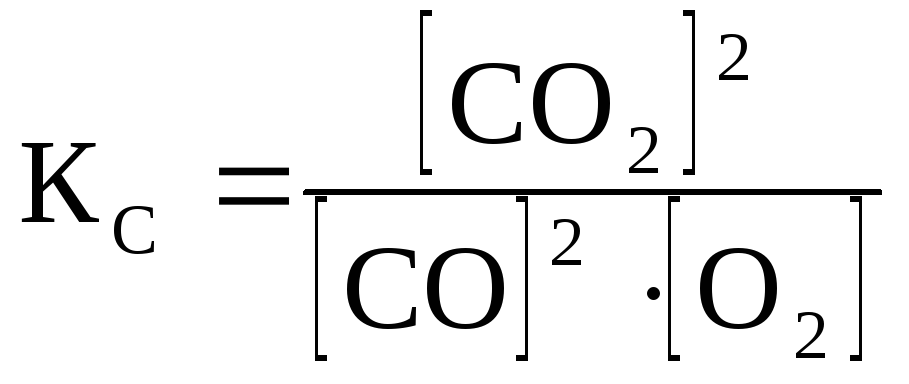
Для гетерогенной
реакции СО2(г)
+ С(к)
= 2СО(г)
![]() .
Концентрация твердой фазы в математическое
выражение ЗДМ для гетерогенных систем
не входит.
.
Концентрация твердой фазы в математическое
выражение ЗДМ для гетерогенных систем
не входит.
Химическое равновесие неизменно до тех пор, пока условия равновесия (концентрация, температура, давление), сохраняются постоянными. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Переход системы из одного равновесного состояния в другое называется смещением равновесия.
Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в сторону той реакции, которое ослабляет произведенное воздействие.
