
- •14.8. Всасывание
- •14.10. Особенности пищеварительной системы детей
- •14.11. Изменения системы пищеварения в процессе старения
- •Глава 15
- •15.1. Основные этапы обмена веществ I и энергии
- •15.2. Обмен веществ
- •15.3. Обмен энергии
- •15.5. Особенности обмена веществ и энергии у детей
- •Глава 16 терморегуляция
- •16.4. Механизмы регуляции температуры тела
- •16.5. Гипертермия и гипотермия
- •16.6. Адаптация к периодическим изменениям температуры среды. Закаливание и здоровье
- •16.7. Особенности терморегуляции у детей
- •16.8. Особенности терморегуляции у пожилых людей
- •Глава 17
- •17.2. Структурно-функциональная характеристика почки
- •17.3. Роль различных отделов нефрона в мочеобразовании
- •Проницаемость фильтрующей мембра ны.
- •3. Фильтрационное давление (фд).
- •17.6. Роль почек в поддержании показателей организма
- •17.7. Количество и состав конечной мочи
- •17.9. Искусственная почка
- •17.10. Особенности выделительной системы плода и детей
- •17.11. Образование и выделение мочи в стареющем организме
- •Раздел IV интегративная деятельность организма
- •Глава 18
- •18.1. Общая физиология анализаторов
- •18.2. Зрительный анализатор
- •18.3. Слуховой анализатор
- •18.4. Вестибулярный анализатор
- •18.5. Двигательный (кинестетический) анализатор
- •18.6. Внутренние (висцеральные) анализаторы
- •18.7. Температурный анализатор
- •18.8. Тактильный анализатор
- •18.9. Вкусовой анализатор
- •18.10. Обонятельный анализатор
- •18.11. Болевой анализатор
- •18.12. Обезболивающая (антиноцицептивная) система
- •18.13. Особенности деятельности анализаторов у детей
- •Глава 19
- •19.1. Физиологические основы поведения
- •19.2. Научение
- •19.3. Динамика корковых процессов
- •19.4. Ашлитико-синтетическая деятельность мозга
- •19.6. Экспериментальные неврозы
- •19.9. Физиологические основы
17.6. Роль почек в поддержании показателей организма
Почки играют важную роль в регуляции осмотического давления, объема жидкости в организме, стабилизации АД, ионного состава и кислотно-основного состояния внутренней среды организма.
17.6.1. РЕГУЛЯЦИЯ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ И ОБЪЕМА ВОДЫ
Осмотическое давление регулируется весьма точно. Отклонение его параметров от нормы (7,6 атм) опасно для жизни. Оно несколько (на 5—30 мосмоль/л) больше в венозной
446
крови вследствие поступления низкомолекулярных продуктов метаболизма; в воротной и печеночной венах оно больше примерно на 350 мосмоль/л. Осмотическое давление — это диффузионное давление, обеспечивающее движение растворителя через полупроницаемую мембрану; измеряется минимальной величиной гидростатического давления, препятствующего движению растворителя в раствор через полупроницаемую мембрану. Осмотическое давление и объем жидкости регулируются с помощью рассмотренных процессов регуляции мочеобразовательной функции почки, главным из которых является гормональный. Здесь представим лишь способы включения реакций почки и местные регуля-торные механизмы.
А. Местные механизмы регуляции осмоляр-ности и количества воды в крови.
-
Диффузия и осмос между кровью и тка нями организма. Нормализация осмолярнос- ти крови при дегидратации и повышении ос мотического давления может произойти в ре зультате диффузии осмотически активных частиц в тканевую жидкость и перехода воды в противоположном направлении — из тка ней в кровь и лимфу согласно закону осмоса.
-
Образование соединений белков и эрит роцитов с катионами, что ведет к уменьше нию числа свободных частиц в плазме крови и снижению ее осмотического давления. Это происходит потому, что их концентрация и взаимодействие возрастают вследствие уменьшения объема растворителя — плазмы крови. Следовательно, сама кровь может вы полнять роль осмотического буфера.
-
Ускорение всасывания воды из желудоч но-кишечного тракта при увеличении осмо- дярности плазмы крови.
В случае поступления избытка воды в кровь и снижения ее осмолярности осмотически активные вещества и вода между кровью и тканями перемещаются в обратном направлении, а связанные эритроцитами и белками катионы освобождаются. В транскапиллярном обмене жидкости и ионов особое значение имеют печень и селезенка. В частности, в печени может выходить значительное количество воды в лимфатические сосуды, задерживаться Na+. Что касается селезенки, то при ее удалении в эксперименте содержание Саг+ и Na+ в сыворотке крови повышается, а в мышцах и коже снижается, при введении животным экстрактов из селезенки восстанавливается исходное содержание ионов. При небольших сдвигах осмотического давления может оказаться достаточно местных регуляторных механизмов. Следует
заметить, что местные механизмы регуляции осмолярности и объема жидкости крови в выведении ионов и воды из организма не участвуют.
Б. Регуляция осмолярности и объема воды посредством изменения интенсивности выведения. Во-первых, это может осуществляться с помощью изменения скорости клубочковой фильтрации, что может наблюдаться при изменении фильтрационного давления, которое определяется в основном артериальным давлением. Однако этот механизм существенной роли не играет, так как колебания артериального давления в пределах 80—180 мм рт.ст. практически не влияют на скорость клубочковой фильтрации; за пределами этих границ давления скорость клубочковой фильтрации может существенно изменяться. Так, при сердечной недостаточности или сильно выраженной гипотонии сосудистого происхождения избыток воды задерживается в организме вследствие снижения скорости клубочковой фильтрации и уменьшения образования первичной мочи. Во-вторых (и это главное), интенсивность выведения регулируется посредством изменения объема реаб-сорбции. Регуляция осмолярности и объема жидкости при этом осуществляется с помощью: 1) антидиуретического гормона (АДГ, вазопрессина), 2) альдостерона, 3) атриопеп-тида и запускается в основном с помощью осмо- и волюморецепторов. Афферентные сигналы, вызывающие изменение секреции АДГ, поступают также в гипоталамус от баро-рецепторов аортальной и синокаротидной рефлексогенных зон.
1. Регуляция с помощью АДГ. О с м о р е-ц е п т о р ы расположены в гипоталамусе, в интерстиции тканей и кровеносных сосудов печени, почек, селезенки, сердца, в костном мозге, пищеварительном тракте, в синокаротидной рефлексогенной зоне. Об этом свидетельствует, в частности, результат следующего опыта: при введении гипертонических растворов в кровоток поджелудочной железы, легких, печени, сердца наблюдаются торможение диуреза и увеличение натрийуреза (осмолярность в организме на 90 % обеспечивается натрием, поскольку он находится в основном вне клеток различных тканей организма).
По-видимому, наиболее важными периферическими рефлексогенными зонами являются предсердия и печень. При прохождении гипотоничной крови через печень (например, после питья) клетки печени набухают, так как их цитоплазма обладает повышенной осмолярностью относительно крови в дан-
447

ный момент, поэтому вода поступает в клетки. Это физиологическое набухание ведет к возбуждению осморецепторов и поступлению импульсов в гипоталамус, что тормозит образование и выделение в кровь АДГ, в результате чего больше воды выводится из организма (схема 17.1). Подобным образом реагируют и осморецепторные нейроны гипоталамуса. Фактически осморецепторы являются ме-ханорецепторами, так как они реагируют на изменение объема клетки при поступлении внутрь клетки или выхода из нее жидкости при изменении осмотического давления среды. Часть осморецепторов является хемо-рецепторами, т.е. они регистрируют не общее осмотическое давление жидкости, а концентрацию каких-то ионов. Среди таких рецепторов наибольшее значение имеют специализированные натрийрецепторы (наибольшая их плотность в печени, предсердиях и гипоталамусе).
Имеются также специфические рецепторы для Са2+, К+, Mg2+. В случае увеличения концентрации любого из названных ионов увеличивается выведение именно этого иона из организма. Эти механизмы изучены недостаточно. Осморецелторы весьма чувствитель-
ны: при увеличении осмолярности плазмы крови на 1 % (около 3 мосмоль/л) наблюдается увеличение концентрации АДГ в плазме крови человека (она возрастает на 1 пг/мл — пикограмм = 10~12 г). Особенно высока чувствительность осморецепторов гипоталамуса. При снижении осмотического давления крови осморецепторные нейроны поглощают воду, в результате чего снижается секреция АДГ и увеличивается выведение воды почками. При повышении осмотического давления крови развиваются противоположные реакции. Увеличению выработки АДГ при гипе-росмолярности способствует также возбуждение тканевых рецепторов, ведущее к возрастанию импульсации в гипоталамус по афферентным волокнам блуждающего нерва и по задним корешкам спинного мозга. При снижении осмолярности афферентный поток от тканевых осморецепторов снижается, выработка АДГ уменьшается. При этом основная афферентация поступает по волокнам блуждающего нерва от желудочно-кишечного тракта. Даже поступление воды в желудочно-кишечный тракт уменьшает афферентацию по блуждающим нервам, в результате чего уменьшается жажда, если она наблюдалась, еше до поступления воды в кровь при ее ги-перосмолярности (сенсорное насыщение). АДГ увеличивает также выведение Na+ из организма и повышает всасывание воды в желудочно-кишечном тракте, что тоже способствует нормализации осмотического давления в случае возникновения гиперосмолярности. Волюморецепторы (барорецепто-ры низкого давления) расположены в предсердиях, в правом желудочке, в полых и других крупных венах вблизи сердца. Ведущую роль, по-видимому, играют рецепторы левого предсердия (рефлекс Гауера—Генри — увеличение диуреза при растяжении стенки левого предсердия). Импульсы от волюморецепто-ров поступают в ЦНС по афферентным волокнам блуждающего нерва. Объемные рецепторы являются механорецепторами, они возбуждаются при растяжении предсердий, кровеносных сосудов в результате увеличения объема крови. Импульсация в ЦНС по блуждающим нервам возрастает, выработка АДГ тормозится; при уменьшении объема жидкости возникают противоположные реакции и соответствующие изменения диуреза (АДГ, как известно, уменьшает диурез). При возбуждении волюморецепторов нередко возбуждаются и осморецепторы. Например, после приема большого количества воды возникает рефлекс с осмо- и волюморецепторов: секреция АДГ тормозится или прекращается,
448
вследствие чего выводится большой объем гипотоничной мочи (взаимосодействие двух рефлексов), при этом в первую очередь восстанавливается объем жидкости, позже -г- ос-молярность. В случае же уменьшения объема крови вследствие кровотечения рефлекс срабатывает только с волюморецепторов, так как осмолярность крови нормальная. При уменьшении объема крови вследствие недостатка приема воды рефлексы возникают одновременно и с волюморецепторов, и с ос-морецепторов, так как при этом имеется и гиперосмолярность.
2. Регуляция осмотического давления и объема жидкости в организме с помощью аль-достерона осуществляется посредством изменения количества реабсорбируемого Na+, поскольку осмотическое давление на 90 % определяется содержанием Na+, который в свою очередь влияет на содержание жидкости в организме. Увеличение концентрации Na+ в крови (повышение осмолярности) вызывает большее возбуждение осморецепто-ров, Ка+-рецепторов и возрастание афферентной импульсации, поступающей в ЦНС по блуждающим нервам и задним корешкам спинного мозга, что по принципу обратной отрицательной связи непосредственно тормозит выработку альдостерона в надпочечниках и сопровождается увеличением выведения Na+. Эта же импульсация посредством угнетения выработки рилизинг-фактора в гипоталамусе тормозит также выработку адре-нокортикотропного гормона (АКТГ) в передней доле гипофиза. При уменьшении выработки АКТГ уменьшается секреция альдостерона. Однако при изменении количества выводимого Na+ осмотическое давление крови может существенно не измениться, поскольку за Na+ идут С1 и вода. Снижение объема жидкости в крови ведет к усилению выработки альдостерона, задержке Na+ и воды в организме.
Влияние нескольких гормонов может быть разнонаправленным. Так, при уменьшении объема крови и увеличении ее осмолярности вследствие недостатка поступления воды в организм увеличивается выработка АДГ, что приводит к уменьшению выведения воды с мочой, причем, рефлекс возникает и с волюморецепторов, и с осморецепторов. Но при этом вырабатывается меньше альдостерона, что сопровождается увеличением выделения Na+, а с ним — С1 и воды. Взаимодействие всех механизмов (в данном примере трех рефлексов), в том числе и прием воды, приведет к нормализации осмолярности и объема жидкости в организме.
При обильном потоотделении возрастают потери солей, в первую очередь натрия — возникает опасность его недостаточного содержания в организме, значительного снижения осмотического давления, в результате чего может нарушиться обмен веществ. Однако этого обычно не происходит, так как одновременно увеличивается секреция альдостерона, уменьшающего выведение Na+ с мочой, что предотвращает значительное снижение содержания натрия в жидкостях организма, а значит, и их осмотического давления.
Регуляция содержания Na+ в крови обычно сопряжена с регуляцией содержания К+: увеличение содержания К+ в крови сопровождается увеличением выработки альдостерона, задержкой Na+ и возрастанием выведения К+ мочой.
Таким образом, выработка альдостерона увеличивается:
-
при уменьшении содержания Na+;
-
увеличении содержания К+ в организме;
-
при уменьшении объема крови и артери ального давления (в последнем случае — с помощью ренина).
3. Важную роль в регуляции осмотического давления и объема жидкости в организме играют также натрийуретический гормон, на-трийуретический фактор, плазмакинипы, паратгормон, брадикинины.
В. Регуляция объема воды и концентрации солей с помощью изменения количества их поступления в организм (поведенческая регуляция). В ходе нормальной жизнедеятельности организма осмотическое давление среды может отклоняться в обе стороны: оно повышается при недостаточном и понижается при избыточном потреблении воды. В промежутках между приемами воды ее потери через почки, легкие, кишечник и поверхность кожи несколько превышают выведение осмотически активных веществ, поэтому развивается гиперосмолярность внутренней среды, обусловленная недостатком воды в организме. При этом небольшая часть принятой воды (4—6 %) «теряется» — не всасывается в кишечнике и не участвует в выведении из внутренней среды организма продуктов метаболизма. Гиперосмолярность, во-первых, включает уже рассмотренные механизмы регуляции с помощью АДГ (главный механизм) и альдостерона; во-вторых — потребление воды вследствие возникновения чувства жажды в результате возбуждения питьевого центра. Последний расположен в гипоталамусе и других структурах лимбической системы.
449
-
под влиянием активации центральных и периферических осморецепторов (особо важную роль играют осморецепторы желу дочно-кишечного тракта и слизистой обо лочки рта): например, при поступлении в желудок соленой пищи поведение направ лено на потребление воды;
-
вследствие ослабления при недостатке жидкости в организме возбуждения волю- морецепторов в результате уменьшения растяжения предсердий и полых вен;
-
под влиянием ангиотензина II, выработка которого в печени увеличивается при уменьшении объема крови;
-
возбуждение питьевого центра усиливает ся также АДГ, натрийуретическим пепти дом, выработка которого возрастает при увеличении концентрации Na+ в крови;
-
жажда может быть вызвана электрическим раздражением перифорникальной области латерального гипоталамуса, который ак тивирует ряд структур лимбической систе мы, бледный шар, кору большого мозга.
Вынужденное ограничение поступления воды в организм или потеря воды при избыточном потоотделении могут привести к значительной дегидратации клеток и нарушению их функций. В первую очередь страдает ЦНС: нейроны наиболее чувствительны к сдвигам, которые при этом развиваются (нарушается обмен веществ между клеткой и интерстици-ем, наблюдаются ионные сдвиги). При недостатке воды в организме выпиваемая вода очень быстро уменьшает жажду вследствие снижения потока импульсов от осморецепторов желудочно-кишечного тракта в питьевой
центр (сенсорное насыщение). Затем вода всасывается и попадает в общий кровоток — возникает истинное насыщение — внутренняя среда организма вновь становится изото-ничной.
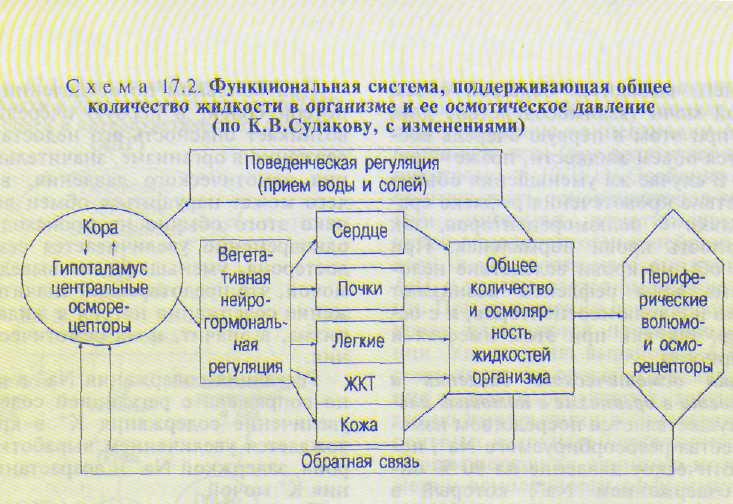
При снижении осмолярности внутренней среды, возникающем в результате избытка воды (например, после обильного питья), уменьшается выделение АДГ, а также подавляется чувство жажды. После того как уже имеющийся в крови АДГ разрушится печенью, возникает водный диурез. Это приводит к быстрому удалению избытка воды. Нормализации осмотического давления способствуют также неупотребление воды, сохраняющаяся реабсорбция Na+, потребление соленой пищи и недостающих солей (Na+, Ca2+, К+). Все эти реакции запускаются с осмо- и волюморецепторов. При приеме изотонического раствора NaCl избыточная жидкость удаляется гораздо дольше, чем при потреблении такого же количества неподсоленной воды, так как при этом срабатывают только волюморецепторы. Общая структура функциональной системы, поддерживающей количество жидкости в организме и ее осмотическое давление, представлена на схеме 17.2.
Регуляция объема жидкости в организме неизбежно сопровождается изменением артериального давления.
17.6.2. РОЛЬ ПОЧЕК В РЕГУЛЯЦИИ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
А. В почках вырабатываются биологически активные вещества, сужающие или расширяющие сосуды. Тонус сосудов снижают про-стагландины, кинины, нейтральный депрес-
450
сорный липид мозгового вещества почки. Участвует в сужении сосудов ренин, вырабатываемый эпителиоидными клетками юкс-тагломерулярных аппаратов почек, или так называемыми юкстагломерулярными клетками. Ренин представляет собой протеазу, под действием которой от а2-глобулина крови (антиотензиногена) отщепляется малоактивный декапептид ангиотензин I. Последний под действием фермента крови (ангиотензи-назы) превращается в активную форму — ок~ тапептид ангиотензин II. Это самый мощный из всех известных сосудосуживающих веществ. Он вызывает длительное и значительное сужение сосудов, вследствие чего существенно повышается АД (см. рис. 13.27). Кроме того, ангиотензин II вызывает выброс альдостерона из коры надпочечников — это главный стимулятор выработки альдостерона; существует ренин- ангиотензин-альдосте-роновая система — РААС. Альдостерон увеличивает реабсорбцию Naf в почечных ка-нальнах, что ведет к задержке воды и повышению АД.
Б. Роль почки в регуляции АД за счет изменения количества выводимой из организма воды.
1, При снижении АД, потере ионов (в первую очередь Na+), при избытке К+, при гипово-лемии активируется РААС. Все эти состояния тесно связаны между собой. РААС может активироваться, когда давление снижается только в почечных сосудах при нормальном системном АД. Это может произойти, например, при сужении почечных артерий, в случае патологии и привести к развитию почечной гипертонии. Особый интерес представляет торможение выделения ренина под действием ангиотензина II и АДГ по механизму обратной отрицательной связи, что ограничивает чрезмерное действие РААС, ведущее к повышению АД. Ангиотензин увеличивает чувствительность осморецепторов. Основные последствия активации РААС на уровне целого организма заключаются в повышении АД, сохранении или задержке Na+ и как следствие в увеличении объема внеклеточной жидкости.
При кровопотере, ортостатических пробах выброс ренина может возрастать вследствие возбуждения симпатической нервной системы. При раздражении почечных нервов, а также внутриартериальном введении адреналина или норадреналина выработка ренина увеличивается. Юкстагломерулярные клетки иннервируются симпатическими волокнами. Выделение ренина обусловлено возбуждением р-адренорецепторов. РААС запускается и
при увеличении внутриканальцевого или ин-терстициального давления, например, при затруднении оттока мочи при мочекаменной болезни, воспалительных процессах в почке. Если это постоянно действующий фактор, то может развиться гипертензия, как и при сужении почечной артерии. Физиологическое значение повышения системного АД — устранение застоя жидкости в почечных канальцах с помощью увеличения фильтрационного давления и, естественно, градиента давления в самих канальцах. Однако приспособительный рефлекс, как это нередко бывает в организме при чрезмерном его выражении, ведет к патологическому состоянию. При нормализации показателей, которые стимулируют активность РААС, выработка ее гормонов также нормализуется. Таким образом, РААС регулирует АД и за счет изменения тонуса сосудов, и за счет изменения количества выводимой из организма воды с мочой — это комбинированная регуляторная система.
-
Ведущее место в регуляции выведения воды из организма занимает АДГ. При остром уменьшении объема крови (жидкости) не только усиливается выработка АДГ, но воз никает и чувство жажды. Это один из меха низмов возникновения жажды у людей, поте рявших более 10 % крови.
-
Выведение воды регулируется также с помощью атриопептида, который является полным антагонистом РААС. Продукция ат риопептида увеличивается при возрастании давления в предсердиях.
-
Выведение воды регулируется симпати ческой нервной системой. Увеличение АД в области каротидных клубочков и дуги аорты вызывает торможение активности симпати ческих центров, что сопровождается умень шением реабсорбции Na+, увеличением вы ведения его из организма и, естественно, возрастанием диуреза и снижением АД. Па дение АД вызывает возбуждение симпатичес ких центров, увеличение реабсорбции Na+, задержку воды в организме и повышение (нормализацию) АД.
-
При высоком АД выведение воды из орга низма возрастает вследствие вымывания большого количества Na+ и мочевины из моз гового слоя почки, что возникает вследствие ускорения кровотока в прямых сосудах мозго вого слоя почки. Снижение осмолярности в нем ведет к увеличению выведения воды из организма, т.е. меньшее количество ее реаб- сорбируется в собирательных трубках. При снижении АД скорость кровотока в прямых сосудах уменьшается, больше накапливается Na+ и мочевины в мозговом слое, повышает-
15*
451
ся его осмолярность, что обусловливает увеличение объема реабсорбируемой воды в собирательных трубках и подъем (нормализацию) системного АД, т.е. изменение самого АД обеспечивает работу механизмов, нормализующих его.
В. Почка участвует в стабилизации АД посредством регуляции ионного состава плазмы крови — Na+, K+, Са2+, которые оказывают сильное влияние на возбудимость и сократимость сердца и сосудов, а значит, и на величину АД.
17.6.3. РОЛЬ ПОЧЕК В РЕГУЛЯЦИИ ИОННОГО СОСТАВА ПЛАЗМЫ КРОВИ И КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
А. Участие почки в регуляции ионного состава плазмы крови рассмотрено в главе 10. Здесь же отметим, что в процессе регуляции осмотического давления, объема жидкости и АД регулируется, естественно, и ионный состав плазмы крови. В частности, был рассмотрен механизм регуляции содержания Na+ и К+ в организме.
Б. Роль почек в регуляции кислотно-основного состояния. В процессе метаболизма в организме постоянно образуются кислоты и основания, причем часто в непропорциональных количествах. Тем не менее рН крови поддерживается на постоянном уровне: венозной — 7,34, артериальной — 7,40. Отклонение рН более чем на 0,4 несовместимо с жизнью. Постоянство рН внутренней среды организма обеспечивается буферными системами крови, легкими, почками и желудочно-кишечным трактом.
Почечные процессы регуляции рН весьма экономичны: анионы сильных кислот (фосфорной, серной и соляной) выводятся, анионы угольной кислоты (НСОз) реабсорбиру-ются, что способствует восстановлению буферных систем крови. Сульфаты и фосфаты образуются в результате расщепления белков и нуклеиновых кислот. К нелетучим основаниям относятся главным образом щелочные ионы пищи — их больше в растительных продуктах питания. Что касается угольной кислоты, образуемой в почках, то часть ее в виде СО2 поступает в кровь, как во всех тканях, часть — в виде ионов Н+ секретируется в просвет канальцев всеми отделами нефрона. Источником ионов Н+ является угольная кислота, образуемая в клетках стенок канальцев в процессе метаболизма. При этом углекислый газ (один из конечных продуктов метаболизма) в клетках канальцев в присутст-
вии карбоангидразы подвергается гидратации с образованием угольной кислоты:
Н+ + НСОз.
Карбоангидраза СО2 + Н2О 4 Н2СО3
Кроме того, дополнительно СО2, физически растворенный в плазме крови, в первичной и вторичной моче диффундирует в клетки канальцев и также используется для образования Н2СО3, которая диссоциирует на ионы Н+ и НСОз. Ион HCOi остается в клетке, а ион Н+ секретируется в просвет канальца в обмен на ион Na+. Секреция ионов Н+ в просвет канальцев почки: происходит в 3 раза быстрее, чем секреция их в желудке при образовании соляной кислоты.
Связывание ионов Н+ в канальцах нефрона осуществляется с помощью следующих механизмов.
1. Поступающий в каналец ион it реагирует с анионом НСО], который попадает в канальцы нефрона постоянно в процессе фильтрации в почечном клубочке и образования первичной мочи. Поскольку в каналец секретируются все новые и новые ионы Н+ и поступают с первичной мочой также непрерывно ионы НСО^ в виде бикарбоната натрия NaHCO3 (Na+ ^ НСОз), то в канальце идет непрерывно образование угольной кислоты под влиянием карбоангидразы, встроенной в щеточную каемку клеток эпителия канальца. Образовавшаяся угольная кислота распадается на углекислый газ и воду. Естественно, процесс может проходить и в обратном направлении, но реально он сдвинут вправо (в сторону образования Н2О и СО2), поскольку ионы Н+ и НСОз поступают в каналец непрерывно, а образующиеся Н2О и СО2 из канальца уходят. Н2О выделяется с мочой, а С02 диффундирует в клетки канальца и снова используется там для образования угольной кислоты под действием карбоангидразы — угольная кислота диссоциирует на ионы Н+и НСО3. Ион НСОз остается в клетке, а ион Н+ секретируется в просвет канальца (цикл повторяется). Из просвета канальца в клетку поступает ион Na+, который вместе с оставшимся там ионом НСОз выводится в интерс-тиций и кровь (реабсорбируется), причем ион Na+ диффундирует в клетку согласно концентрационному и электрическому градиентам (внутри клетки заряд отрицательный, ионов Na+ там мало). Из клетки Na+ выводится Na/K-помпой вопреки концентрационному и электрическому градиентам — клетки канальца со стороны интерстиция во всех отделах нефрона заряжены положитель-
452
но относительно заряда внутри клетки. Внутри канальца, в разных его отделах, заряд различный: на большем протяжении канальца от его начала, т.е. от капсулы Шумлянского— Боумена до дистального извитого канальца, заряд в его просвете положительный относительно интерстиция, а далее — отрицательный. Отрицательный заряд внутри дистального канальца способствует движению ионов К+ и Н+ из клетки канальца в его просвет, причем в дистальных отделах нефрона за обмен на реабсорбируемый Na+ конкурируют между собой Н+ и К+: в просвет канальца секретируется больше того иона (Н+ или К+), концентрация которого больше в клетках канальцев. При ацидозе выводится больше Н+, нежели К+, причем скорость секреции Н+ и К+ зависит от интенсивности реабсорбции Na+: с увеличением его реабсорбции возрастает скорость секреции Н+ и К+, при уменьшении реабсорбции Na+ уменьшается секреция Н+ и К+. Например, при увеличении содержания альдостерона в крови (эндогенного при патологии или экзогенного, вводимого с лечебной целью) увеличивается реабсорбция Na+, что ведет к увеличению секреции Н+ и К+. Это может привести к гипокалиемии и умеренному алкалозу. Поэтому при длительном лечении пациента альдостероном врач должен заботиться о дополн ительном поступлении К+ в организм.
Следует также заметить, что ион НСО$ является, как и глюкоза, пороговым, т.е. он может появиться в конечной моче только в том случае, если его концентрация в плазме крови будет превышать пороговое значение, равное 28 ммоль/л, что лишь незначительно выше нормального физиологического содержания этого иона в плазме крови. Поэтому НСОз в виде NaHCO3 в небольших количествах может появляться в моче. Кроме описанного механизма возврата НСО3 B плазму крови, предполагается наличие еще и транспортной системы для реабсорбции НСОз, скорость которой возрастает при увеличении концентрации иона в плазме крови до пороговой величины.
Итак, образующийся из ионов Н+ и НСОз в канальце нефрона СО2 уходит в клетки канальца, а вода (как и поступившая с первичной мочой) реабсорбируется и поступает в кровь и другие жидкости организма. Небольшая часть воды (около 1,5 л) выводится с мочой. При метаболическом и респираторном алкалозе НСОз выводится в неизмененном виде, что является компенсаторным механизмом. При метаболическом и респираторном ацидозе реабсорбируется больше
НСО3, что компенсирует сдвиг рН в кислую сторону.
2. Часть ионов Н+, секретируемых в про свет канальцев, выводится с мочой в виде иона HiPO^. Этот ион не может проходить из канальца через клеточную мембрану, попада ет он в канальцевую жидкость в составе пер вичной мочи, т.е. в процессе клубочковой фильтрации. Отрицательные заряды НРО^ уравновешены Na+ (Na2HPO4 — двузамешен- ный фосфат, его в крови и соответственно в моче в 4 раза больше однозамещенного NaH2PO4). Процесс можно представить сле дующим образом. Выделяющийся СО2 в эпи телиальных клетках канальца под воздейст вием карбоангидразы гидратируется, образо вавшаяся Н2СО3 диссоциирует на Н+ и HCOj. Последний остается в клетке, а ион Н+ сек ретируется в каналец и взаимодействует с двузамещенным фосфатом:
Na2HPO4 + Н+ -> NaH2PO4 + Na+.
Далее Na+ поступает в клетку стенки канальца и вместе с ионом НСОз — в интерсти-ций и кровь, a NaH2PO4 выводится с мочой.
3. Ионы Н+ диссоциирующей Н2СО3 выво дятся из организма также в виде иона N1$, который образуется в просвете канальца, куда поступают NH3 и ион Н+. Аммиак (NH3) образуется в эпителиальных клетках стенки канальцев из глутамина и аминокислот (ала- нина, глицина) во всех отделах нефрона. Мо лекула NH3 благодаря своему неполярному состоянию хорошо растворима в липидах, поэтому свободно диффундирует сквозь кле точную мембрану в просвет канальца. Обра зовавшийся ион аммония NH4, как и его соли NH4C1, (NH4)2SO4, через стенку каналь ца пройти не могут и выводятся с мочой (схема 17.3). Источником Н+, как и в предыдущих реакциях, является образующая ся в клетках угольная кислота. В обмен на Н+ в клетку поступает Na+ и вместе с НСОз, по стоянно образующимся в клетках стенок ка нальцев, переводится в интерстиций и кровь, причем наибольшая часть Н+ (около 70 %), секретируемых эпителием почечных каналь цев в их просвет, нейтрализуется (связывает ся). Скорость образования NH3 при необхо димости (например, при диабетическом аци дозе) может увеличиваться в 10 раз. При под- кислении среды возрастает активность глута- миназы, что ведет к усилению образования NH3, который взаимодействует с ионами Н+, образуя NH4.
Степень активности описанных буферных систем почки в разных отделах нефрона раз-
453

-
Еще некоторая часть ионов Н+ выво дится с мочой в свободном виде, в качестве противоиона выступает С1 (Н+ + СГ), что и определяет кислую реакцию мочи, причем ее обычная реакция (рН около 6,0) устанавли вается в дистальных извитых канальцах (в ос новном) и в собирательных трубках. Секре ция же Н+ идет на всем протяжении нефро на, но рН вторичной мочи практически не изменяется в других отделах нефрона, по скольку Н+ нейтрализуется в клетках каналь ца и в просвете его щелочными ионами НСОз- Наиболее высока скорость секреции Н+ в проксимальных извитых канальцах. По мере продвижения вторичной мочи по ка нальцам щелочные ее элементы реабсорбиру- ются, часть их расходуется на нейтрализацию Н+, но тем не менее рН вторичной мочи в дистальных извитых канальцах и собиратель ных трубках по мере ее продвижения быстро уменьшается.
-
В условиях вегетарианской диеты в крови накапливается избыток нелетучих ос нований, содержание щелочных ионов
при этом увеличивается. Почки в этих условиях также играют важную роль в поддержании рН крови: они выводят избыток бикарбонатов, моча имеет не кислую, как обычно (рН около 6,0), а щелочную реакцию. Диапазон колебаний рН мочи весьма значителен — от 4,5 до 8,5. При этом концентрация ионов Н+ может изменяться в 1000 раз. что является внешним показателем важной роли почек в регуляции рН крови.
В процессе регуляции различных констант организма почкой и в результате выполнения главной, экскреторной ее функции формируется состав конечной мочи.
