- •Прощекальников д.В. Лекции по дисциплине «Источники энергии теплотехнологии»
- •Сырьевые ресурсы.
- •Энергия.
- •Краткая характеристика источников энергии.
- •Лекция 2 (Раздел 2) Классификация источников энергии в теплотехнологии
- •Общепринятыми в классификации источников энергии является их деление на возобновляемые и невозобновляемые.
- •Лекция 3 (раздел 2)
- •Энергия солнца
- •Энергия ветра
- •Энергия биомассы
- •Использование низкопотенциального тепла земли
- •Использование энергии малых рек
- •1. Элементарный состав топлив.
- •2. Балласт, влага, зольность, выход летучих и характеристики золы.
- •Элементарный химический состав горючей массы различных видов твердого и жидкого топлив.
- •Минеральные примеси топлива.
- •Балласт топлива.
- •Зола топлива.
- •Зольность.
- •Влага топлива.
- •Гигроскопичность топлива.
- •Выход летучих и свойства кокса.
- •Лекция 5 (раздел 3)
- •Иллюстрация к определению энтальпии образования.
- •2 Способ определения теплоты сгорания (по Менделееву).
- •Второй закон термодинамики. Энтропия.
- •Лекция 6 (раздел 3) характеристики и состав энергоносителей. И влияние на процесс горения.
- •Классификация каменных углей по выходу летучих, спекаемости и характеристикам коксового остатка.
- •Нефть и нефтепродукты.
- •Структурно-групповой состав нефти. Растворенные газы. В условиях залегания они представляют собой гомологический ряд (от метана ch4 и до пентана c5h12).
- •Эти жидкие продукты составляют основы нефти. С с16н34 и далее эти парафины являются твердыми.
- •2 Нафтеновые соединения – насыщенные углеводороды, основанные главным образом на циклопентане, циклогексане и их производных.
- •Малопарафинистая – содержание парафина 1,5%,
- •Лекция 7 (разделы 3-4) характеристики и состав энергоносителей. (Продолжение)
- •Основы материального баланса и основные определения
- •1:1:1:3 (Кмоль)
- •Материальный баланс процесса горения.
- •Влияние минеральной части топлива на выход продуктов сгорания.
- •Лекция 8 (разделы 3-4) тепловой баланс процесса горения
- •Лекция 9 (раздел 5) Основы теории горения органического топлива
- •Лекция 10 (раздел 5) Основы теории горения органического топлива
- •Лекция 11 (раздел 6) Особенности горения газового топлива
- •Лекция 15-16 (раздел 8) Основы анализа и выбора рационального способа использования источников энергии теплотехнологий
Лекция 10 (раздел 5) Основы теории горения органического топлива

Механизмы химических реакций термического разложения углеводородов.
При пиролизе нефтепродуктов протекают 2 группы сложных обратимых реакций: первичные, проходящие с увеличением объема и с образованием пирогаза и вторичные, проходящие с уплотнением и приводящие к смолообразованию и коксованию
Первичные реакции
а) распад молекул предельных углеводородов с разрывом связи с-с (преимущественно в середине молекулы):

 СnН2n
+ 2
Сn’Н2n’
+ 2 + Cn’’Н2n’’
- Q
СnН2n
+ 2
Сn’Н2n’
+ 2 + Cn’’Н2n’’
- Q
б) дегидрирование предельных и нафтеновых углеводородов:

 СnН2n
+ 2 CnН2n
+ Н2
– Q
СnН2n
+ 2 CnН2n
+ Н2
– Q
СН2 СН2







 СН2
СН2
СН2
СН2
СН2
СН2
СН2
СН2



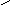 СН2
СН2
СН2
СН2
+ 3Н2 -
Q
СН2
СН2
СН2
СН2
+ 3Н2 -
Q
СН2 СН2
в) деалкилирование с отрывом боковой цепи:
СН СН



 СН
С - СН3
СН
СН
СН
С - СН3
СН
СН






 2
2 + СН2
= СН2
– Q
2
2 + СН2
= СН2
– Q


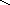
 СН
СН
СН
СН
СН
СН
СН
СН
СН СН
Гомоядерная ароматика (бензол, нафталин и пр.) не подвергается распаду.
Вторичные реакции
а) изомеризация предельных углеводородов:

 Н
– СnН2n+2
изо
– СnН2n+2
+ Q
Н
– СnН2n+2
изо
– СnН2n+2
+ Q
б) полимеризация:

 nС2Н4
(С2Н4)n
+ Q
nС2Н4
(С2Н4)n
+ Q
в) циклизация:
 СН2
СН2
 СН2
= СН (СН2)3СН3
CН2
СН2
+ Q
СН2
= СН (СН2)3СН3
CН2
СН2
+ Q
 СН2
СН2
СН2
СН2
СН2
г) дегидрирование олефинов с образованием диолефинов:

 СН2
= СН – СН2
– СН3
СН2
= СН – СН = СН2
+ Н2
+ Q
СН2
= СН – СН2
– СН3
СН2
= СН – СН = СН2
+ Н2
+ Q
д) конденсация диолефинов с олефинами:
СН2 СН


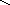





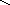 СН
СН2
СН
СН
СН
СН2
СН
СН


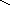


 +
2Н2 + Q
+
2Н2 + Q
СН СН2 СН СН
СН2 СН
Влияние давления
Х арактер
влияния давления на равновесие химических
реакций определяется знаком разности
числа молей газообразных участков
реакции n
или знаком изменения объёма V.
Для газовых реакций, в которых число
молей продуктов превышает число молей
реагентов, т.е.
арактер
влияния давления на равновесие химических
реакций определяется знаком разности
числа молей газообразных участков
реакции n
или знаком изменения объёма V.
Для газовых реакций, в которых число
молей продуктов превышает число молей
реагентов, т.е.
![]() n0,
увеличение давления неблагоприятно.
Смещению равновесия реакции вправо
способствует снижение давления. Если
же реакция протекает с уменьшением
числа молей
n0,
увеличение давления неблагоприятно.
Смещению равновесия реакции вправо
способствует снижение давления. Если
же реакция протекает с уменьшением
числа молей
![]() n0
повышение давления целесообразно - оно
смещает равновесие реакции в сторону
образования продуктов.
n0
повышение давления целесообразно - оно
смещает равновесие реакции в сторону
образования продуктов.
Влияние температуры
Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температур всегда благоприятствует накоплению веществ образующихся в данной реакции с поглощением теплоты, т.е. усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т.е. усиливает экзотермическое направление. При изменении температуры процесса равновесия смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температур. При повышении температур смещается равновесие в сторону исходных реагентов, понижение температур действует в противоположном направлении.