
- •Прощекальников д.В. Лекции по дисциплине «Источники энергии теплотехнологии»
- •Сырьевые ресурсы.
- •Энергия.
- •Краткая характеристика источников энергии.
- •Лекция 2 (Раздел 2) Классификация источников энергии в теплотехнологии
- •Общепринятыми в классификации источников энергии является их деление на возобновляемые и невозобновляемые.
- •Лекция 3 (раздел 2)
- •Энергия солнца
- •Энергия ветра
- •Энергия биомассы
- •Использование низкопотенциального тепла земли
- •Использование энергии малых рек
- •1. Элементарный состав топлив.
- •2. Балласт, влага, зольность, выход летучих и характеристики золы.
- •Элементарный химический состав горючей массы различных видов твердого и жидкого топлив.
- •Минеральные примеси топлива.
- •Балласт топлива.
- •Зола топлива.
- •Зольность.
- •Влага топлива.
- •Гигроскопичность топлива.
- •Выход летучих и свойства кокса.
- •Лекция 5 (раздел 3)
- •Иллюстрация к определению энтальпии образования.
- •2 Способ определения теплоты сгорания (по Менделееву).
- •Второй закон термодинамики. Энтропия.
- •Лекция 6 (раздел 3) характеристики и состав энергоносителей. И влияние на процесс горения.
- •Классификация каменных углей по выходу летучих, спекаемости и характеристикам коксового остатка.
- •Нефть и нефтепродукты.
- •Структурно-групповой состав нефти. Растворенные газы. В условиях залегания они представляют собой гомологический ряд (от метана ch4 и до пентана c5h12).
- •Эти жидкие продукты составляют основы нефти. С с16н34 и далее эти парафины являются твердыми.
- •2 Нафтеновые соединения – насыщенные углеводороды, основанные главным образом на циклопентане, циклогексане и их производных.
- •Малопарафинистая – содержание парафина 1,5%,
- •Лекция 7 (разделы 3-4) характеристики и состав энергоносителей. (Продолжение)
- •Основы материального баланса и основные определения
- •1:1:1:3 (Кмоль)
- •Материальный баланс процесса горения.
- •Влияние минеральной части топлива на выход продуктов сгорания.
- •Лекция 8 (разделы 3-4) тепловой баланс процесса горения
- •Лекция 9 (раздел 5) Основы теории горения органического топлива
- •Лекция 10 (раздел 5) Основы теории горения органического топлива
- •Лекция 11 (раздел 6) Особенности горения газового топлива
- •Лекция 15-16 (раздел 8) Основы анализа и выбора рационального способа использования источников энергии теплотехнологий
Иллюстрация к определению энтальпии образования.
Н

![]() (не
существует)
(не
существует)
простые вещества (Н2, О2, N2) нулевой

 уровень
уровень
![]()
![]()

Энергия связи возрастает, а образование уменьшается, следовательно эту систему выгодно образовать.
Реагент (i) – от лат. initial.
Н



![]()


 Реагент
Реагент
![]()

∆Н<0 – экзотермическая реакция, с выделением тепла.
∆ Н>0
– эндотермическая реакция, с поглощением
тепла.
Н>0
– эндотермическая реакция, с поглощением
тепла.
Состояние К – активированный комплекс.
Соответствующая реакция горения может быть представлена следующим образом:
Н
![]()

![]()
![]()


![]()
![]()

С начала образуется СО газ, затем он реагирует с кислородом и получается углекислый газ. Получается энтальпия сгорания (∆Н).
Энтальпия сгорания вещества.
Энтальпия (теплота сгорания) – это изменение энтальпии при полном сгорании единицы вещества (одного кг, моля, м3) с участием кислорода.
Стандартная теплота сгорания соответствует (если особо не оговорено) сгоранию до углекислого газа и воды. Для остальных веществ в каждом случае указываются продукты их окисления (сгорания).
Энтальпия сгорания сложного процесса всегда является суммарной теплотой эффектов реакций, составляющих процесс:
![]()
![]()
Пример:
Теплота сгорания молочной кислоты:
![]()
Эти
теплота (энтальпии сгорания) также
называются теплотворной способностью.
Например: теплотворная способность
метана высока
![]()
Закон Гесса и расчет энтальпий реакций.
Как уже было сказано выше, стандартную энтальпию реакций можно рассчитать, если известны стандартные энтальпии всех участников реакции.
Пример:
Для того чтобы прореагировал оксид водорода (НN3) необходимы особые условия.
![]()
![]()
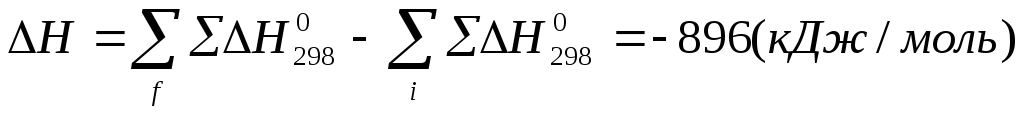
Закон Гесса:
Тепловой эффект реакции зависит лишь от природы и физического состояния исходных и конечных веществ, но не зависит от пути реакции и ее промежуточных стадий.
Выводы из закона Гесса:
-
Энтальпия образования вещества не зависит от способа его получения.
-
Энтальпия разложения вещества до исходных простых равна энтальпии образования взятой с обратным знаком.
-
Энтальпия реакции (тепловой эффект реакции) вычисляется с помощью энтальпий образования и продуктов реагентов.
Существует несколько способов определения теплоты сгорания.
1 способ (использование закона Гесса).
СН2=СН – СН3 (С3Н6)
![]() ,
,
где С3Н6, О2, СО2 – газы, а Н2О – жидкость.
![]()
![]()
![]()
Реакция 3 складывается из двух первых. Исходная реакция складывается из двух первых за вычетом третьей.
![]()
