- •Растворы. Титриметрический анализ.
- •Вода. Свойства воды как растворителя.
- •Растворы. Способы выражения концентраций растворов.
- •Посуда, применяемая в объемном анализе.
- •Титриметрический метод анализа
- •Способы фиксирования точки эквивалентности
- •Теория индикаторов Оствальда.
- •Титранты, их приготовление и стандартизация. Способы титрования.
- •Классификация титриметрических методов анализа
- •Окислительно-восстановительное титрование. Перманганатометрия.
- •Комплексонометрическое титрование
- •Метод осадительного титрования
- •Кривые кислотно-основного титрования
- •Вопросы для самоконтроля
- •Ход работы
- •Сущность работы:
- •Ход работы
- •Сущность работы:
- •Ход работы
- •Сущность работы:
- •Ход работы
- •Сущность работы: Основной реакцией определения ионов серебра является осаждение ионами роданида (метод Фольгарда):
- •Ход работы
- •Тесты для самоконтроля
- •Ответы к тестам
Кривые кислотно-основного титрования
Кривые титрования – графическое изображение изменения величины рH раствора в процессе титрования. Кривые строятся с помощью прибора рН-метра. Эти кривые даны теоретически для разных видов титрования.
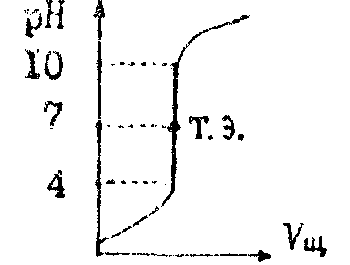
1.Рассмотрим титрование сильной кислоты сильным основанием
HCl+NaOH=NaCl+H2O
|
|
Особенно резкое изменение рН происходит около точки эквивалентности. Изменение, которое вызывается последней каплей титранта, называется скачком титрования. В данном случае скачок титрования при рН 4-10. При этом соль NaCl не гидролизуется. Поэтому точка эквивалентности всегда совпадает с точкой нейтральности (рН 7). |
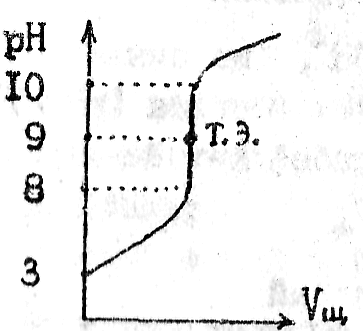
2. Титрование слабой кислоты сильным основанием.
СН3СООН+ NaOH=СН3СООNa+ H2O
|
|
Уксусная кислота – слабый электролит. Поэтому концентрация Н+ не равна концентрации кислоты. Соль СН3СООNa гидролизуется и в результате появляется избыток ионов ОН. В этом случае Т.Э. не совпадает с точкой нейтральности и лежит в щелочной области. Т.Э.~9. Скачок титрования =8-10 рН |
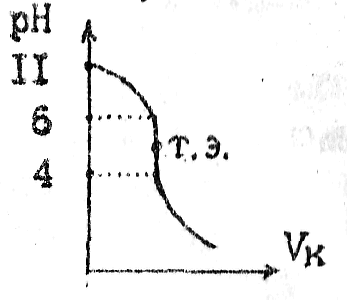
3. Титрование слабого основания сильной кислотой
NH4OH+HCl=NH4Cl+ H2O
|
|
Соль NH4Cl гидролизуется и в растворе появляется избыток ионов Н+. В этом случае Т.Э. находится в кислой области и равна ~5рН. Скачок титрования при 6-4рН. |
Правило выбора индикатора в кислотно-основном титровании:
При титровании используют такой индикатор, который изменяет свою окраску около Т.Э., т.е. интервал перехода окраски индикатора должен совпадать или захватывать скачок титрования на кривой титрования.
|
Кислота |
Основание |
Скачок титрования |
Т.Э. |
Индикатор |
Интервал перехода окраски индикаторов |
|
Сильная |
Сильное |
4-10 рН |
~7 рН |
Фенолфталеин Метиловый оранжевый Лакмус |
8-10 рН 3-4,5 рН
5-8 рН |
|
Слабая |
Сильное |
8-10 рН |
~9 рН |
Фенолфталеин |
8-10 рН |
|
Сильная |
Слабое |
6-4 рН |
~5 рН |
Метиловый оранжевый |
3-4,5 рН |
Определение кислотности желудочного сока титриметрическим методом.
Как изучалось ранее, определение кислотности желудочного сока позволяет диагностировать различные заболевания на ранних стадиях. Все биологические системы мутные и фиксировать точку эквивалентности при титровании тяжело.
Различают общую, активную и потенциальную кислотность. Общую кислотность желудочного сока определяют кондуктометрическим титрованием (изменение электропроводности), потенциометрией (изменение рН среды) и методом кислотно-основного титрования. Титруют желудочный сок 0,1N NaOH. Общую кислотность отличают от активной индикаторами. Так, согласно правилу выбора индикатора, для определения общей кислотности используют фенолфталеин, для активной - метиловый оранжевый. Кислотность выражают на практике в условных единицах (у.е.) 1 у.е. – число мл 0,1N NaOH, пошедшего на титрование 100 мл желудочного сока. Норма общей кислотности составляет 40-60ед, активной 20-40ед. Нормальность желудочного сока считается из расчета общей кислотности по формуле:
СN=V(NaOH)·N(NaOH)
Vж.с.
Установление точки эквивалентности электрохимическими методами.
Точку эквивалентности можно определить с помощью потенциометрического и кондуктометрического титрования. Они дают возможность:
-
Осуществлять дифференцированное титрование смесей сравнительно близких по свойствам кислот и гидроксидов без предварительного их разделения;
-
проводить определение в окрашенных и мутных растворах с высокой точностью и воспроизводимостью;
-
титровать разбавленные растворы.
Потенциометрическое титрование. В потенциометрическом титровании определение точки эквивалентности основано на измерении потенциала индикаторного электрода относительно электрода сравнения в ходе титрования исследуемого раствора. Для определения точки эквивалентности в кислотно-основном титровании достаточно следить только за концентрацией ионов Н+. Для этой цели могут быть использованы различные электроды - водородный, хингидронный, сурьмяный, стеклянный. Такой индикаторный электрод заменяет индикатор при обычном титровании. Потенциал этих электродов в данном методе является функцией концентрации ионов Н+. Он устанавливается быстро и не зависит от присутствия других ионов в растворе, которые не принимают участия в осуществляемой химической реакции.
Стандартный электрод или электрод сравнения - электрод, потенциал которого остается постоянным в процессе титрования. По отношению к потенциалу стандартного электрода определяют потенциал индикаторного электрода. Примером стандартного электрода является каломельный и хлорсеребряный.
Для проведения потенциометрического титрования собирают установку, которая включает источник тока, потенциометр (или рН-метр), гальваническую цепь из двух электродов - сравнительного и индикаторного, магнитную мешалку, бюретку со стандартным раствором и стакан с исследуемым раствором. Включают потенциометр, бюретку заполняют исследуемым раствором, включают мешалку. После каждого добавления стандартного раствора к неизвестному фиксируют ЭДС или рН. Результаты титрования записывают в таблицу и строят кривую титрования.
Таким образом, сущность метода состоит в измерении потенциала электрода, погруженного в титруемый раствор кислоты, и изменяющегося по мере добавления титранта (щелочи), причем в Т.Э. происходит резкое изменение потенциала. Кривые потенциометрического титрования строятся аналогично кривым кислотно-основного титрования. Преимуществом потенциометрического титрования является чувствительность метода, она выше объемного и кондуктометрического титрования.
Кондуктометрический метод. Точку эквивалентности определяют по изменению электрической проводимости раствора. Она зависит от концентрации и природы электролитов. Чем выше подвижность ионов, тем выше электрическая проводимость. Наибольшей подвижность обладают Н+ и ОН- ионы, объясняется это эстафетным механизмом их перемещения. Протоны, находящиеся в водных растворах кислот, не закреплены за определенными молекулами воды, а постоянно перескакивают с одной молекулы на другую. Величина электропроводности является прямолинейной функцией концентраций всех ионов в растворе, поэтому измерение электрической проводимости можно использовать для определения концентраций разбавленных электролитов.
Кондуктометрическое титрование широко применяют не только для количественного определения кислот, оснований, солей в различных жидкостях, но и для измерения константы диссоциации физиологически важных электролитов, изоэлектрической точки аминокислот, пептидов, белков.
Для кондуктометрического титрования требуется прибор для измерения электропроводности, платиновые электроды, стакан для титрования, бюретка и мешалка. По технике выполнения кондуктометрическое титрование напоминает потенциометрическое. Однако, при кондуктометрическом титровании не всегда получают кривую с ясно выраженным переломом в Т.Э. В этом случае Т.Э. определяют нахождением точки пересечения прямолинейных участков кривой до и после Т.Э.
Процесс кондуктометрического титрования основан на реакции нейтрализации, вместо ионов Н+ в растворе накапливаются ионы солей с меньшей подвижностью, а, следовательно, и проводимостью.
Н++Cl-+Na++OH-→H2O+Na++Cl-
В точке эквивалентности электропроводность χ будет минимальна, что показано на рисунке.
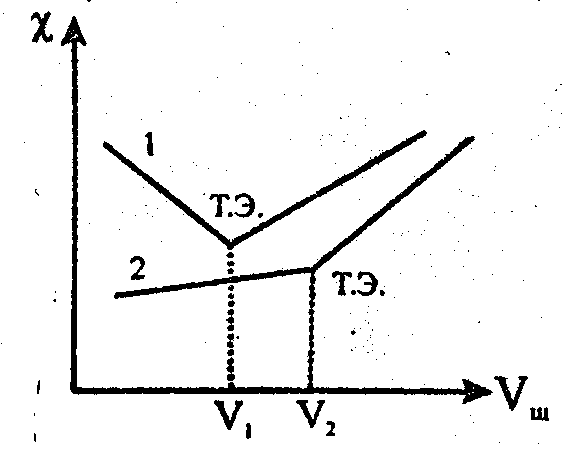
Добавление избытка щелочи приводит к появлению очень подвижных ионов OH-. Кривая 1 на графике - титрование сильной кислоты сильным основанием, кривая 2 – титрование слабой кислоты сильным основанием. Определив по графику точку эквивалентности, находят объем щелочи и рассчитывают нормальную концентрацию кислоты:
Nк=Nщ·Vщ
Vк