
- •Раздел I 10
- •Раздел II 49
- •Раздел III 57
- •Раздел IV 116
- •Раздел V 250
- •Раздел VI 358
- •Введение
- •РазделI общая фармакология
- •Лекция 1 фармакокинетика. Всасывание и пути введения лекарственных средств
- •Всасывание лекарственных средств
- •Биодоступность лекарственных средств
- •Биодоступность лекарственных средств зависит от возраста больного. В педиатрической практике необходимо считаться с особенностями всасывания у детей:
- •2. Сублингвальный (рассасывание под языком) и трансбуккальный (рассасывание за щекой) пути
- •3. Ректальный путь
- •Парентеральные пути введения
- •1. Введение под кожу
- •2. Введение в мышцы
- •3. Введение в вену
- •4. Введение в артерии
- •5. Внутрисердечный путь
- •6. Внутрикостный путь
- •7. Субарахноидальный и эпидуральный пути
- •8. Ингаляционный путь
- •9. Накожный путь
- •Лекция 2 распределение лекарственныхсредств в организме
- •Депонирование лекарственных средств
- •Реакции метаболической трансформации Окисление
- •Восстановление
- •Конъюгация
- •Индивидуальные особенности биотрансформации
- •Биотрансформация и эффекты лекарственных средств при энзимопатиях
- •Экскреция лекарственных средств
- •Взаимодействие лекарственных средств с циторецепторами
- •Виды действия лекарственных средств Местное и резорбтивное действие
- •Прямое и косвенное действие
- •Обратимое и необратимое действие
- •Главное и побочное действие
- •Избирательное (элективное) действие
- •Лекция 6
- •Фармакодинамика (Продолжение)
- •Эффекты при повторном приеме лекарственных средств
- •Кумуляция
- •Привыкание (толерантность)
- •Фармакокинетические механизмы привыкания
- •Фармакодинамические механизмы привыкания
- •Пристрастие
- •Синдром отдачи
- •Синдром отмены
- •Сенсибилизация
- •Эффекты при совместном приеме лекарственных средств
- •Синергизм
- •Антагонизм
- •Синерго-антагонизм
- •Зависимость действия лекарственных средств от дозы
- •Терапевтические дозы:
- •Токсические дозы:
- •Летальные дозы:
- •Виды фармакотерапии
- •РазделIi
- •Лекарственные средства, влияющие на афферентную иннервацию
- •Лекция 7
- •Местные анестетики
- •Механизм действия
- •Препараты местных анестетиков
- •Применение местных анестетиков Терминальная (поверхностная, концевая) анестезия
- •Проводниковая анестезия
- •Спинномозговая анестезия
- •Инфильтрационная анестезия
- •Резорбтивное действие местных анестетиков Влияние на нервную систему
- •Влияние на сердечно-сосудистую систему и гладкие мышцы
- •Отравление кокаином
- •Рефлекторное действие
- •Показания к применению
- •Раздражающие средства растительного происхождения
- •Синтетические раздражающие средства
- •Строение и функции синапсов
- •Адренергические синапсы
- •Адренорецепторы
- •Лекция 10 адреномиметики
- •Связь химической структуры адреномиметиков - производных фенилалкиламина с фармакологическим действием
- •Местное действие
- •Резорбтивное действие Влияние на цнс
- •Влияние на сердце
- •Влияние на артериальное давление
- •Влияние на органы с гладкой мускулатурой
- •Влияние на метаболизм
- •Применение резорбтивных эффектов
- •Избирательные -адреномиметики прямого действия
- •Избирательные β2-адреномиметики
- •Местное действие
- •Резорбтивное действие Влияние на цнс
- •Влияние на сердечно-сосудистую систему, органы с гладкой мускулатурой и метаболизм
- •Применение резорбтивных эффектов
- •Лекция 11
- •Фентоламин блокирует рецепторы серотонина и калиевые каналы мембран, уменьшает выделение гистамина из тучных клеток, тормозит секрецию инсулина.
- •Лекция 12
- •Фармакологические эффекты и применение Антиангинальное действие
- •Гипотензивное действие
- •Побочное действие неизбирательных β-адреноблокаторов
- •Препараты группы β-адреноблокаторов
- •Кардиоселективные β1-адреноблокаторы
- •Холинорецепторы
- •Лекция 15 антихолинэстеразные средства
- •Третичные амины
- •Четвертичные амины
- •Необратимые блокаторы холинэстеразы
- •Местное действие на глаз
- •Резорбтивное действие
- •Применение резорбтивных эффектов обратимых блокаторов холинэстеразы Заболевания нервной системы
- •Миастения
- •Атония гладких мышц
- •Декураризация
- •Острое отравление фос
- •Неотложная помощь при интоксикации фос:
- •Лекция 16
- •Местное действие на глаз
- •Резорбтивное действие Влияние на цнс
- •Синтетические м-холиноблокаторы
- •Применение м-холиноблокаторов Потенцированный наркоз
- •Вестибулярные расстройства
- •Аритмии
- •Хроническая обструктивная болезнь легких
- •Язвенная болезнь желудка и двенадцатиперстной кишки
- •Спазм гладкой мускулатуры
- •Острое отравление атропином
- •Лекция 17 ганглиоблокаторы
- •Эффекты блокады симпатических ганглиев Ортостатическая гипотензия
- •Эффекты блокады парасимпатических ганглиев Тахикардия
- •Расслабление гладких мышц бронхов, кишечника, желчевыводящих и мочевыводящих путей
- •Снижение секреторной функции потовых, слезных, слюнных, бронхиальных желез и секреции желудочного сока
- •Лекция 18
- •Деполяризующие миорелаксанты (лептокураре)
- •Применение миорелаксантов
- •Осложнения при применении миорелаксантов
- •Частота злокачественной гипертермии у детей — 1 случай на 15000 наблюдений, у взрослых — 1 на 100000.
- •Неодинаковая реакция структур цнс на действие общих анестетиков приводит к последовательному развитию стадий наркоза. Классические четыре стадии наркоза вызывает эфир:
- •Газовый наркоз
- •Лекция 20 неингаляционные наркозные средства
- •Лекция 21 спирт этиловый
- •Местное действие спирта этилового
- •Рефлекторное действие спирта этилового
- •Резорбтивное действие спирта этилового
- •Токсикокинетика спирта этилового
- •Влияние спирта этилового на цнс
- •Влияние спирта этилового на сердечно-сосудистую систему
- •Характеристика снотворных средств Производные бензодиазепина
- •Производные циклопирролона и имидазопиридина
- •Производные алифатического ряда
- •Производные этаноламина
- •Отравление снотворными средствами Острое отравление
- •Хроническое отравление
- •Лекция 23 противоэпилептические средства
- •Принципы лечения эпилепсии
- •Характеристика противоэпилептических средств Лекарственные средства, эффективные при тонико-клонических и парциальных припадках
- •Лекарственные средства, эффективные при абсансах
- •Лекарственные средства с широким противоэпилептическим спектром
- •Новые противоэпилептические средства
- •Лекция 24 фармакотерапия дегенеративных заболеваний цнс
- •Противопаркинсонические средства
- •Дофаминомиметики
- •Антагонисты nmda-рецепторов глутаминовой кислоты
- •Центральные м-холиноблокаторы
- •Лекарственные средства для лечения болезни альцгеймера
- •Нейропротекторы
- •Вазодилататоры
- •Противовоспалительные средства
- •Антиамилоидные стратегии терапии
- •Лекарственные средства для лечения хореи гентингтона
- •Лекарственные средства для лечения бокового амиотрофического склероза
- •Лекция 25 лекарственные средства для лечения мигрени
- •Лечение мигрени
- •Алкалоиды спорыньи
- •Селективные агонисты рецепторов серотонина
- •Лекция 26 седативные средства
- •Бромиды
- •Растительные седативные средства
- •Лекция 27 наркотические (опиоидные) анальгетики
- •Опиоидные рецепторы
- •Влияние на цнс Кора больших полушарий
- •Гипоталамус и железы внутренней секреции
- •Средний мозг
- •Продолговатый мозг Дыхательный центр
- •Центр блуждающего нерва
- •Влияние на органы с гладкой мускулатурой
- •Фармакокинетика
- •Острое отравление морфином
- •Хроническое отравление наркотическими анальгетиками
- •Лекция 28 ненаркотические анальгетики (нестероидные противовоспалительные средства)
- •Ингибирование молекул клеточной адгезии
- •Иммунотропное действие
- •В последнее время полагают, что ненаркотические анальгетики оказывают не только периферическое, но и центральное обезболивающее действие:
- •Жаропонижающее действие
- •Особенности действия и фармакокинетики препаратов
- •Лекция 29 психотропные средства. Нейролептики
- •1. Нейролептики (греч. Neuron - нерв,lepticos — способный воспринимать), илиАнтипсихотические средства
- •2. Транквилизаторы (лат. Tranquillium - спокойствие, покой), или анксиолитики(лат. Anxius - тревожный, полный боязни, охваченный страхом, греч. Lysis - растворение)
- •3. Антидепрессанты (греч. Anti- против, лат. Depressio— подавление)
- •5. Ноотропные средства (греч. Noos - душа, мысль, tropos - направление)
- •6. Нормотимические средства (соли лития)
- •Химическое строение
- •1. Производные фенотиазина
- •2. Производные тиоксантена
- •3. Производные бутирофенона
- •4. Производные замещенного бензамида
- •Психоседативное действие
- •Влияние на вегетативные функции Гипотермическое действие
- •Противорвотное действие
- •Ортостатическая гипотензия
- •Влияние на сердечную деятельность
- •Изменение секреции гормонов
- •Блокада м-холинорецепторов
- •Влияние на моторику
- •1. Производные фенотиазина с аминоалкильным радикалом
- •2. Производные фенотиазина с пиперидиновым радикалом
- •3. Производные тиоксантена
- •4. Производное бутирофенона
- •Антипсихотические нейролептики — дофаминоблокаторы
- •1. Производные фенотиазина с пиперазиновым радикалом
- •2. Производное бутирофенона
- •3. Производные замещенного бензамида сулыпирид
- •Атипичные нейролептики
- •Лекция 30
- •Психоседативное влияние
- •Активирующее влияние
- •Нейровегетотропное действие
- •Особенности действия, применение, фармакокинетика и побочные эффекты
- •Лекция 31 антидепрессанты
- •Ингибиторы нейронального захвата моноаминов
- •Неизбирательные блокаторы нейронального захвата
- •Избирательные блокаторы нейронального захвата серотонина
- •Ингибиторы мао
- •Имао с необратимым действием
- •Атипичные антидепрессанты
- •Лекция 32 нормотимические средства (соли лития)
- •Лекция 33
- •Влияние на нейрофизиологические процессы Повышение бодрствования мозга
- •Повышение змоционально-мотивационного реагирования
- •Оживление движений
- •Влияние на психофизиологические процессы
- •Препараты психомоторных стимуляторов
- •Производные фенилалкиламина
- •Производные ксантина
- •Психостимуляторы-адаптогены
- •Эффекты, механизм действия и применение
- •Лекция 34 ноотропные средства. Актопротекторы ноотропные средства
- •Механизм действия
- •Ноотропные средства, имеющие структуру гамк, оказывают противогипоксический эффект, модифицируя биохимические реакции гамк-шунта.
- •Повышение синтеза и выделения нейромедиаторов
- •Применение и особенности действия препаратов
- •Актопротекторы
- •Камфора
- •Виды действия камфоры Местное действие
- •Рефлекторное действие
- •Резорбтивное действие
- •Этимизол
- •Стрихнин
- •Фармакодинамика сердечных гликозидов в терапевтических дозах Влияние на сердце
- •Положительное инотропное (кардиотоническое, систолическое) действие
- •Влияние на электролитный обмен миокарда
- •Отрицательное дромотропное действие
- •Влияние на гемодинамику
- •Мочегонное действие
- •Фармакокинетика
- •Неполярные липофильные сердечные гликозиды
- •Сердечные гликозиды промежуточной полярности и липофильности
- •Полярные водорастворимые сердечные гликозиды
- •Лекция 37
- •Принципы назначения
- •Кардиальные симптомы
- •Внекардиальные симптомы
- •Диспепсические нарушения:
- •Лечение отравления
- •Нестероидные кардиотонические средства
- •Патогенез аритмий
- •Нарушение импульсообразования
- •Круговая волна возбуждения
- •Классификация противоаритмических средств
- •Iкласс - блокаторы натриевых каналов (мембраностабилизирующие средства)
- •IAкласс — блокаторы натриевых каналов, удлиняющие эрп
- •IBкласс — блокаторы натриевых каналов, укорачивающие эрп
- •Iс класс — блокаторы натриевых каналов, имеющие различное влияние на эрп
- •Лекция 39 противоаритмические средства (препараты II — V классов)
- •Iiкласс -β-адреноблокаторы
- •Средства с мембраностабилизирующим действием:
- •Средства с внутренней адреномиметической активностью:
- •Кардиоселективные средства:
- •Iiiкласс - блокаторы калиевых каналов, удлиняющие эрп
- •Vкласс - брадикардические средства
- •В нисходящем колене петли нефронареабсорбируется вода по осмотическому градиенту в гиперосмотический мозговой слой почки. Первичная моча становится гиперосмотической.
- •В реабсорбции ионов в дистальных извитых канальцах участвуют гормоны:
- •Типы транспорта веществ в почках
- •1. Пассивная диффузия
- •2. Активная диффузия в базальной мембране нефроцитов
- •Классификация По характеру мочегонного эффекта:
- •По локализации мочегонного действия в нефроне:
- •По силе мочегонного действия
- •Диуретики, повышающие фильтрацию в клубочках Диметилксантины
- •Диуретики. Тормозящие реабсорбцию в проксимальных извитых канальцах Ингибиторы карбоангидразы
- •Диуретики, тормозящие реабсорбцию в петле нефрона Осмотические диуретики
- •Лекция 41 мочегонные средства (сильнодействующие диуретики, тиазиды, тиазидоподобные и калийсберегающие диуретики) диуретики, тормозящие реабсорбцию в петле нефрона
- •Диуретики, тормозящие реабсорбцию в дистальных извитых канальцах
- •Гидрохлортиазид, стимулируя секрецию ренина → образование ангиотензина II→ секрецию альдостерона, не вызывает обратное развитие гипертрофии левого желудочка.
- •Антагонисты альдостерона
- •Блокаторы натриевых каналов
- •Лекция 42 вазопрессин
- •Физиология вазопрессина
- •Заболевания, вызванные нарушением функций вазопрессина
- •Лекция 43 противоподагрические средства
- •Лекция 44 антиангиналыные средства (нитраты, молсидомин, блокаторы кальциевых каналов)
- •Нитраты
- •Молсидомин
- •Блокаторы кальциевых каналов
- •Средства метаболической терапии
- •Классификация
- •Агонисты имидазолиновых i1-рецепторов
- •Центральные 2-адреномиметики
- •Лекция 46 антигипертензивные средства (продолжение) вазодилататоры
- •Блокаторы кальциевых каналов
- •Активаторы калиевых каналов
- •Ингибиторы ангиотензинпревращающего фермента
- •Эффекты иапф, связанные с подавлением активности плазменной рас:
- •Эффекты иапф, связанные с подавлением активности тканевой рас:
- •Блокаторы рецепторов ангиотензина II
- •Ингибиторы вазопептидазы
- •Характеристика липопротеинов
- •Статины
- •Секвестранты желчных кислот
- •Кислота никотиновая
- •Фибраты
- •РазделVi
- •Лекарственные средства, влияющие на систему крови
- •Лекция 49
- •Антиагреганты
- •Блокаторы рецепторов на тромбоцитах
- •Лекция 50 антикоагулянты
- •Антикоагулянты прямого действия (ингибиторы тромбина)
- •Гепарин обладает противоатеросклеротическими свойствами:
- •Антикоагулянты непрямого действия
- •Лекция 51 лекарственные средства, влияющие на фибринолиз стимуляторы фибринолиза (тромболитические средства)
- •Фибриннеспецифические тромболитические средства
- •Активаторы плазминогена
- •Фибринспецифические тромболитические средства — активаторы плазминогена
- •Ланотеплаза — делеционный мутант ретеплазы с дополнительной заменой аминокислот.
- •Ингибиторы фибринолиза
- •Лекция 52 стимуляторы эритропоэза для лечения макроцитарной анемии (витаминb12, кислота фолиевая) витамин b12
- •Шоу вскоре выздоровел и вернулся к творческой деятельности [Хьюз э. Бернард Шоу (серия биографий «Жизнь замечательных людей») — м., 1968].
- •Фармакокинетика
- •Механизм действия, применение, побочные эффекты
- •Профилактическое применение витамина в12 оправдано у строгих вегетарианцев, при удалении желудка, синдроме мальабсорбции. Инъекции необходимы один раз в месяц.
- •Кислота фолиевая
- •Фармакокинетика
- •Механизм действия, применение
- •В медицинской практике используют синтетический препарат кислоты фолиевой для приема внутрь. Она входит также в состав многих поливитаминных средств.
- •Терапия препаратами железа
- •Препараты железа для приема внутрь
- •Токсическое действие препаратов железа
- •Отравление препаратами железа
- •Известны следующие гемопоэтические факторы: эритропоэтин (еро)
- •Фактор стволовых клеток (skf)
- •Интерлейкины-1-12
- •Гранулоцитарно-макрофагальный колониестимулирующий фактор (gm-csf)
- •Факторы роста миелоидных клеток
- •Лекция 54 фармакологическая несовместимость
- •Фармакокинетическая несовместимость
- •Несовместимость при всасывании
- •1. Изменение рН среды, из которой происходит всасывание:
- •2. Изменение интенсивности перистальтики кишечника:
- •3. Образование нерастворимых, не всасывающихся комплексов лекарственных средств:
- •4. Изменение функции гликопротеина р26:
- •2. Изменение проницаемости клеточных мембран:
- •3. Расширение области распространения лекарственных средств в органе.
- •Несовместимость при биотрансформации
- •Несовместимость при экскреции
- •Фармакодинамическая несовместимость
- •Несовместимость вследствие синергизма
- •1. Превращение терапевтических эффектов в токсические, превышение предела работоспособности клеток и органов:
- •2. Извращение фармакологических эффектов:
- •3. Усиление побочных эффектов лекарственных средств:
- •Несовместимость вследствие физиологического антагонизма лекарственных средств:
Реакции метаболической трансформации Окисление
В ЭПР функционируют НАДФ•Н- и НАД•Н-зависимые дыхательные цепи. В НАДФ•Н-зависимой системе терминальным переносчиком электронов является цитохром Р-450 — мембраносвязанный липофильный фермент группы многоцелевых монооксигеназ2, гемопротеин, состоящий из белка и системы порфирина с трехвалентным железом. буква Р в названии происходит от слова пигмент, число 450 означает, что восстановленный, связанный с окисью углерода цитохром максимально поглощает свет с длиной волны 450 нм.
Цитохром Р-450 глубоко погружен в липидный бислой мембраны ЭПР и функционирует совместно с НАДФ•Н-зависимой цитохром Р-450-редуктазой (коферменты — флавинадениндинуклеотид и флавинаденин-мононуклеотид). Соотношение количества молекул цитохрома Р-450 и редуктазы составляет 10:1. Активный центр этих ферментов ориентирован на цитоплазматическую поверхность ЭПР. Цикл окисления лекарственных средств при участии цитохрома Р-450 состоит из следующих реакций (рис. 1):
окисленный цитохром Р-450 присоединяет лекарственное средство;
бинарный комплекс цитохром — лекарство восстанавливается цитохром Р-450-редуктазой, используя электрон НАДФ•Н;
восстановленный комплекс цитохром Р-450 — лекарство связывается с молекулярным (триплетным) кислородом;
происходит активация кислорода электроном НАДФ•Н (триплетный кислород становится синглетным);
на финальном этапе один атом кислорода включается в молекулу окисляемого лекарственного средства, второй — включается в молекулу воды;
 ц
ц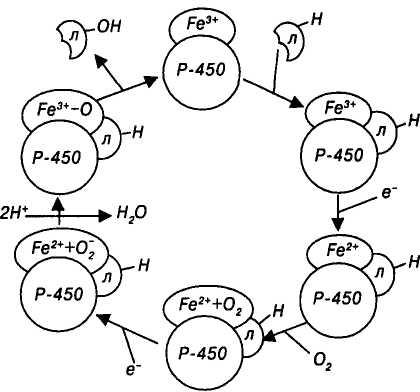 итохромР-450
регенерирует в исходную окисленную
форму.
итохромР-450
регенерирует в исходную окисленную
форму.
Н
Рис. 1. Механизм окисления лекарственных
средств при участии цитохрома Р-450
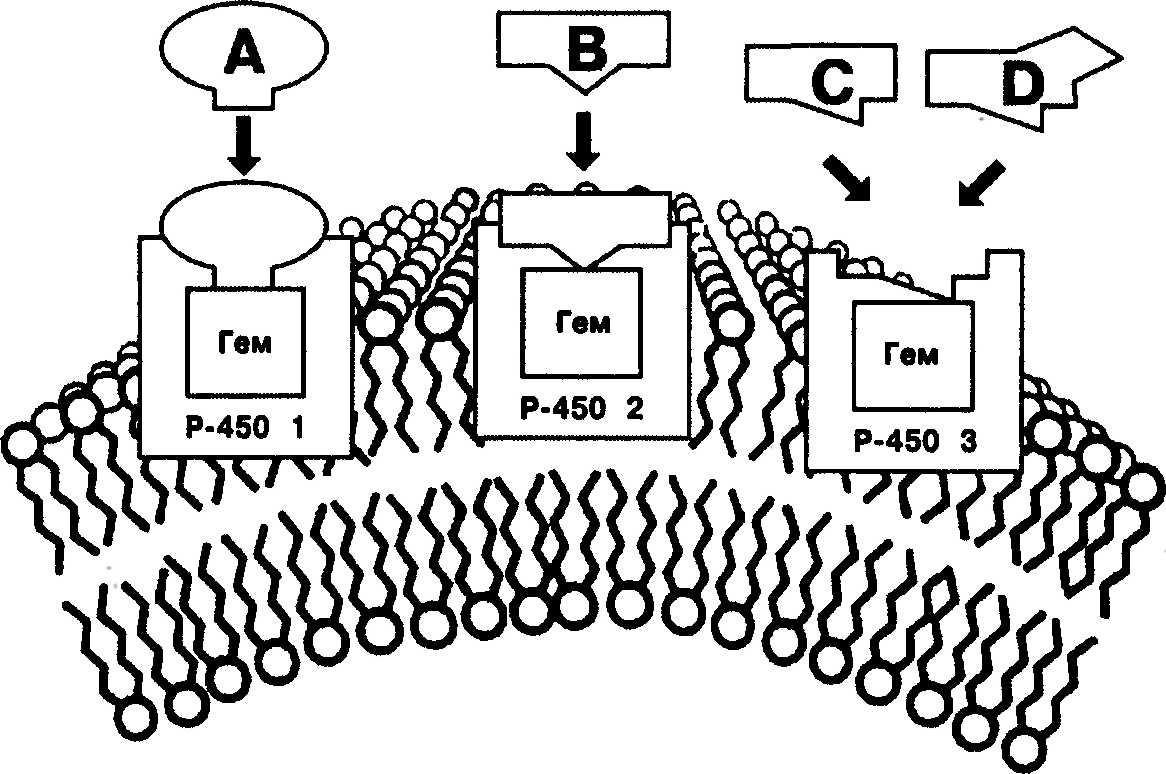
Рис. 2. Изоферменты
цитохрома Р-450
Суперсемейство цитохромов Р-450 поражает своими почти неограниченными метаболическими возможностями. Оно включает более 1000 клонированных вариантов, способных катализировать около 60 типов энзиматических реакций с тысячами потенциальных субстратов. В клетках человека обнаружено 17 семейств цитохрома Р-450, разделенных на 39 подсемейств. Изоферменты обозначаются следующим образом: первая цифра обозначает семейство, затем латинская буква указывает на подсемейство, последняя цифра соответствует конкретному изоферменту. В молекулах изоферментов одного семейства идентичны более 40 % аминокислот, в молекулах одного подсемейства — более 55 %.
Метод фенотипирования позволяет установить субстратную специфичность изоферментов цитохрома Р-450 по соотношению концентраций неизмененного вещества и его метаболитов в крови. Методом генотипирования с помощью полимеразной цепной реакции (ПЦР) изоферменты идентифицируют по их генам, так как каждый изофермент кодируется одним из 53 генов, локализованных в разных локусах хромосом. Большинство реакций катализируют изоферменты цитохрома Р-450 семейств 1, 2 и 3 (рис. 2, табл. 7).
Реакция окисления ксенобиотиков при участии цитохрома Р-450 расщепляется с образованием свободных радикалов кислорода и токсических промежуточных продуктов (эпоксиды, N-, S-окиси, альдегиды). свободные радикалы и активные интермедиаты, инициируя перекисное окисление мембранных липидов, вызывают некроз клеток, появление неоантигенов, тератогенный, эмбриотоксический эффекты, мутации, канцерогенез и ускорение старения. По этой причине не существует абсолютно безвредных ксенобиотиков.
Таблица 7. Содержание изоферментов цитохрома Р-450 в печени человека, их вклад в окисление лекарственных средств, локализация в хромосомах, индукторы и ингибиторы
|
Изоферменты цитохрома Р-450 |
Содержание в печени, % |
Вклад в окисление, % |
Локус в хромосоме (первая цифра — номер хромосомы) |
Индукторы |
Ингибиторы |
|
1А1 |
<1 |
2,5 |
15q22-q24 |
Полициклические ароматические углеводороды (в легких преобразуются в канцерогенные метаболиты) |
|
|
1А2 |
13 |
8,2 |
15q22-qter |
Фенобарбитал, гексамидин, дифенин, рифампицин, полициклические ароматические углеводороды, никотин |
Амитриптилин, имипрамин, такрин, мексилетин, верапамил, дилтиазем, тиклопидин, эритромицин, кларитромицин, фторхинолоны (ципрофлоксацин, норфлоксацин, эноксацин), препараты интерферона, фурацилин |
|
1В1 |
<1 |
Не установлен |
2q22-q22 |
|
|
|
2А6 |
4 |
2,5 |
19q13.2 |
Фенобарбитал |
Ритонавир |
|
2В6 |
<1 |
3,4 |
19q13.2 |
Фенобарбитал, гексамидин, дифенин |
Орфенандрин |
|
2С8 |
Не установлено |
Не установлен |
10q24.1 |
Фенобарбитал, гексамидин |
|
|
2С9 |
18 |
15,8 |
10q24.1-24.3 |
Дифенин, рифампицин |
Бутадион, диклофенак, кетопрофен, амиодарон, флувастатин, зафирлукаст, тетурам, сульфаметоксазол, дапсон |
|
2С18 |
Не установлено |
Не установлен |
Локус в хромосоме 10 |
|
Циметидин |
|
2С19 |
1 |
8,3 |
10q24.1-24.3 |
Фенобарбитал, гексамидин, дифенин, рифампицин |
Имипрамин, флувоксамин, флуоксетин, омепразол |
|
2D6 |
2,5 |
18,8 |
22q13.1 |
|
Тиоридазин, галоперидол, имипрамин, кломипрамин, флувоксамин, флуоксетин, пароксетин, сертралин, хинидин, пропафенон, амиодарон, циметидин |
|
2Е1 |
7 |
4,1 |
10q24.3qter |
Этиловый спирт, пиразол, пиридин |
Тетурам, ритонавир |
|
ЗА4 |
28 |
34,1 |
7q22.1 |
Фенобарбитал, гексамидин, дифенин, карбамазепин, глюкокортикоиды, рифампицин, рифабутин, сульфинпразон |
Флуоксетин, флувоксамин, пароксети н, хинидин, дилтиазем, циметидин, зафирлукаст, эритромицин, кларитромицин, флуконазол, итраконазол, клотримазол, индинавир, нелфинавир, метронидазол |
|
ЗА5 |
Не установлено |
11 |
7q22.1 |
Фенобарбитал, гексамидин, дифенин, рифампицин |
Кетоконазол, клотримазол, миконазол, метронидазол |
Токсические продукты биотрансформации обезвреживаются конъюгацией с восстановленным глутатионом и ковалентным связыванием с альбуминами. Повреждение молекулы альбумина не опасно для организма, так как этот белок синтезируется в печени со скоростью 10 — 16г в сут. и присутствует в высоких концентрациях в ЭПР.
Ксенобиотики в процессе окисления могут разрушать цитохром Р-450. Такие вещества получили название «суицидные субстраты». Свойствами «суицидных субстратов» обладают четыреххлористый углерод, фторотан, парацетамол, преобразуемые цитохромом Р-450 в свободные радикалы. Их эффект можно рассматривать не только как токсический, но и как защитный — элиминируются молекулы цитохрома Р-450, генерирующие реакционноспособные метаболиты.
