
- •Раздел I 10
- •Раздел II 49
- •Раздел III 57
- •Раздел IV 116
- •Раздел V 250
- •Раздел VI 358
- •Введение
- •РазделI общая фармакология
- •Лекция 1 фармакокинетика. Всасывание и пути введения лекарственных средств
- •Всасывание лекарственных средств
- •Биодоступность лекарственных средств
- •Биодоступность лекарственных средств зависит от возраста больного. В педиатрической практике необходимо считаться с особенностями всасывания у детей:
- •2. Сублингвальный (рассасывание под языком) и трансбуккальный (рассасывание за щекой) пути
- •3. Ректальный путь
- •Парентеральные пути введения
- •1. Введение под кожу
- •2. Введение в мышцы
- •3. Введение в вену
- •4. Введение в артерии
- •5. Внутрисердечный путь
- •6. Внутрикостный путь
- •7. Субарахноидальный и эпидуральный пути
- •8. Ингаляционный путь
- •9. Накожный путь
- •Лекция 2 распределение лекарственныхсредств в организме
- •Депонирование лекарственных средств
- •Реакции метаболической трансформации Окисление
- •Восстановление
- •Конъюгация
- •Индивидуальные особенности биотрансформации
- •Биотрансформация и эффекты лекарственных средств при энзимопатиях
- •Экскреция лекарственных средств
- •Взаимодействие лекарственных средств с циторецепторами
- •Виды действия лекарственных средств Местное и резорбтивное действие
- •Прямое и косвенное действие
- •Обратимое и необратимое действие
- •Главное и побочное действие
- •Избирательное (элективное) действие
- •Лекция 6
- •Фармакодинамика (Продолжение)
- •Эффекты при повторном приеме лекарственных средств
- •Кумуляция
- •Привыкание (толерантность)
- •Фармакокинетические механизмы привыкания
- •Фармакодинамические механизмы привыкания
- •Пристрастие
- •Синдром отдачи
- •Синдром отмены
- •Сенсибилизация
- •Эффекты при совместном приеме лекарственных средств
- •Синергизм
- •Антагонизм
- •Синерго-антагонизм
- •Зависимость действия лекарственных средств от дозы
- •Терапевтические дозы:
- •Токсические дозы:
- •Летальные дозы:
- •Виды фармакотерапии
- •РазделIi
- •Лекарственные средства, влияющие на афферентную иннервацию
- •Лекция 7
- •Местные анестетики
- •Механизм действия
- •Препараты местных анестетиков
- •Применение местных анестетиков Терминальная (поверхностная, концевая) анестезия
- •Проводниковая анестезия
- •Спинномозговая анестезия
- •Инфильтрационная анестезия
- •Резорбтивное действие местных анестетиков Влияние на нервную систему
- •Влияние на сердечно-сосудистую систему и гладкие мышцы
- •Отравление кокаином
- •Рефлекторное действие
- •Показания к применению
- •Раздражающие средства растительного происхождения
- •Синтетические раздражающие средства
- •Строение и функции синапсов
- •Адренергические синапсы
- •Адренорецепторы
- •Лекция 10 адреномиметики
- •Связь химической структуры адреномиметиков - производных фенилалкиламина с фармакологическим действием
- •Местное действие
- •Резорбтивное действие Влияние на цнс
- •Влияние на сердце
- •Влияние на артериальное давление
- •Влияние на органы с гладкой мускулатурой
- •Влияние на метаболизм
- •Применение резорбтивных эффектов
- •Избирательные -адреномиметики прямого действия
- •Избирательные β2-адреномиметики
- •Местное действие
- •Резорбтивное действие Влияние на цнс
- •Влияние на сердечно-сосудистую систему, органы с гладкой мускулатурой и метаболизм
- •Применение резорбтивных эффектов
- •Лекция 11
- •Фентоламин блокирует рецепторы серотонина и калиевые каналы мембран, уменьшает выделение гистамина из тучных клеток, тормозит секрецию инсулина.
- •Лекция 12
- •Фармакологические эффекты и применение Антиангинальное действие
- •Гипотензивное действие
- •Побочное действие неизбирательных β-адреноблокаторов
- •Препараты группы β-адреноблокаторов
- •Кардиоселективные β1-адреноблокаторы
- •Холинорецепторы
- •Лекция 15 антихолинэстеразные средства
- •Третичные амины
- •Четвертичные амины
- •Необратимые блокаторы холинэстеразы
- •Местное действие на глаз
- •Резорбтивное действие
- •Применение резорбтивных эффектов обратимых блокаторов холинэстеразы Заболевания нервной системы
- •Миастения
- •Атония гладких мышц
- •Декураризация
- •Острое отравление фос
- •Неотложная помощь при интоксикации фос:
- •Лекция 16
- •Местное действие на глаз
- •Резорбтивное действие Влияние на цнс
- •Синтетические м-холиноблокаторы
- •Применение м-холиноблокаторов Потенцированный наркоз
- •Вестибулярные расстройства
- •Аритмии
- •Хроническая обструктивная болезнь легких
- •Язвенная болезнь желудка и двенадцатиперстной кишки
- •Спазм гладкой мускулатуры
- •Острое отравление атропином
- •Лекция 17 ганглиоблокаторы
- •Эффекты блокады симпатических ганглиев Ортостатическая гипотензия
- •Эффекты блокады парасимпатических ганглиев Тахикардия
- •Расслабление гладких мышц бронхов, кишечника, желчевыводящих и мочевыводящих путей
- •Снижение секреторной функции потовых, слезных, слюнных, бронхиальных желез и секреции желудочного сока
- •Лекция 18
- •Деполяризующие миорелаксанты (лептокураре)
- •Применение миорелаксантов
- •Осложнения при применении миорелаксантов
- •Частота злокачественной гипертермии у детей — 1 случай на 15000 наблюдений, у взрослых — 1 на 100000.
- •Неодинаковая реакция структур цнс на действие общих анестетиков приводит к последовательному развитию стадий наркоза. Классические четыре стадии наркоза вызывает эфир:
- •Газовый наркоз
- •Лекция 20 неингаляционные наркозные средства
- •Лекция 21 спирт этиловый
- •Местное действие спирта этилового
- •Рефлекторное действие спирта этилового
- •Резорбтивное действие спирта этилового
- •Токсикокинетика спирта этилового
- •Влияние спирта этилового на цнс
- •Влияние спирта этилового на сердечно-сосудистую систему
- •Характеристика снотворных средств Производные бензодиазепина
- •Производные циклопирролона и имидазопиридина
- •Производные алифатического ряда
- •Производные этаноламина
- •Отравление снотворными средствами Острое отравление
- •Хроническое отравление
- •Лекция 23 противоэпилептические средства
- •Принципы лечения эпилепсии
- •Характеристика противоэпилептических средств Лекарственные средства, эффективные при тонико-клонических и парциальных припадках
- •Лекарственные средства, эффективные при абсансах
- •Лекарственные средства с широким противоэпилептическим спектром
- •Новые противоэпилептические средства
- •Лекция 24 фармакотерапия дегенеративных заболеваний цнс
- •Противопаркинсонические средства
- •Дофаминомиметики
- •Антагонисты nmda-рецепторов глутаминовой кислоты
- •Центральные м-холиноблокаторы
- •Лекарственные средства для лечения болезни альцгеймера
- •Нейропротекторы
- •Вазодилататоры
- •Противовоспалительные средства
- •Антиамилоидные стратегии терапии
- •Лекарственные средства для лечения хореи гентингтона
- •Лекарственные средства для лечения бокового амиотрофического склероза
- •Лекция 25 лекарственные средства для лечения мигрени
- •Лечение мигрени
- •Алкалоиды спорыньи
- •Селективные агонисты рецепторов серотонина
- •Лекция 26 седативные средства
- •Бромиды
- •Растительные седативные средства
- •Лекция 27 наркотические (опиоидные) анальгетики
- •Опиоидные рецепторы
- •Влияние на цнс Кора больших полушарий
- •Гипоталамус и железы внутренней секреции
- •Средний мозг
- •Продолговатый мозг Дыхательный центр
- •Центр блуждающего нерва
- •Влияние на органы с гладкой мускулатурой
- •Фармакокинетика
- •Острое отравление морфином
- •Хроническое отравление наркотическими анальгетиками
- •Лекция 28 ненаркотические анальгетики (нестероидные противовоспалительные средства)
- •Ингибирование молекул клеточной адгезии
- •Иммунотропное действие
- •В последнее время полагают, что ненаркотические анальгетики оказывают не только периферическое, но и центральное обезболивающее действие:
- •Жаропонижающее действие
- •Особенности действия и фармакокинетики препаратов
- •Лекция 29 психотропные средства. Нейролептики
- •1. Нейролептики (греч. Neuron - нерв,lepticos — способный воспринимать), илиАнтипсихотические средства
- •2. Транквилизаторы (лат. Tranquillium - спокойствие, покой), или анксиолитики(лат. Anxius - тревожный, полный боязни, охваченный страхом, греч. Lysis - растворение)
- •3. Антидепрессанты (греч. Anti- против, лат. Depressio— подавление)
- •5. Ноотропные средства (греч. Noos - душа, мысль, tropos - направление)
- •6. Нормотимические средства (соли лития)
- •Химическое строение
- •1. Производные фенотиазина
- •2. Производные тиоксантена
- •3. Производные бутирофенона
- •4. Производные замещенного бензамида
- •Психоседативное действие
- •Влияние на вегетативные функции Гипотермическое действие
- •Противорвотное действие
- •Ортостатическая гипотензия
- •Влияние на сердечную деятельность
- •Изменение секреции гормонов
- •Блокада м-холинорецепторов
- •Влияние на моторику
- •1. Производные фенотиазина с аминоалкильным радикалом
- •2. Производные фенотиазина с пиперидиновым радикалом
- •3. Производные тиоксантена
- •4. Производное бутирофенона
- •Антипсихотические нейролептики — дофаминоблокаторы
- •1. Производные фенотиазина с пиперазиновым радикалом
- •2. Производное бутирофенона
- •3. Производные замещенного бензамида сулыпирид
- •Атипичные нейролептики
- •Лекция 30
- •Психоседативное влияние
- •Активирующее влияние
- •Нейровегетотропное действие
- •Особенности действия, применение, фармакокинетика и побочные эффекты
- •Лекция 31 антидепрессанты
- •Ингибиторы нейронального захвата моноаминов
- •Неизбирательные блокаторы нейронального захвата
- •Избирательные блокаторы нейронального захвата серотонина
- •Ингибиторы мао
- •Имао с необратимым действием
- •Атипичные антидепрессанты
- •Лекция 32 нормотимические средства (соли лития)
- •Лекция 33
- •Влияние на нейрофизиологические процессы Повышение бодрствования мозга
- •Повышение змоционально-мотивационного реагирования
- •Оживление движений
- •Влияние на психофизиологические процессы
- •Препараты психомоторных стимуляторов
- •Производные фенилалкиламина
- •Производные ксантина
- •Психостимуляторы-адаптогены
- •Эффекты, механизм действия и применение
- •Лекция 34 ноотропные средства. Актопротекторы ноотропные средства
- •Механизм действия
- •Ноотропные средства, имеющие структуру гамк, оказывают противогипоксический эффект, модифицируя биохимические реакции гамк-шунта.
- •Повышение синтеза и выделения нейромедиаторов
- •Применение и особенности действия препаратов
- •Актопротекторы
- •Камфора
- •Виды действия камфоры Местное действие
- •Рефлекторное действие
- •Резорбтивное действие
- •Этимизол
- •Стрихнин
- •Фармакодинамика сердечных гликозидов в терапевтических дозах Влияние на сердце
- •Положительное инотропное (кардиотоническое, систолическое) действие
- •Влияние на электролитный обмен миокарда
- •Отрицательное дромотропное действие
- •Влияние на гемодинамику
- •Мочегонное действие
- •Фармакокинетика
- •Неполярные липофильные сердечные гликозиды
- •Сердечные гликозиды промежуточной полярности и липофильности
- •Полярные водорастворимые сердечные гликозиды
- •Лекция 37
- •Принципы назначения
- •Кардиальные симптомы
- •Внекардиальные симптомы
- •Диспепсические нарушения:
- •Лечение отравления
- •Нестероидные кардиотонические средства
- •Патогенез аритмий
- •Нарушение импульсообразования
- •Круговая волна возбуждения
- •Классификация противоаритмических средств
- •Iкласс - блокаторы натриевых каналов (мембраностабилизирующие средства)
- •IAкласс — блокаторы натриевых каналов, удлиняющие эрп
- •IBкласс — блокаторы натриевых каналов, укорачивающие эрп
- •Iс класс — блокаторы натриевых каналов, имеющие различное влияние на эрп
- •Лекция 39 противоаритмические средства (препараты II — V классов)
- •Iiкласс -β-адреноблокаторы
- •Средства с мембраностабилизирующим действием:
- •Средства с внутренней адреномиметической активностью:
- •Кардиоселективные средства:
- •Iiiкласс - блокаторы калиевых каналов, удлиняющие эрп
- •Vкласс - брадикардические средства
- •В нисходящем колене петли нефронареабсорбируется вода по осмотическому градиенту в гиперосмотический мозговой слой почки. Первичная моча становится гиперосмотической.
- •В реабсорбции ионов в дистальных извитых канальцах участвуют гормоны:
- •Типы транспорта веществ в почках
- •1. Пассивная диффузия
- •2. Активная диффузия в базальной мембране нефроцитов
- •Классификация По характеру мочегонного эффекта:
- •По локализации мочегонного действия в нефроне:
- •По силе мочегонного действия
- •Диуретики, повышающие фильтрацию в клубочках Диметилксантины
- •Диуретики. Тормозящие реабсорбцию в проксимальных извитых канальцах Ингибиторы карбоангидразы
- •Диуретики, тормозящие реабсорбцию в петле нефрона Осмотические диуретики
- •Лекция 41 мочегонные средства (сильнодействующие диуретики, тиазиды, тиазидоподобные и калийсберегающие диуретики) диуретики, тормозящие реабсорбцию в петле нефрона
- •Диуретики, тормозящие реабсорбцию в дистальных извитых канальцах
- •Гидрохлортиазид, стимулируя секрецию ренина → образование ангиотензина II→ секрецию альдостерона, не вызывает обратное развитие гипертрофии левого желудочка.
- •Антагонисты альдостерона
- •Блокаторы натриевых каналов
- •Лекция 42 вазопрессин
- •Физиология вазопрессина
- •Заболевания, вызванные нарушением функций вазопрессина
- •Лекция 43 противоподагрические средства
- •Лекция 44 антиангиналыные средства (нитраты, молсидомин, блокаторы кальциевых каналов)
- •Нитраты
- •Молсидомин
- •Блокаторы кальциевых каналов
- •Средства метаболической терапии
- •Классификация
- •Агонисты имидазолиновых i1-рецепторов
- •Центральные 2-адреномиметики
- •Лекция 46 антигипертензивные средства (продолжение) вазодилататоры
- •Блокаторы кальциевых каналов
- •Активаторы калиевых каналов
- •Ингибиторы ангиотензинпревращающего фермента
- •Эффекты иапф, связанные с подавлением активности плазменной рас:
- •Эффекты иапф, связанные с подавлением активности тканевой рас:
- •Блокаторы рецепторов ангиотензина II
- •Ингибиторы вазопептидазы
- •Характеристика липопротеинов
- •Статины
- •Секвестранты желчных кислот
- •Кислота никотиновая
- •Фибраты
- •РазделVi
- •Лекарственные средства, влияющие на систему крови
- •Лекция 49
- •Антиагреганты
- •Блокаторы рецепторов на тромбоцитах
- •Лекция 50 антикоагулянты
- •Антикоагулянты прямого действия (ингибиторы тромбина)
- •Гепарин обладает противоатеросклеротическими свойствами:
- •Антикоагулянты непрямого действия
- •Лекция 51 лекарственные средства, влияющие на фибринолиз стимуляторы фибринолиза (тромболитические средства)
- •Фибриннеспецифические тромболитические средства
- •Активаторы плазминогена
- •Фибринспецифические тромболитические средства — активаторы плазминогена
- •Ланотеплаза — делеционный мутант ретеплазы с дополнительной заменой аминокислот.
- •Ингибиторы фибринолиза
- •Лекция 52 стимуляторы эритропоэза для лечения макроцитарной анемии (витаминb12, кислота фолиевая) витамин b12
- •Шоу вскоре выздоровел и вернулся к творческой деятельности [Хьюз э. Бернард Шоу (серия биографий «Жизнь замечательных людей») — м., 1968].
- •Фармакокинетика
- •Механизм действия, применение, побочные эффекты
- •Профилактическое применение витамина в12 оправдано у строгих вегетарианцев, при удалении желудка, синдроме мальабсорбции. Инъекции необходимы один раз в месяц.
- •Кислота фолиевая
- •Фармакокинетика
- •Механизм действия, применение
- •В медицинской практике используют синтетический препарат кислоты фолиевой для приема внутрь. Она входит также в состав многих поливитаминных средств.
- •Терапия препаратами железа
- •Препараты железа для приема внутрь
- •Токсическое действие препаратов железа
- •Отравление препаратами железа
- •Известны следующие гемопоэтические факторы: эритропоэтин (еро)
- •Фактор стволовых клеток (skf)
- •Интерлейкины-1-12
- •Гранулоцитарно-макрофагальный колониестимулирующий фактор (gm-csf)
- •Факторы роста миелоидных клеток
- •Лекция 54 фармакологическая несовместимость
- •Фармакокинетическая несовместимость
- •Несовместимость при всасывании
- •1. Изменение рН среды, из которой происходит всасывание:
- •2. Изменение интенсивности перистальтики кишечника:
- •3. Образование нерастворимых, не всасывающихся комплексов лекарственных средств:
- •4. Изменение функции гликопротеина р26:
- •2. Изменение проницаемости клеточных мембран:
- •3. Расширение области распространения лекарственных средств в органе.
- •Несовместимость при биотрансформации
- •Несовместимость при экскреции
- •Фармакодинамическая несовместимость
- •Несовместимость вследствие синергизма
- •1. Превращение терапевтических эффектов в токсические, превышение предела работоспособности клеток и органов:
- •2. Извращение фармакологических эффектов:
- •3. Усиление побочных эффектов лекарственных средств:
- •Несовместимость вследствие физиологического антагонизма лекарственных средств:
Ингибиторы ангиотензинпревращающего фермента
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) подавляют ключевой фермент РАС, связывая ионы цинка в его активном центре. ИАПФ блокируют прессорные механизмы и активируют депрессорые механизмы регуляции АД.
Как известно, первая реакция в каскаде образования ангиотензина II— превращение ангиотензиногена в ангиотензинIпри участии протеолитического фермента ренина (рис. 11).
Ренин был открыт в 1898 г. шведскими учеными. Студент-медик П. Бергман по заданию профессора Р. Тигерштедта изучал эффекты экстракта почек кролика. При введении этого экстракта другому кролику через 15 мин значительно повысилось АД. Спустя 30 лет П. Голдблатт установил, что действующим веществом экстракта почек является ренин.
Ренин представляет собой одноцепочечную аспартиловую протеазу с молекулярной массой 40 кДа и высокой субстратной специфичностью для ангиотензиногена. Он синтезируется в юкстагломерулярном аппарате почек (ренинпродуцирующий сегмент приносящей артериолы и плотное пятно). Освобождение ренина из гранул происходит в ответ на снижение АД в приносящих артериолах, стимуляцию β-адренорецепторов и уменьшение содержания ионов натрия и хлора в клубочковом фильтрате. Секрецию ренина тормозят ангиотензинIIи натрийуретические пептиды. Специфическими ингибиторами ренина являются новые лекарственные средства — занкирен, ремикирен, ципрокирен, эналкирен, обладающие высокой гипотензивной активностью. Колебания АД в течение суток (ночное снижение и повышение в утренние часы) совпадают с динамикой активности ренина в крови.
Ангиотензиноген — гликопротеин (2-глобулин) с молекулярной массой 60 кДа, состоящий из 14 аминокислотныхостатков.Образуетсяв печени.Под влиянием ренина от ангиотензиногена отщепляется декапептид ангиотензинI.
Ангиотензинпревращающий фермент (АПФ, дипептидилкарбоксипептидаза; молекулярная масса 140 — 170 кДа) является трансмембранной эндопептидазой эндотелия сосудов и секретируется этими клетками в растворимой форме в кровь и ткани.
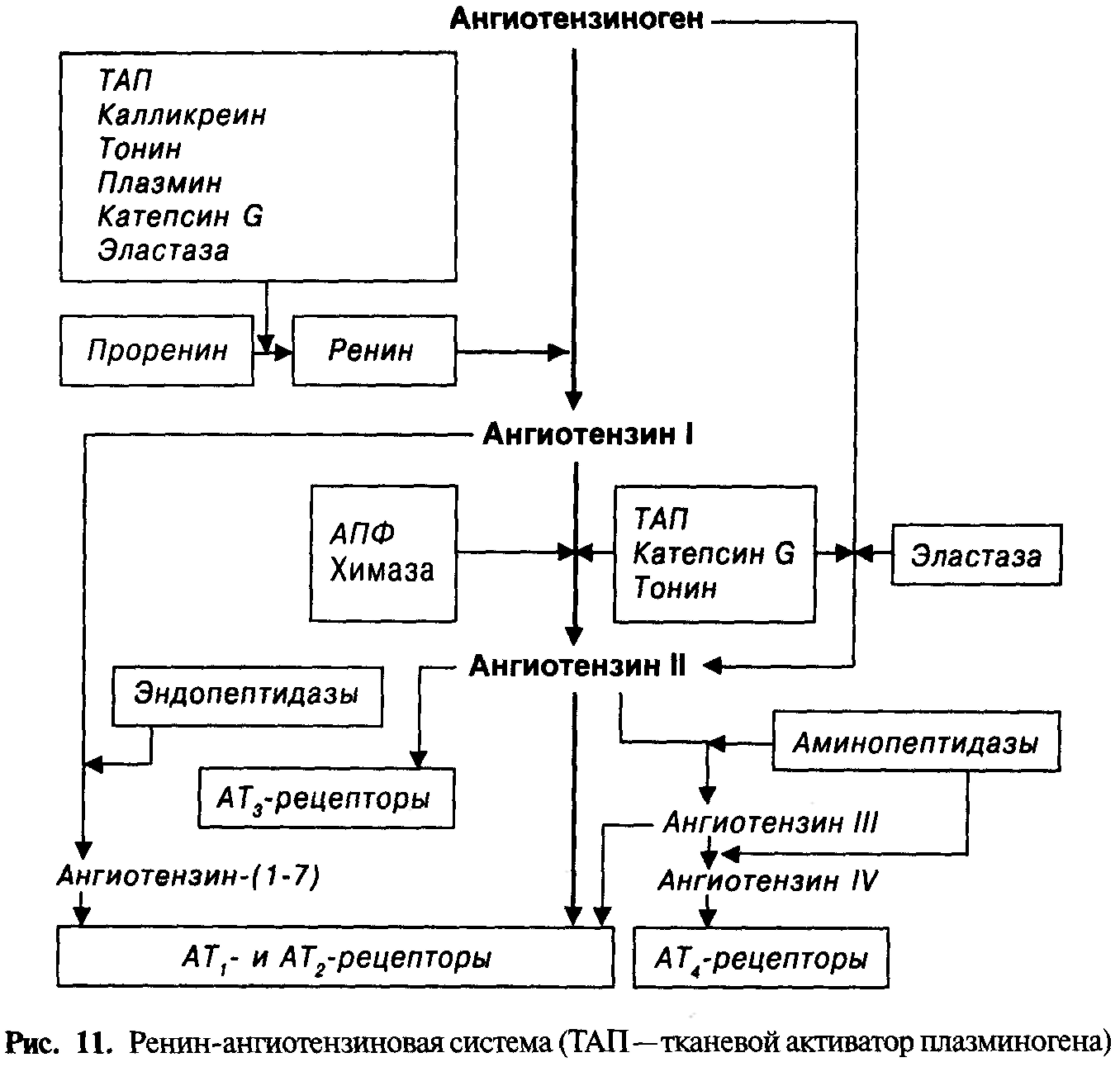
АПФ катализирует ряд биохимических реакций:
образование октапептида ангаотензина II из ангиотензина I (отщепляет от последнего карбоксильный дипептид);
инактивацию брадикинина (АПФ, участвующий в этой реакции, получил название кининаза II);
инактивацию энкефалинов, β-эндорфина, субстанции Р, АКТГ, рилизинг-фактора лютеинизирующего гормона, β-цепи инсулина.
Ангиотензин IIимеет период полуэлиминации 12мин. При участии аминопептидазон последовательно трансформируется в ангиотензинIIIи ангиотензинIV. Эти вещества подобно ангиотензинуIIвызывают спазм сосудов и стимулируют секрецию альдостерона. В головном мозге пролиловая и нейтральная эндопептидазы преобразуют ангиотензиныIиIIв ангиотензин- (1 — 7).
В регуляции функций участвуют плазменная (циркулирующая) и тканевая (локальная) РАС. Только 10% ангиотензина IIобразуется в плазме крови, 90% имеет тканевое происхождение или поступает в ткани в результате захвата из крови. Плазменная РАС способна к моментальной активации и оказывает кратковременное воздействие на организм. Она играет роль «скорой помощи» при кровотечении, падении АД, остром инфаркте миокарда. Тканевая РАС находится в легких, сердце, почках, головном мозге и надпочечниках (из этих органов выделены ангиотензиноген, ренин, АПФ, ангиотензиныIиII). Активность тканевой РАС нарастает постепенно, что приводит к длительным и часто необратимым изменениям функции и структуры органов.
РАС головного мозга регулирует мозговое и периферическое кровообращение, психические функции, питьевой и пищевой инстинкты.
Ангиотензин II оказывает действие на специфические АТ-рецепторы. АТ1-рецепторы (АТ1А, АТ1В) локализованы в сердечно-сосудистой системе и органах, регулирующих ее деятельность, — сердце, артериях, почках, надпочечниках, гипофизе, нервной системе. АТ1-рецепторы, активируя посредством G-белков фосфолипазу С мембран, участвуют в образовании вторичных мессенджеров — диацилглицерола и инозитолтрифосфата. Диацилглицерол повышает активность протеинкиназы С, инозитолтрифосфат стимулирует освобождение ионов кальция из внутриклеточных депо. Кроме того АТ1-рецепторы активируют фосфолипазу А2, увеличивают проницаемость кальциевых каналов, ингибируют аденилатциклазу. Эффекты стимуляции АТ1-рецепторов представлены в табл. 70.
АТ2-рецепторы расширяют сосуды, улучшают почечный кровоток и фильтрацию, оказывают натрийуретическое действие, тормозят пролиферацию и миграцию эндотелия, гладких мышц и мезангиальных клеток, снижают гипертрофию кардиомиоцитов, образование межклеточного матрикса, ингибируют коллагеназу. У здоровых взрослых людей соотношениеАТ1/АТ2-рецепторов составляет 1:2. В клетках плодаАТ2-рецепторов значительно больше, чем в клетках взрослых людей. Возможно,АТ2-рецепторы необходимы для роста и дифференцировки клеток в периоде эмбрионального развития.АТ2-рецепторы участвуют в апоптозе (запрограммированная гибель клеток). Их активность возрастает в поврежденных тканях, например, в зонах ишемии миокарда. При блокадеАТ1-рецепторов происходит активацияАТ2-рецепторов, что может быть полезным при лечении артериальной гипертензии.
АТ3-рецепторы локализованы в нейронах головного мозга, функция их неизвестна.АТ4-рецепторы, избирательно взаимодействующие с ангиотензиномIV, располагаются в сердце, почках и головном мозге. В почках они регулируют кровоток и функции канальцев, в головном мозге участвуют в познавательной деятельности.
Таблица 70. Эффекты антотензина II, возникающие при возбуждении АТ1-pe-цепторов
|
Органы |
Эффекты ангиотензина II |
|
Сердце | |
|
Миокард |
Повышение сократимости Гипертрофия, фиброз |
|
Коронарные артерии |
Сужение |
|
Периферические сосуды |
Сужение с ростом АД Повышение чувствительности барорецепторов Гиперплазия и гипертрофия гладких мышц |
|
Надпочечники | |
|
Корковый слой |
Секреция альдостерона с повышением реабсорбции Na+и секреции К+в дистальных извитых канальцах и собирательных трубочках почек Секреция гидрокортизона |
|
Мозговой слой |
Секреция катехоламинов |
|
Почки | |
|
Почечная артерия |
Сужение с ухудшением почечного кровотока и фильтрации |
|
Клубочки |
Сужение приносящей и в большей степени выносящей артериол, клубочковая гипертензия, повышение проницаемости базальной мембраны для белков, пролиферация мезангиальных клеток и образование в них свободных радикалов кислорода, цитокинов и факторов роста для компонентов мезангиального матрикса (фибронектин, коллаген IVтипа) |
|
Дистальные канальцы |
Реабсорбция Na+ |
|
Юкстагломерулярный аппарат |
Торможение секреции ренина |
|
Гипофиз |
Секреция вазопрессина (антидиуретический гормон) с повышением реабсорбции воды в собирательных трубочках и сужением сосудов |
|
Гипоталамус |
Возбуждение центра жажды с повышением потребления жидкости |
|
Продолговатый мозг |
Возбуждение сосудодвигательного центра |
|
Периферические симпатические окончания |
Секреция норадреналина |
Нежелательные эффекты плазменной РАС следующие:
сужение артерий и вен (повышение АД, преднагрузки и постнагрузки на сердце);
учащение сердечных сокращений, аритмия;
ухудшение коронарного кровотока;
задержка в организме ионов натрия и воды, гипокалиемия.
Гиперактивность тканевой РАС сопровождается расстройством функции и структуры сердечно-сосудистой системы и почек, возникают следующие нарушения:
гипертрофия мышечных волокон сердца (в результате активации протоонкогенов, воздействия катехоламинов, ионов кальция и эндотелина-1);
пролиферация фибробластов и синтез коллагена в миокарде (повышается синтез фактора роста фибробластов);
иперплазия и гипертрофия гладких мышц сосудов (прекапиллярные сфинктеры);
клубочковая гипертензия и гиперфильтрация с последующей гибелью клубочков, пролиферация мезангиальных клеток;
прогрессирование атеросклероза (усиливаются окислительный стресс, местные воспалительные реакции, рост и миграция гладкомышечных клеток в интиму сосудов, происходят инфильтрация интимы моноцитами/макрофагами, аккумуляция в них модифицированных ангиотензином II липопротеинов низкой плотности, увеличивается нестабильность атеросклеротических бляшек).
Первым ИАПФ, использованным в клинике (с 1971 г.), был тепротид — полипептид, выделенный из яда бразильской змеи жарараки. Тепротид проявил высокую терапевтическую эффективность при артериальной гипертензии, но был пригоден только для введения в вену, действовал кратковременно и вызывал многочисленные побочные эффекты.
В 1975 г. М. Ondetti, В. Rubin и D.W. Cushman в лаборатории фирмы Squibb создали КАПТОПРИЛ — синтетический ИАПФ для приема внутрь. С 1991 г. каптоприл производится в России под названием капотен. Первое сообщение о препарате второй генерации, получившем название ЭНАЛАПРИЛ, было опубликовано в журнале «.Nature» в 1980 г. сотрудниками фирмы Merck Sharp & Dohme. Выпускают комбинированные препараты КАПОЗИД (каптоприл + гидрохлортиазид), КО-РЕНИТЕК (эналаприл + гидрохлортиазид), НОЛИПРЕЛ (периндоприл + индапамид) и др.
В настоящее время в медицинской практике используют около 20 ИАПФ (табл. 71).
ИАПФ, блокируя продукцию ангиотензина II, уменьшают секрецию норадреналина, адреналина, вазопрессина (антидиуретический гормон) и альдостерона; как ингибиторы кининазы II задерживают инактивацию брадикинина. Они также препятствуют протеолизу предсердного натрийуретического пептида, снижают образование фактора некроза опухоли-.
Таким образом, сосудорасширяющее действие ИАПФ обусловлено снижением в организме количества ангиотензина II, норадреналина, адреналина, вазопрессина, альдостерона и накоплением брадикинина и натрийуретического пептида. Брадикинин, активируя В2-рецепторы эндотелия, повышает освобождение простагландина Е2, простациклина, окиси азота (NО), эндотелиального гиперполяризующего фактора.
Фармакологические эффекты ИАПФ развиваются как результат торможения плазменной и тканевой РАС22.
