
- •Кафедра биохимии
- •Классификация мышечных волокон
- •Особенности обмена веществ в мышечной ткани
- •Креатинфосфатный челнок
- •Характеристика быстрых и медленных скелетных мышц
- •Миофибрилла
- •Состав миофибриллы
- •Строение миофибриллы
- •Механизмы мышечного сокращения
- •Регуляция сокращения и расслабления мышц
- •Биохимические показатели крови и мочи отражающие функциональное состояние мышечной ткани
- •Тропонин т
- •Основные нарушения обмена веществ различных видов мышечной ткани, причины, последствия, биохимическая диагностика
- •Инфаркт миокарда
- •Факторы риска инфаркта миокарда
Биохимические показатели крови и мочи отражающие функциональное состояние мышечной ткани
Аминотрансферазы
Наиболее часто активность АТ исследуют с целью дифференциальной диагностики патологии печени и миокарда. При инфаркте миокардаактивность АСТ в 95% случаев повышена.
Лактатдегидрогеназа
При инфаркте миокарда в плазме крови повышена активность ЛДГ1, ЛДГ2.
У больных прогрессирующей мышечной дистрофией (миопатией) в мышечной ткани происходит заметное снижение активности ЛДГ4и ЛДГ5и повышение активности ЛДГ1, ЛДГ2и ЛДГ3.
Креатинкиназа
КФК-ММ повышается в крови при патологии скелетных мышц, КФК-МВ – при инфаркте миокарда.
Альдолаза
Активность энзима сыворотки (плазмы) крови значительно увеличивается при глубоких дистрофических процессах в мышечной системе. Резкое повышение активности альдоазы наблюдается у больных с прогрессирующей мышечной дистрофией.
Гиперальдолаземия отмечается у больных с инфарктом миокарда.
Тропонин т
тропонин Т является высокоспецифичным лабораторным биохимическим маркером инфаркта миокарда в острой и подострой его фазе.
Миоглобин
Миоглобин является маркером деструктивных изменений в мышечной системе.
При инфаркте миокарда концентрация миоглобина в сыворотке крови возрастает быстро — уже через 4—б ч от начала заболевания. Нормализация данного показателя происходит в среднем через 22 ч с момента возникновения инфаркта миокарда.
Основные причины, обусловливающие миоглобинемию и миогаобинурию, могут быть разделены на следующие основные группы: физические; химические; инфекционные (воспалительные); токсические (миоренальный синдром — раздавливание гипертрофированных мышц, отравление некоторыми сортами рыбы, алкогольная интоксикация — алкоголь чрезвычайно токсичен для мышц, вызывает их некроз); воздействие лекарств (снотворных, терпингидрата, нашатырного спирта); сосудистые — эмболии, тромбозы артерий, разрывы (перевязка); ишемические; электрическая травма, приводящая к судорогам; термические ожоги.
С-реактивный белок(СРБ)
Положительные результаты серологического определения СРБ обычно наблюдаются при бактериальной инфекции, инфаркте миокарда, злокачественных опухолях, лимфогранулематозе, нефрите, а также при отдельных формах коллагенозов: ревматизме, красной волчанке, инфекционном неспецифическом полиартрите.
Креатин
Креатинурия появляется при патологических состояниях мышечной ткани: миопатии или прогрессирующей мышечной дистрофии.
При повреждениях мышц снижено содержание калия в крови, повышено содержание аминокислот в моче.
Основные нарушения обмена веществ различных видов мышечной ткани, причины, последствия, биохимическая диагностика
Миопатии и миодистрофии
Миопатии(греч. mys, myos мышца + pathos страдание, болезнь) - нервно-мышечные заболевания, характеризующиеся прогрессирующим развитием первичного дистрофического или вторичного (денервационного) атрофического процесса в скелетной мускулатуре, сопровождающиеся мышечной слабостью и двигательными нарушениями.
К миопатиям относят как наследственные нервно-мышечные заболевания, так и разнообразные нервно-мышечные синдромы при ряде соматических и неврологических болезней.
Наследственные миопатии, в основе которых лежат первичные обменные нарушения и расстройства микроциркуляции в мышечной ткани, приводящие к дистрофии мышечных волокон с замещением их соединительной и жировой тканью, относят к группе прогрессирующих мышечных дистрофий(см. Дистрофии мышечные прогрессирующие),а наследственные миопатии, обусловленные нарушением иннервации мышц вследствие поражения сегментарных мотонейронов спинного мозга или периферических нервных волокон, - к группе спинальных илиневральных амиотрофий.
В основе развития миопатии лежат нарушение обмена в мышечных клетках, изменение синтеза нуклеиновых кислот, значительное преобладание ускоренного распада белков мышц над измененным их синтезом. Мышцы при миопатии истончены, часть волокон замещена жировой тканью; при электронной микроскопии обнаруживают изменение структуры мембран мышечных клеток. Основные признаки миопатии - нарастающая мышечная слабость, симметричная атрофия мышц, снижение сухожильных рефлексов, в поздних стадиях - деформация костей и суставов. Постоянно выражены вегетативнотрофические расстройства.
Ишемическая болезнь сердца
ИБС патологическое состояние, характеризующееся абсолютным или относительным нарушением кровоснабжения миокарда вследствие поражения коронарных артерий сердца.
Причиныпоражения коронарных артерий сердца обусловлены наследственными (дефекты сосудов) и воспалительными (васкулиты, большие коллагенозы, инфекционные поражения, например сифилис), так и обменными (атеросклероз, 97-98%) заболеваниями.
Также причиной ишемии может быть нарушение нервной регуляции артерий, приводящее к их спазму.
Классификация. Выделяют пять форм ишемической болезни сердца: 1) первичная остановка кровообращения; 2) стенокардия; 3) инфаркт миокарда; 4) сердечная недостаточность; 5) аритмии.
Основное внимание привлечено к инфаркту миокарда- самой тяжелой и распространенной острой форме ишемической болезни сердца.
Биохимические изменения при ИБС
гипоксия
снижение количества гликогена и глюкозы
накопление лактата, неокисленных жирных кислот
ацидоз
активация СРО и накопление токсичных продуктов ПОЛ
снижение активности ферментов аэробного дыхания, синтеза клеточных структур, транспорта субстратов обмена веществ и катионов.
перестройка изоферментного спектра
изменение ионного равновесия
воспалительная реакция
уменьшение электрической активности
нарушение «энергоснабжения»
повреждение клеток, субклеточных частиц, мембран
снижением сократительной функции сердца
нарушением кровообращения в органах и тканях
В условиях гипоксии миокард поглощает ТГ из липопротеинов, при этом они не используются, а накапливаются, приводя к ожирению миокарда. В условиях ИБС назначают безжировую диету, повышают уровень ЛПВП в крови.
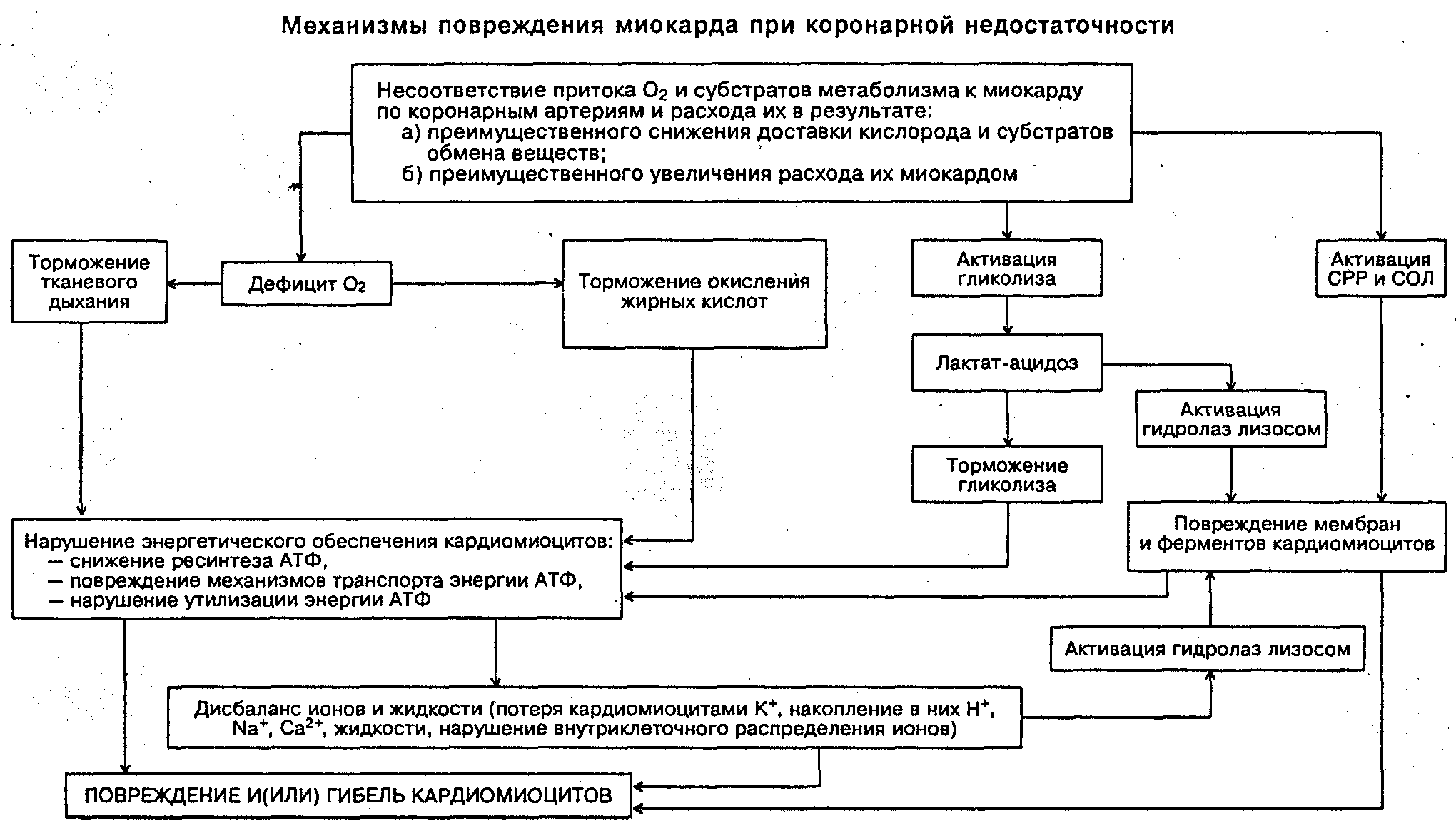
Дефицит энергии в клетках миокарда обусловливает также развитие аритмий, что является одной из наиболее частых причин внезапной смерти пациентов с КН.
Повреждение мембранного аппарата и ферментных систем кардиомиоцитов
Основные свойства миокарда (автоматизм, возбудимость, проводимость, сократимость), а также их регуляция в значительной мере зависят от состояния мембран и ферментов клеток миокарда. В условиях КН их повреждение является следствием действия ряда общих механизмов. К числу наиболее значимых среди них относятся избыточная интенсификация свободнорадикальных реакций и перекисного окисления липидов; чрезмерная активация лизосомальных, свободных и мембранно-связанных гидролаз (протеаз, липаз, фосфолипаз и др.); внедрение продуктов указанных процессов (жирных кислот, гидроперекисей липидов, других амфифильных соединений) в мембраны кардиомиоцитов; торможение «субстрат- и энергозависимых» процессов ресинтеза поврежденных липидных и белковых компонентов мембран и синтеза их заново; нарушение конформации молекул белков (структурных, ферментов) и липопротеидов; растяжение и микроразрывы мембран в результате набухания клеток миокарда и их органелл. Важно заметить, что все указанные механизмы прямо или опосредованно обусловливают повреждение, изменение конформации и(или) кинетических свойств ферментов, многие из которых связаны с мембранами кардиомиоцитов (подробнее анализ реализации названных выше механизмов см. в разделе «Повреждение клетки»).
Дисбаланс ионов и жидкости
КН характеризуется существенными нарушениями общего содержания ионов и жидкости в ткани миокарда, их внутри- и внеклеточного соотношения, а также интрацеллюлярного распределения.
Как правило, дисиония развивается «вслед» или одновременно с расстройствами реакций энергообеспечения кардиоцитов, а также — повреждением их мембран и ферментов. Дисбаланс ионов в свою очередь лежит в основе нарушения таких фундаментальных процессов, протекающих в клетках миокарда, как возбуждение, электромеханическое сопряжение, сокращение и расслабление, ритмогенез, расстройство которых характерно для КН. В основе указанных изменений лежит выход ионов калия из ишемизированных кардиомиоцитов, накопление в них натрия, кальция, а также жидкости. В отдаленных от зоны ишемии участках сердца концентрация указанных и других ионов, а также жидкости тоже меняется, однако степень этих изменений значительно меньшая.
В качестве ведущих причин К+— Na+дисбаланса при КН называют дефицит АТФ, повышение проницаемости сарколеммы и торможение активности К+Ма2+-зависимой АТФазы, что создает возможность пассивного выхода К+ из клетки и входа в нееNa+по градиенту концентрации. КН сопровождается также высвобождением больших количеств К+и Са2+из митохондрий. Непосредственными факторами, обусловливающими этот процесс, могут быть снижение мембранного потенциала деэнергизированных митохондрий и увеличение проницаемости их мембраны под влиянием ацидоза, продуктов СПОЛ и фосфолипаз, активируемых Са2+. Значительное количество К+высвобождается и при гликолитиЧеском распаде молекул гликогена (синтез которого идет с захватом ионов калия).
Потеря К+клетками миокарда при КН сопровождается повышением содержания его в крови. Гиперкалиемия является характерным признаком КН, особенно завершающейся развитием инфаркта миокарда. В эксперименте на собаках уже в первые пять минут ишемии содержание калия в крови, оттекающей как от ишемизированной, так и отдаленной зон, существенно увеличивается.
Нарушение энергообеспечения кардиомиоцитов, повреждение их мембран и ферментов, дисбаланс ионов и жидкости в совокупности обусловливают расстройство механизма регуляции объема клеток миокарда при КН. Последнее является результатом повышения проницаемости клеточных мембран для ионов и органических гидрофильных молекул (белка, углеводов); гиперосмии кардиомиоцитов в результате накопления в них ионов (натрия, кальция) и мелкодисперсных соединений (альбуминов, пирувата, лактата); гипергидратации и набухания клеток; снижение механической прочности биологических мембран.
Расстройство механизмов регуляции функции сердца
Изменение функции сердца в целом, а также характер и степень повреждения отдельных его клеток при КН являются не только результатом прямой альтерации их патогенными факторами ишемии. В значительной мере это обусловлено и расстройством механизмов регуляции сердечной деятельности, которое развивается преимущественно на одном (реже) или нескольких (чаще) уровнях:
на уровне взаимодействия биологически активных веществ (гормонов, нейромедиаторов) с рецепторами. Изменение чувствительности, числа и(или) конформации молекул рецепторов, их липидного окружения в биологических мембранах может существенно модифицировать характер клеточного ответа на регулирующий стимул; на уровне клеточных «посредников» (мессенджеров) регуляторных влияний, в частности циклических нуклеотидов (цАМФ, цГМФ), образующихся в ответ на действие «первых посредников» — нейромедиаторов и гормонов;
на уровне метаболических клеточных реакций, регулируемых циклическими нуклеотидами и другими внутриклеточными «медиаторами».
КН характеризуется фазными изменениями активности механизмов регуляции, в том числе — симпатической и парасимпатической. На начальном этапе ишемии миокарда, как правило (хотя и не всегда), наблюдается значительная активация симпатоадреналовой системы. Это сопровождается увеличением содержания в миокарде норадреналина и особенно адреналина. Вследствие этого развивается тахикардия, увеличивается сердечный выброс, как правило, снижающийся сразу после начала эпизода КН. Параллельно с этим могут усиливаться и парасимпатические влияния (о чем свидетельствует увеличение содержания в миокарде ацетилхолина), но степень их усиления меньшая, чем симпатических. Однако, учитывая, что и адрено- и холинореактивные свойства миокарда на начальном этапе КН изменяются примерно в одинаковой мере, эффекты симпатических воздействий на сердце преобладают. На более поздних сроках КН нередко регистрируется уменьшение содержания в миокарде норадреналина и сохранение повышенного уровня ацетилхолина. Одновременно отмечается развитие брадикардии, снижение величины сердечного выброса, скорости сокращения и расслабления миокарда.
В условиях КН (особенно при длительном ее течении) нередко развивается феномен гормононейромедиаторной диссоциации катехоламинов. Характерное для этого феномена значительное увеличение в ишемизированном миокарде концентрации адреналина при одновременном существенном уменьшении в нем содержания норадреналина играет в основном патогенную роль (механизмы кардиотоксического действия избытка адреналина см. выше) . КН сопровождается и другими изменениями нейро-гуморальной регуляции функции сердца, но они весьма «индивидуализированы» (в зависимости от длительности эпизода КН, числа их в анамнезе, возраста пациента, выраженности миокардиальной недостаточности и т.д.) и подробно рассматриваются в клинических руководствах.
