
Пять субъединиц холинорецептора, в последовательности α-β-α-γ-δ образуют канал, проницаемый для ионов натрия, калия, кальция и даже некоторых органических катионов. Холинорецептор локализован на постсинаптической мембране клетки и при связывании ацетилхолина изменяет свою конформацию таким образом, что через устье, сформированное канальными субъединицами, внутрь клетки устремляются ионы Na+. Происходит деполяризация мембраны, что приводит к выходу К+ из клетки. Ток ионов К+ возвращает потенциал мембраны к исходной величине. В процессе этой перезарядки мембраны, осуществляемой потенциалом действия, через этот же канал внутрь клетки могут входить ионы Са2+. Следовательно, этот канал нельзя назвать избирательным в отношении катионов. В то же время это быстродействующая регуляторная система – потенциал действия, вызываемый ацетилхолином, возникает и затухает в тканях мозга за 1–2 мсек, благодаря чему синапс может проводить от аксона на иннервируемую клетку до 500 имп/с. В нервно-мышечном синапсе потенциал действия длится несколько дольше (80–120 мсек).
Такое быстрое развитие и тушение сигнала возможны благодаря быстроте связывания ацетилхолина с рецептором, а также высоким скоростям его диссоциации от рецептора и разрушения ацетилхолинэстеразой. Разумеется, не менее важен и механизм открывания канала за счет конформационных переходов, происходящих в наносекундном интервале. Бесперебойное функционирование холинергического синапса требует большого запаса ацетилхолина, который синтезируется впрок и накапливается в везикулах пресинаптической мембраны. Кроме того, в клетках должны существовать достаточно высокие градиенты ионов Na+ и К+ по обе стороны плазматической мембраны, которые создаются и поддерживаются
Na/K-нacocoм.
Быстродействие ацетилхолина (как и других нейромедиаторов) определяется также особенностями того морфологического образования, которое существует между аксоном и иннервируемой клеткой и которое называется синапсом. Благодаря тому, что расстояние между пре- и постсинаптической мембранами составляет всего 300–500 Å, а холинорецепторы сконцентрированы в виде
211
кластеров в области участков секреции ацетилхолина, в момент разрыва секреторного пузырька нейромедиатор быстро оказывается в месте его рецепции. Кроме того, при раздражении аксона происходит выброс столь большого количества ацетилхолина, что молекулы этого нейромедиатора мгновенно насыщают все рецепторы и вызывают массированный вход Na+ в клетку (развитие потенциала действия).
Холинергические рецепторы никотинового типа имеют довольно низкое сродство к ацетилхолину – полумаксимальное насыщение рецепторов наблюдается в присутствии 10-4 М ацетилхолина, поэтому как только ацетилхолинэстераза (локализованная в областях, соседствующих с молекулами холинорецентора) начинает гидролизовать ацетилхолин и понижать его уровень в синапсе, происходят диссоциация этого нейромедиатора от рецептора и возвращение канала в закрытое состояние.
Сродство рецептора к нейромедиатору или гормону определяется соотношением скоростей диссоциации и ассоциации гормонрецепторного комплекса. При константе диссоциации 10-4–10-3 М скорость диссоциации ацетилхолина от рецептора составляет доли миллисекунды, что, очень важно для быстрого восстановления синаптической передачи.
По «канальному» механизму работают и некоторые другие рецепторы, имеющие близкую молекулярную массу и, как правило, состоящие из нескольких субъединиц. В зависимости от селективности ионов, пропускаемых каналом, эти рецепторы генерируют деполяризацию или гиперполяризацию мембраны. Вероятно, что «ворота» каналов всех этих рецепторов открываются по единому механизму, так как у некоторых субъединиц различных рецепторов найдены гомологичные участки.
Совершенно иную, отличающуюся от холинергического рецептора никотинового типа, структуру и другой механизм функционирования имеет так называемый мускариновый холинергический рецептор (мХР) (рис. 77), который локализован преимущественно вне синапса. На этот рецептор не действует никотин, но он легко активируется мускарином (алкалоидом из ядовитых грибов), а также, разумеется, ацетилхо-
212
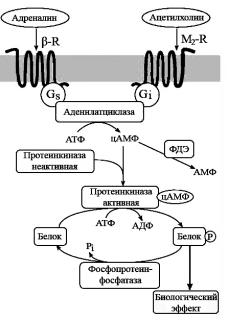
лином, к которому имеет сродство порядка 106 М.
Существуют, |
по |
крайней |
|
||
мере, четыре типа мускари- |
|
||||
новых рецепторов, |
причем |
|
|||
все они близки по структу- |
|
||||
ре (их полипептидная цепь |
|
||||
семь раз пронизывает мем- |
|
||||
брану) и сопряжены с G- |
|
||||
белками, но передают сиг- |
|
||||
нал разным системам внут- |
|
||||
риклеточной |
сигнализации. |
|
|||
Так, например, мХР могут |
|
||||
стимулировать фосфолипа- |
|
||||
зу С, которая гидролизует |
|
||||
фосфоинозитиды, и ингиби- |
|
||||
ровать аденилатциклазу, а |
|
||||
также активировать К+-ка- |
|
||||
нал. К этому классу рецеп- |
|
||||
торов относятся и адренер- |
|
||||
гические рецепторы, а так- |
Рис. 77. Система проведения сигнала |
||||
же опиатные рецепторы ко- |
|||||
ры полушарий мозга. |
путем образования вторичных |
||||
посредников и последующей |
|||||
Ответ этих рецепторов рас- |
|||||
химической модификации белков |
|||||
тянут во времени. Эффекты |
|||||
мускариновых |
холинорецеп- |
β-R – бета-адренергический рецептор, |
|||
торов развиваются спустя 1–2 |
M2-R – холинергический рецептор |
||||
мин после |
взаимодействия с |
мускаринового типа. |
|||
рецептором |
и |
гасятся за де- |
|
||
сятки мин. Столь разительное отличие в скоростях проведения ацетилхолинового сигнала между
никотиновым и мускариновым рецепторами объясняется, прежде всего, разной кинетикой связывания лиганда с соответствующими рецепторами (диссоциация ацетилхолина от мускаринового рецептора происходит весьма медленно), сложным каскадом проведения сигнала в случае мускариновой регуляторной системы (необходимо
213
последовательное взаимодействие рецептора с соответствующим G-белком, затем G-белка с определенным ферментом или каналом), а также сравнительно медленно протекающими реакциями синтеза вторичных посредников, фосфорилирования и дефосфорилирования белков.
8.6. МЕХАНОЧУВСТВИТЕЛЬНЫЕ ИОННЫЕ КАНАЛЫ
Функционирование ионных каналов может зависеть от локального растяжения мембраны и изменения градиента ее кривизны. Канальные структуры, которые изменяют свою активность в зависимости от натяжения мембраны, называются механочувствительными, хотя кроме них описаны каналы, увеличивающие активность и при обратном изменении натяжения. Впервые Ca2+-прово- дящие механочувствительные каналы были показаны на эндотелиальных клетках животных, где они выполняют роль сенсора кровяного давления. Каналы с аналогичными свойствами были обнаружены в бактериях, грибах и высших растениях.
Функционирование механочувствительных каналов происходит в тесном взаимодействии с цитоскелетом. Чувствительность этих каналов к натяжению возрастает, если сила, приложенная к большому участку мембраны, концентрируется на канале посредством элементов цитоскелета. Связь осуществляется набором белков, известных как анкирины (см. выше).
Выделяют два типа каналов, чувствительных к натяжению мембраны: SA-каналы (stretch-activated), активирующиеся при растяжении мембраны и SI-каналы (stretch-inactivated), которые при растяжении мембраны инактивируются. В зависимости от объекта и типа клетки встречаются механочувствительные каналы, селективные к К+, Cl-, а также Са2+ и другим двухвалентным катионам, проницаемые для одно- и двухвалентных катионов, и неселективные (или слабоселективные) для анионов и катионов. Наиболее часто в качестве ингибитора механочувствительных каналов используют гадолиний (Gd3+), который обратимо блокирует работу каналов в низких концентрациях (10 мкМ), действуя с наружной стороны мембраны.
214
В отличие от рецептор- и потенциал-зависимых ионных каналов, механочувствительные каналы имеют гораздо меньшую плотность распределения в мембранах (она составляет в среднем 1/мкм2). Тем не менее, при мембранном потенциале -60 мВ кальциевый ток через SA-канал может достигать величин 0,1 нА. Наиболее важное значение механочувствительные ионные каналы имеют в ростовых движениях различного типа и в регуляции работы устьичного аппарата. Механическое взаимодействие клеток в ходе их развития приводит к натяжению (или сдвигам) клеточных мембран, активации механочувствительных каналов и появлению векторных ионных потоков, которые уже непосредственно осуществляют регуляцию процессов роста и дифференцировки.
У млекопитающих (в том числе, у человека) функционирование механорецепторов выстилки слизистой желудка обеспечивают ощущение сытости. При генетическом нарушении этих каналов возникают заболевания, приводящие к булимии.
8.7. РЕЦЕПТОРЫ, ОТВЕЧАЮЩИЕ ЗА ПЕРЕНОС МАКРОМОЛЕКУЛ В КЛЕТКУ
Информация может передаваться в клетку не только с помощью ионных каналов или цепи реакций, регулируемых G-белка- ми. На поверхности некоторых клеток имеются рецепторы, способные распознавать макромолекулы и «организовывать» их перенос через мембрану внутрь клетки. К таким клеткам относятся макрофаги, осуществляющие один из первых актов активации иммунной системы. В этом случае участок плазматической мембраны обволакивает захватываемый материал, который в итоге попадает внутрь клетки. В процессе этого акта он заключается в мембранный пузырек-везикулу, стенки которой образуются из участков плазматической мембраны. Этот процесс на-
зывается эндоцитозом.
Существуют три вида эндоцитоза: 1) фагоцитоз – захват клеткой больших структурных компонентов, вплоть до целых клеток, например клеток бактерий одноклеточными организмами
215

и макрофагами; 2) пиноцитоз – неспецифический захват клетками внеклеточной жидкости и ее содержимого; 3) специфический захват молекул, опосредованный специальными рецепторами
(рис. 78).
В этом разделе мы рассмотрим только специфический эндоцитоз. Впервые эндоцитоз, обусловленный специфическими рецепторами, был обнаружен в середине прошлого века при изучении захвата яйцеклетками белков, которые используются для питания зародыша. Позднее было выяснено, что некоторые белки синтезируются в печени, оттуда переносятся руслом крови к яичникам, там связываются со специфическими рецепторами плазматической мембраны ооцита, а затем происходит «впячивание» плазматической мембраны, после чего рецепторсбелкомпопадаетвнутрьклетки.
Рис. 78. Схематическое изображение мембранного транспорта между внутриклеточными вакуолями и плазматической мембраной
ЭР – эндоплазматический ретикулум, СГ – секреторная гранула, СВ – секреторная везикула, Л – лизосома, Э1 – периферическая эндосома, Э2 – перинуклеарная эндосома, ОВ – окаймленная везикула, ОЯ – окаймленная ямка, РВ – рециклируюшаяся везикула, ФЛ – фаголизосома, Ф – фагосома, Г – аппарат Гольджи.
216
У млекопитающих по механизму опосредованного специфическими рецепторами эндоцитоза передаются структурные носители иммунитета от материнского организма к плоду. Антитела из кровотока материнского организма связываются с клетками плода, окружающими желточный мешок. На поверхности этих клеток имеются рецепторы, специфически связывающиеся с иммуноглобулинами и переносящие их в кровоток плода.
Клетки иммунной системы также функционируют с помощью эндоцитоза. Макрофаги захватывают антиген, внутри клетки он претерпевает процессинг – расщепление гидролитическими ферментами с вычленением сравнительно небольших фрагментов, несущих отдельные антигенные детерминанты. Заключительный этап этого процесса – экспрессия фрагментов антигена на поверхность макрофага, где они оказываются в комплексе с собственными антигенами гистосовместимости II класса (которые можно рассматривать как своего рода рецепторы). Далее запускается специфическая цепь иммунологических реакций, в которой участвуют лимфоциты различных типов.
В основе пиноцитоза и опосредованного рецепторами поглощения растворенных веществ лежит образование окаймленных ямок
иокаймленных везикул. Термин «окаймленные ямки» относится к морфологии этих структур, выявляемой с помощью электронной микроскопии. Отличительной их особенностью является наличие решетчатой структуры из молекул белка клатрина, который связывается с углублениями на поверхности плазматической мембраны
ивезикулами, образующимися из таких ямок.
На долю окаймленных ямок обычно приходится 1–2% общей площади поверхности плазматической мембраны, и большинство белков плазматической мембраны не обнаруживаются на этих участках. Однако определенные белки концентрируются в области формирования окаймленных ямок (возможно, с помощью специальных механизмов), и концентрация некоторых белков в этих ямках очень высока.
Как показано в модельных экспериментах in vitro, после образования эндоцитозных везикул оболочка из клатрина удаляется специфическим белком в ходе АТФ-зависимой реакции. Везикулы без
217
клатрина становятся частью сложной системы трубочек и везикул, называемых периферическими эндосомами; они локализованы вблизи плазматической мембраны. Конечный пункт эндоцитозного пути находится во вторичных лизосомах, где происходит деградация отдельных растворенных веществ (таких, как ЛНП).
В табл. 12 перечислены некоторые рецепторы плазматической мембраны, участвующие в поглощении специфических лигандов с помощью окаймленных ямок и везикул. В некоторых случаях сродство рецептора к окаймленным ямкам постоянно, в других случаях рецепторы концентрируются в этих структурах только при связывании лиганда (например, рецептор фактора роста эпидермиса). Примерно 70% рецепторов ЛНП сконцентрировано в клатриновых ямках, где они легко подвергаются интернализации. Физиологический смысл этого явления заключается в том что с помощью опосредованного рецепторами эндоцитоза происходит захват клетками ЛНП из кровяного русла. Этот механизм представляет собой основной путь «доставки» холестерина к клеткам.
Таблица 12. Некоторые рецепторы, интернализуемые при эндоцитозе
Группы рецепторов |
Примеры рецепторов |
I. Рецепторвозвращаетсякклеточнойпо- |
Рецепторы маннозы, асиалогликопротеи- |
верхности, лиганд поступает в лизосомы |
на (галактозы), маннозо-6-фосфата, γ- |
|
макроглобулина, ЛНП |
II. Рецептор илиганд поступают в лизо- |
Рецепторы ФРЭ, инсулиновый |
сомы |
|
III. Трансцитоз |
IgA/IgM-рецептор, IgG-рецептор |
IV. Рецептор илиганд возвращаются к |
Трансферриновый рецептор |
одному итому же домену плазматиче- |
|
ской мембраны |
|
Рецепторы ЛНП были открыты на мембранах фибробластов в конце ХХ в. Оказалось, что они специфически связывают ЛНП за счет «узнавания» апо-протеина 5-100 или апопротеина Е. При этом специфичность узнавания так велика, что связывание происходит даже при концентрации ЛНП 10-9М. Свободный холестерин, покидая лизосомы, участвует в формировании мембран, а в специализированных клетках надпочечников и яичников включается в син-
218
тез стероидных гормонов. Рецепторы ЛНП присутствуют практически во всех тканях, наибольшая их плотность наблюдается в клетках печени, надпочечников и яичников – органах, испытывающих наибольшую потребность в холестерине.
ЛНП-рецептор человека – это типичный рецептор группы I, который возвращается к плазматической мембране, в то время как его лиганд, сывороточный ЛНП, попадает в лизосому. По данным об аминокислотной последовательности рецептора он состоит из пяти доменов. Выраженная гомология с другими мембранными рецепторами отсутствует. Рецептор имеет единственный трансмембранный домен и непротяженный цитоплазматический С-концевой домен. Показано, что у лиц с таким генетическим заболеванием, как семейная гиперхолестеролемия, функция ЛНП-рецепторов существенно ослаблена.
219
ПОСЛЕСЛОВИЕ
Завершая эту книгу, мы вполне отдаем себе отчет, как мало сумели рассказать о проблемах, составляющих суть современной биомембранологии – науки о законах организации, функционирования и устойчивого воспроизведения клеточных мембран. Мы сознательно стремились к краткости изложения, чтобы не загромождать книгу избыточным фактическим материалом. Одновременно мы старались продемонстрировать динамический характер этой новой науки, подчеркнуть наличие в ней точек роста и безусловных перспектив.
Вряд ли нам удалось при этом следовать строгой систематике в изложении материала – в этой области клеточной биологии не так много написано учебников, на опыт которых можно было бы опираться. Понимая, что поставленные нами при написании этого учебника задачи частично противоречат друг другу, мы решили отдать предпочтение главному – привлечь внимание читателя к важности знаний в молекулярной биологии клеточных мембран – в современной биологии эта дисциплина обеспечивает залог успеха в нахождении перспективных проблем и успешного их решения.
Петрозаводск, 2005 г.
220
