
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
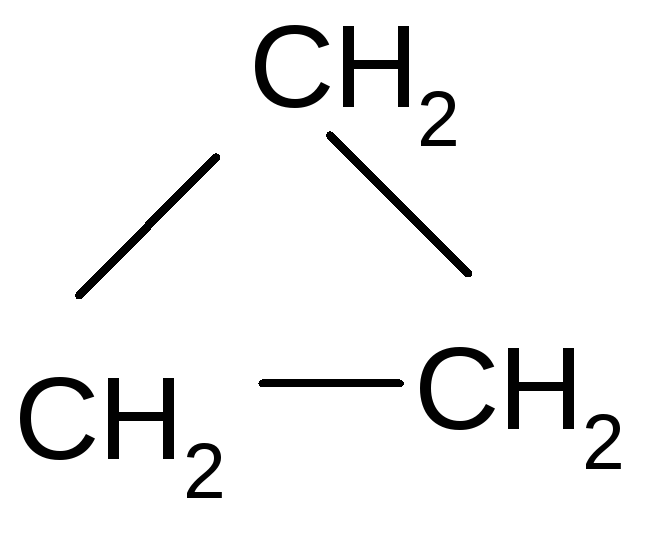
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
Циклоалканы
Это предельные углеводороды циклического строения общей формулы CnH2n
Название Структурная формула Брутто – формула
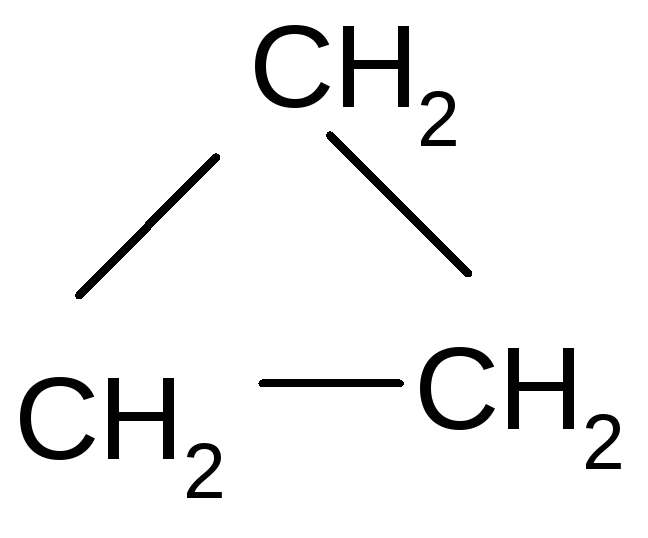
Циклопропан с3н6

Циклобутан С4H8
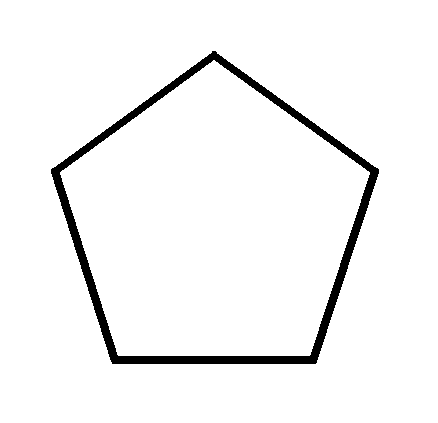
Циклопентан С5Н10
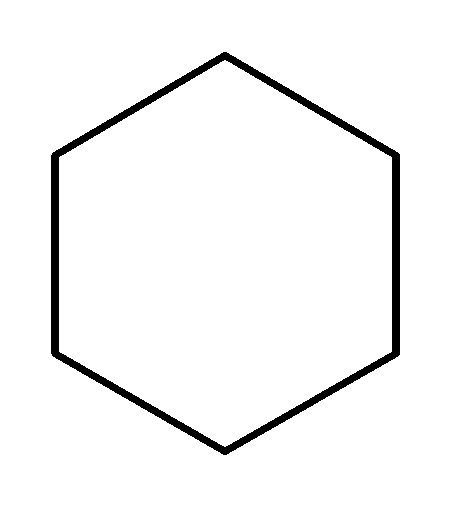
Циклогексан С6Н12
Для циклоалканов, так же как и для алканов, характерна sp3 гибридизация.- Связи должны располагаться под углом109° друг к другу.
При отклонении угла в цикле от 109° возникает угловое напряжение (теория напряжения циклов Байера).
Особенно неустойчив циклопропан, который легко вступает в реакции присоединения с разрывом кольца. Наиболее устойчивы циклогексан и циклопентан. Они вступают в обычные для алканов реакции SR. Циклобутан занимает промежуточное положение. Для него характерны оба направления реакций.
Устойчивость 5- и 6- членных циклов объясняется их неплоским строением.
Циклогексан принимает различные конформации, из которых следует выделить две наиболее устойчивые:

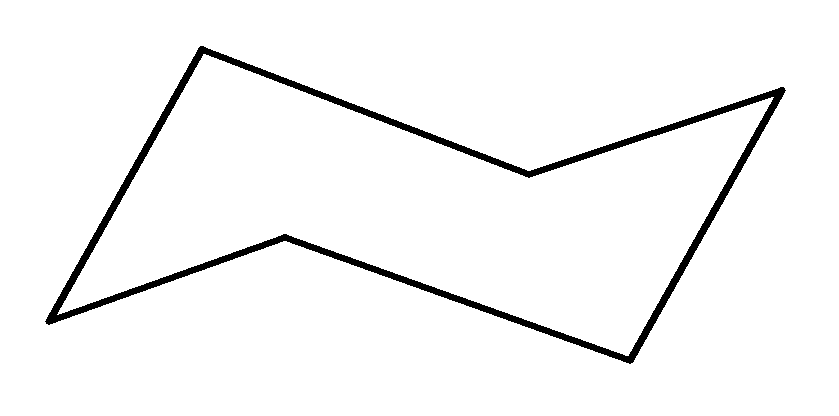
конформация конформация
«ванны» или «лодки» «кресла»
Наиболее выгодной является конформация «кресла», так как все углы между связями составляют 109°, (т.е. отсутствует угловое напряжение). В конформации «кресла» атомы углерода имеют одну аксиальную (а) и одну экваториальную (е) связи. Аксиальная связь параллельна оси молекулы, а экваториальная – направлена в сторону от кольца.
a
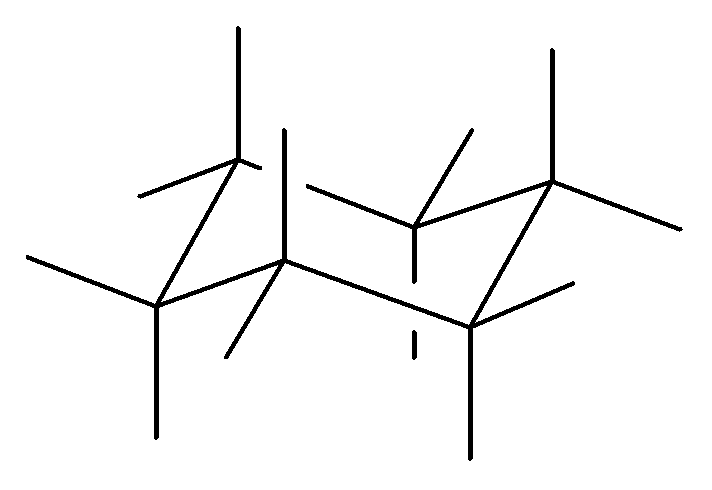
е
Для объемного заместителя наименее выгодно аксиальное положение из-за возникающего сильного 1,3-диаксиального взаимодействия, которое приводит к торсионному напряжению и инверсии циклогексанового кольца:
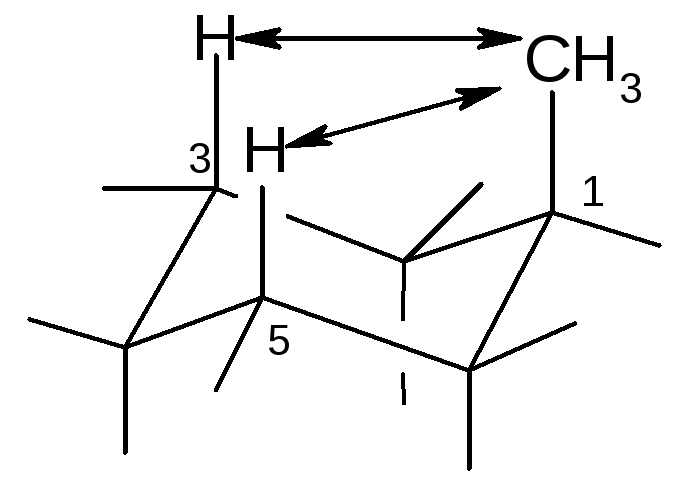

инверсия


Поэтому более энергетически выгодно экваториальное расположение заместителей.
Кроме конформационной изомерии, для циклоалканов характерна геометрическая (цис-транс) изомерия.
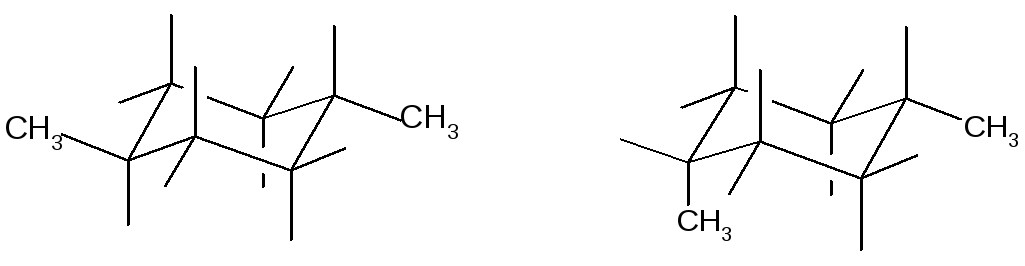
Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
Химические свойства.Химические реакции циклоалканов подобны алканам с открытой цепью, но в зависимости от устойчивости циклов идут в различных направлениях.
Например, галогенирование:
 +Cl2
Cl-CН2–СН2–СН2–Сl
+Cl2
Cl-CН2–СН2–СН2–Сl
1,3–дихлорпропан
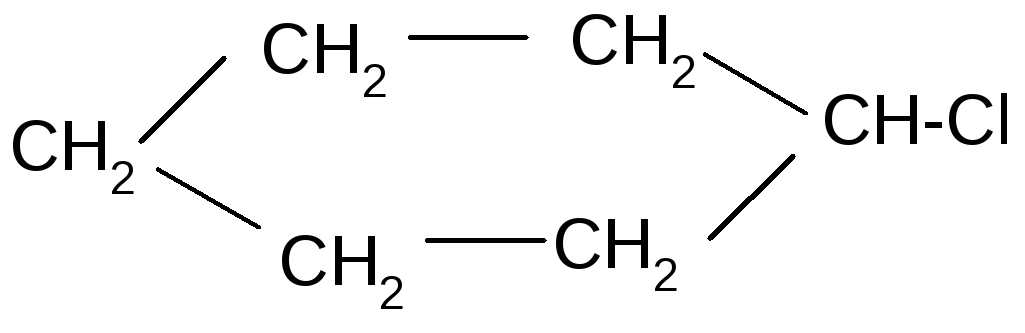
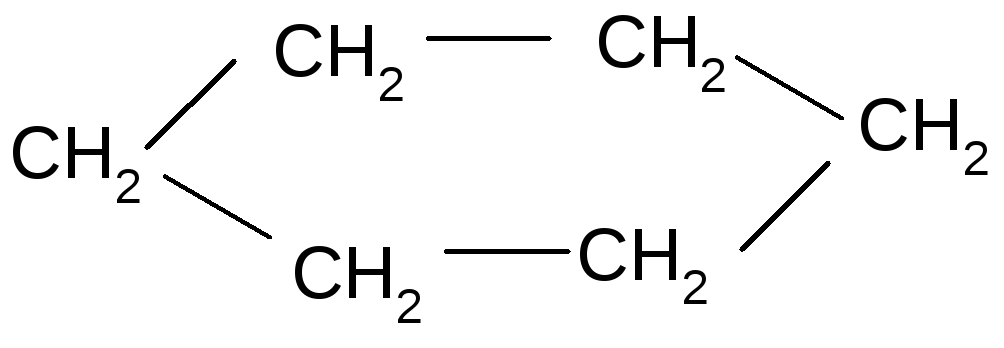 +Cl2,h
+Cl2,h
 -HCl
-HCl
1-хлорциклогексан
Алкены
Алкенами называются углеводороды, содержащие двойную С=С связь, общая формула СnH2n.
|
Название |
Структурная формула |
Брутто-формула |
|
Этен (этилен) Пропен (пропилен) Бутен-1 (бутилен) Бутен-2 (псевдобутилен) |
СН2 = СН2 СН2=СН-СН3 СН2=СН-СН2-СН3 СН3-СН=СН-СН3 |
С2Н4 С3Н6 С4Н8 С4Н8 |
Представители этого класса оказывают наркотическое действие; например, 2- метилбутен-2 по свойствам напоминает хлороформ.
Для алкенов характерна структурная (бутен-1 и бутен-2) и пространственная (геометрическая цис/транс) изомерия.
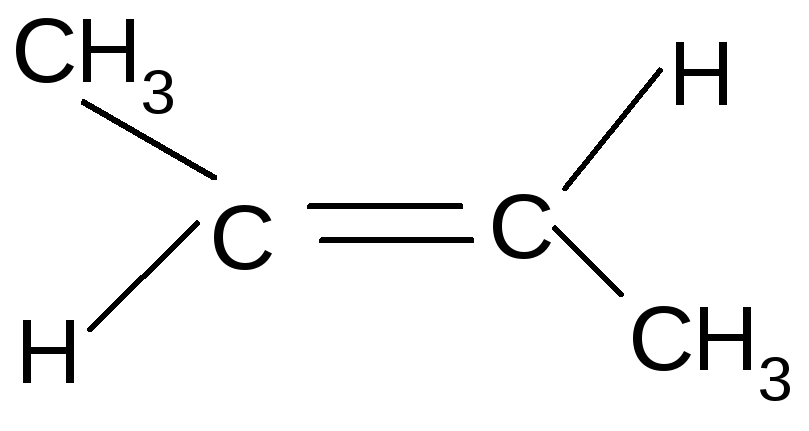
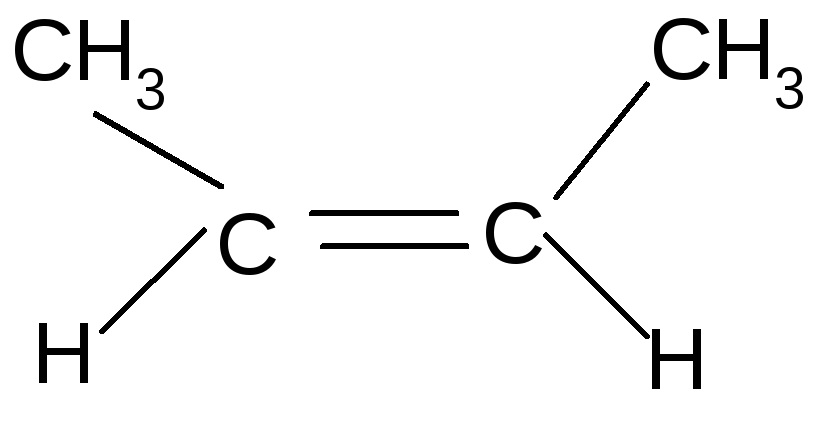
цис-бутен-2 транс-бутен-2
Реакционная способность алкенов определяется наличием двойной связи. Атомы углерода при двойной связи находятся в sp2гибридизации.
Т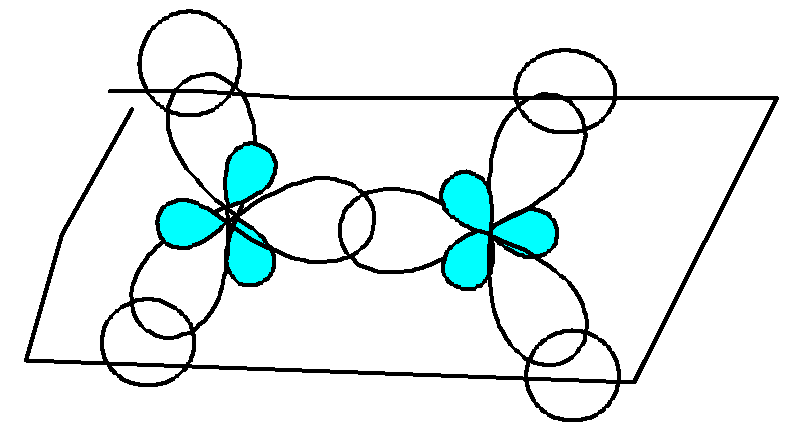 риsp2– гибридизованные
орбитали лежат в одной плоскости под
углом 120° и образуют три прочные-
связи. Негибридизованная-орбиталь,
перпендикулярная плоскости-
связей, участвует в образовании менее
прочной и легкополяризуемой-связи.
риsp2– гибридизованные
орбитали лежат в одной плоскости под
углом 120° и образуют три прочные-
связи. Негибридизованная-орбиталь,
перпендикулярная плоскости-
связей, участвует в образовании менее
прочной и легкополяризуемой-связи.
Строение этилена:
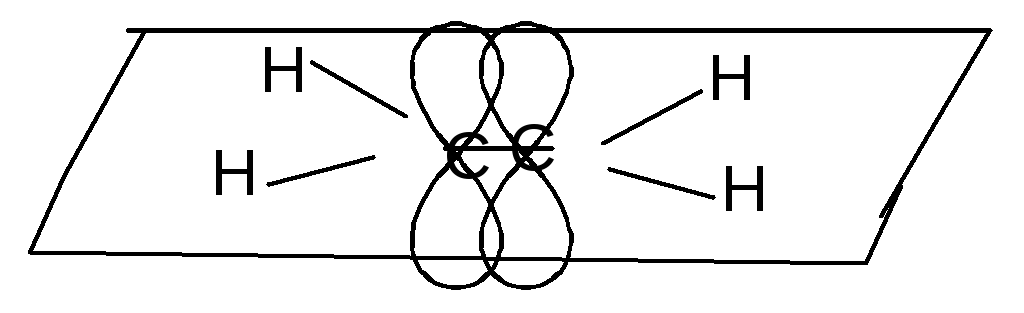
- связь - связи
Химические свойства.Для алкенов наиболее типичны реакции присоединения по месту разрыва-связи.-Cвязь в алкенах богата электронами, поэтому к ней будут притягиваться положительно заряженные йоны или частицы с дефицитом электронов –электрофилы (Е+).
Таким образом, для алкенов характерны реакции электрофильного присоединения АЕ.
